一株乳酸菌GF103的分离鉴定及体外益生效果评价
2012-12-20董晓丽张乃锋刁其玉聂明非
董晓丽 张乃锋 周 盟,2 屠 焰 刁其玉* 聂明非
(1.中国农业科学院饲料研究所,农业部饲料生物技术重点实验室,北京 100081;2.新疆农业大学动物科技学院,乌鲁木齐 830052)
自20世纪50年代以来,抗生素开始广泛应用于畜禽养殖业,其在保证动物健康、促进动物生长、节约饲料成本、提高经济效益等方面做出了巨大的贡献。近些年来,由于抗生素在畜禽养殖业中的长期使用,毒副作用和药物残留已影响到人类健康[1]。2006年,欧盟已经全面禁止了饲料中抗生素的使用,美国和日本等国家也对其做出了严格的限制。2011年,韩国全国禁止在动物饲料中添加抗生素。
随着人们对畜产品安全的不断重视以及环境保护意识的不断加强,益生菌作为抗生素的替代品备受关注,并越来越多地应用于动物营养和饲料中。益生菌是一类能改善动物胃肠道微生态平衡,有益于动物健康和生产性能发挥的微生物添加剂[2]。益生菌的作用效果主要表现在改善动物新陈代谢、提高营养物质吸收和利用、提高免疫力、减少环境污染等方面[3-4]。乳酸菌能够调节肠道微生物区系的平衡,增强机体的免疫力和抵抗力,促进肠道的生长和发育,是得到广泛应用的益生菌之一[5]。近年来,大量研究从菌株的安全性、抗病原菌的活性、耐酸和胆盐及对胃肠道的耐受性等方面进行体外评价益生菌的益生效果[6-8]。
本研究从北京大兴种猪场附近土壤中分离得到一株抑制大肠杆菌(Escherichia coli)和金黄色葡萄球菌(Staphylococcus aureus)生长的乳酸菌,编号为GF103。试验利用分子生物学手段鉴定乳酸菌GF103的菌种属性,并通过体外法评价其作为益生菌的益生效果,以期筛选出具有益生作用的乳酸菌,为替代抗生素提供选择。
1 材料与方法
1.1 菌株及培养基
菌株来源:采集于北京市大兴种猪场附近土壤。
MRS液体培养基:大豆蛋白胨10 g,牛肉膏10 g,酵母浸提物5 g,葡萄糖20 g,柠檬酸二铵2 g,乙酸钠 5 g,磷酸氢二钾 2 g,硫酸镁 0.1 g,硫酸锰0.05 g,吐温80 1 mL,用去离子水定容至1 000 mL,pH 为6.4,121 ℃灭菌 20 min。
MRS固体培养基:大豆蛋白胨10 g,牛肉膏10 g,酵母浸提物5 g,葡萄糖20 g,柠檬酸二铵2 g,乙酸钠 5 g,磷酸氢二钾 2 g,硫酸镁 0.1 g,硫酸锰0.05 g,吐温80 1 mL,琼脂15 g,用去离子水定容至1 000 mL,pH 为6.4,121 ℃灭菌20 min。
肉汤培养基:牛肉膏5 g,蛋白胨10 g,氯化钠5 g,用去离子水定容至 1 000 mL,pH 为 7.2,121℃灭菌20 min。
指示菌:大肠杆菌K88(Escherichia coli IVDC C83901),金黄色葡萄球菌(Staphylococcus aureus IVDC C56005)。指示菌购自中国兽医微生物保藏中心。
1.2 菌株分离与纯培养
取1 g土壤样品置于100 mL MRS液体培养基中[9],37 ℃、150 r/min培养24 h。取1 mL 培养液与灭菌生理盐水倍比稀释成 10-6、10-7、10-83个浓度梯度,取100μL涂布于MRS固体培养基平板,37℃培养24 h。用灭菌牙签挑取单菌落接种于50 mL MRS液体培养基中,37℃培养12 h,然后用接种针进行MRS固体培养基划线培养24 h。最后,挑取单株菌落接种于200 mL MRS液体培养基中,37℃培养24 h,获得单株乳酸菌培养液,4℃保存。
1.3 菌株的抗病原菌特性筛选
应用琼脂扩散的牛津杯法筛选具有抑菌活力的乳酸菌。将肉汤培养基中加入琼脂后,溶解均匀,高压灭菌,冷却到50℃左右,每20 mL培养基加入20μL新鲜培养的指示菌(108CFU/mL),混匀倒入培养皿冷却。用灭菌的镊子将无菌的牛津杯轻轻的放入培养皿中,在牛津杯中分别加入80μL单株乳酸菌培养液,另一个牛津杯中加入80μL无菌的MRS液体培养基作对照,37℃培养24 h。筛选出能够抑制指示菌的乳酸菌培养液,编号为GF103。其菌株称为乳酸菌GF103。
1.4 菌株的分子生物学鉴定
取10 mL乳酸菌GF103培养液,低速离心获得菌体。用细菌基因组DNA提取试剂盒[DP302,天根生化科技(北京)有限公司)提取细菌总DNA。
以10 ng纯化的细菌总DNA作为模板,扩增16S rRNA基因。所用引物为原核生物16S rRNA基因的通用引物:27F:5'-AGA GTT TGA TCC TGG CTC AG-3'和1492R:5'-TAC CTT GTT ACG ACT T-3'。引物由北京博迈德科技发展有限公司合成。PCR扩增体系为50μL,包括0.5μL Taq酶(0.5 U/mL)、5.0 μL 10 × Buffer、4.0 μL dNTP Mixture、1.0 μL 模板 DNA、1.0 μL 正向引物 27F(25 μmol/L)、1.0 μL 反 向 引 物 1492R(25 μmol/L)和37.5μL 重蒸水(ddH2O),扩增条件:95℃ 5 min;94 ℃ 30 s,55℃ 30 s,72℃2 min,30个循环;72℃ 7 min,4℃终止反应。PCR产物全序列由北京博迈德科技发展有限公司测定。
1.5 序列分析及系统发育树的构建
根据16S rRNA基因测序结果,使用Blast比对初步确定菌种。结合GenBank中乳酸菌属(Lactobacillus)中其他菌种的16S rRNA基因序列,利用MEGA 3.0软件,绘制系统发育树。
1.6 菌株的生长曲线及p H变化
将乳酸菌GF103培养液按1%(V/V)接种于装有MRS液体培养基的试管中,37℃进行培养,从0 h开始每隔2 h取3个试管(3个平行),24 h后分别于30、36、48 h各取3管,4℃保存。最后测定每管的pH和600 nm下的OD值(OD600nm)。
1.7 菌株耐酸和耐胆盐特性
为了检测乳酸菌GF103在低pH下的生长状态,用1 mol/L盐酸调节MRS液体培养基为不同pH 梯度,分别为 2.0、3.0、4.0、5.0、6.0、6.4。乳酸菌GF103培养液按1%(V/V)分别接种于不同pH的MRS液体培养基中,37℃培养24 h,测定OD600nm。
在MRS液体培养基中加入猪胆盐,使其浓度分别为 0(对照)、0.15%、0.30% 和 0.60% 。乳酸菌GF103培养液接种于上述不同浓度的MRS液体培养基中,37℃培养24 h,通过平板计数法计算活菌数。
1.8 菌株抗人工胃肠液的耐受性
人工胃液的配制[10]:9.5% ~ 10.5% 的盐酸16.4 mL,加水稀释,使 pH 达 3.0。每 100 mL 溶液中加入1.0 g胃蛋白酶,混匀,用0.2μm 无菌滤膜过滤。
人工肠液的配制[10]:称取磷酸二氢钾6.8 g,加水500 mL溶解,用0.4%的氢氧化钠溶液调pH至6.8,加水稀释至1 000 mL,每100 mL液体中加入1.0 g胰蛋白酶,混匀,用0.2μm无菌滤膜过滤。
将乳酸菌GF103培养液分别接种于人工胃液或人工肠液中,37℃、140 r/min摇床培养,分别在0、30、180 min进行活菌平板计数。
1.9 统计分析
试验数据均为3个平行的平均值,数据经Excel初步处理后,利用SAS 8.01统计软件ANOVA进行分析,差异显著性用Duncan氏法进行多重比较。
2 结果
2.1 乳酸菌的分离筛选
抗病原菌试验显示,筛选出的乳酸菌GF103能够抑制大肠杆菌和金黄色葡萄球菌的生长(图1)。

图1 乳酸菌GF103的抗病原菌特性Fig.1 Antimicrobial property of Lactobacillus sp.GF103
2.2 16S r RNA基因序列分析与系统发育树构建
乳酸菌GF103 16S rRNA基因测序后,提交到GenBank,获得序列登录号为JQ411248。测得序列进行Blast比对,结果该菌株与GenBank中的Lactobacillus plantarum strain 033(登 录 号:JN560899.1)相似性为99%。将乳酸菌 GF103 16S rRNA基因序列与GenBank数据库中的部分细菌的16S rRNA基因序列(菌株号见发育树)进行同源性比对,应用MEGA 3.0软件构建系统发育树(图2)。结果显示,乳酸菌GF103与植物乳杆菌(Lactobacillus plantarum)亲缘关系最近,其次是短乳杆菌(Lactobacillus brevis),消化乳杆菌(Lactobacillus alimentarius)。初步确定乳酸菌GF103为植物乳杆菌(Lactobacillus plantarum)。
2.3 菌株的生长曲线和p H变化
将乳酸菌GF103培养液按1%(V/V)接种后,每隔2 h取样测定发酵液的pH及OD600nm,以发酵时间为横坐标,以OD600nm为纵坐标绘制菌株生长曲线(图3),并以pH为纵坐标制作pH的变化曲线(图4)。从图3可以看出,乳酸菌GF103的生长曲线几乎看不到延滞期,在培养2 h后进入对数生长期,培养8 h时,生长速度降低,但是仍然缓慢生长,培养12 h后开始进入稳定期,培养48 h未见到衰亡期。这与图4所示的随着时间推移,菌液的pH变化趋势相符合。即乳酸菌GF103生长的前8 h时,菌液的pH迅速下降,说明菌株生长较快,发酵产生的酸较多;12 h后,pH趋于稳定。
2.4 菌株的耐酸性和耐胆盐的特性
从图5可以看出,乳酸菌GF103在pH=5以上生长正常;在pH=3和4时,活菌数稍微下降,仍保留大量活菌数;在pH=2时,活菌数显著下降,菌株的生长受到影响。
乳酸菌GF103在胆盐浓度为0.15%、0.30%下生长状况很好,与对照组差异不显著(P>0.05);在浓度为0.60%胆盐中生长时,活菌数极显著下降(P<0.01,表1)。由此可以看出,乳酸菌GF103能够耐受0.3%浓度的胆盐。
2.5 菌株对人工胃肠液的耐受性
从表2可以看出,乳酸菌GF103在人工胃液中生长0.5 h时,活菌数不受影响(P >0.05),生长3 h时活菌数降低大约1 log值(P<0.01);乳酸菌GF103在人工肠液中生长3 h,活菌数没有显著变化(P>0.05),能够完全抵抗人工肠液的影响。
3 讨论
目前,生产中使用的饲用微生物添加剂较多,常用的菌种有芽孢杆菌、乳酸菌和酵母菌等。本研究用MRS培养基分离出单株乳酸菌培养液,并筛选出能够抑制大肠杆菌和金黄色葡萄球菌生长的乳酸菌GF103,通过16S rRNA基因序列分析鉴定其为植物乳杆菌。
微生物典型生长曲线分为延滞期(适应期)、对数期、稳定期和衰亡期4个时期[11],一般微生物制剂的研制中,常采集其生长对数期中后期和稳定期的菌液。了解菌株的生长曲线以便培养适当生长时间的菌液。从乳酸菌GF103生长曲线中可以看出,在MRS培养基中生长10 h后活菌数较高,稳定性很好,且菌液的pH达到稳定的状态,适合用于制备微生物添加剂。
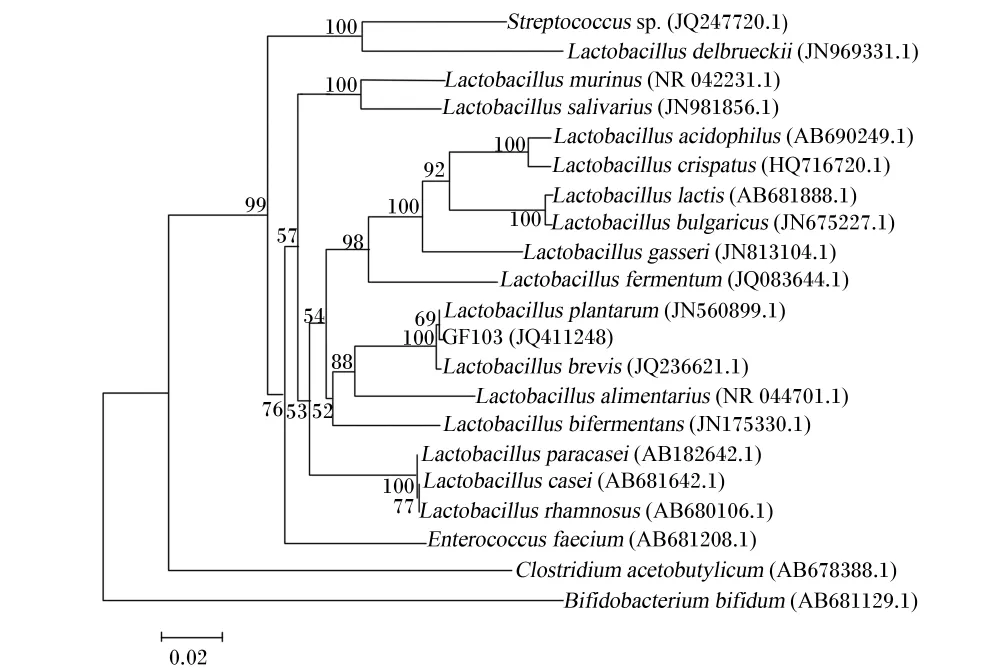
图2 依据16S r RNA序列构建的乳酸菌GF103和同属相关种的系统发育树Fig.2 Phylogenetic tree of Lactobacillus sp.GF103 and related Lactobacillus sp.based on 16S rRNA sequence

图3 乳酸菌GF103的生长曲线Fig.3 Growth curve of Lactobacillus sp.GF103

图4 乳酸菌GF103生长的pH变化Fig.4 The pH variation of Lactobacillus sp.GF103

图5 不同p H下乳酸菌GF103的生长情况Fig.5 Growth of Lactobacillus sp.GF103 under different pH conditions
益生菌要耐受胃环境低pH,才可能进入动物肠道存活并增殖,发挥其益生作用[12]。通过耐酸试验发现乳酸菌GF103在pH=2时受到严重影响,活菌数严重下降,但在pH=3时,能保持大量的活菌数。据吴惠芬等[13]报道,仔猪出生时胃内pH在5~6之间,2月龄前胃内pH保持在3左右。因此,乳酸菌GF103能够耐受动物胃内低酸环境。胆盐的耐受性也是检测益生菌益生作用的重要指标。猪消化道中的胆盐含量为 0.03% ~0.30%[14],十二指肠中的胆汁酸盐对外源细菌具有抑制作用,细菌在肠道的存活和增殖,必须能够耐受0.3%胆盐的环境[15]。前期研究表明,一些乳酸菌能够耐受一定浓度的胆盐[16-17]。本研究中,乳酸菌GF103在胆盐浓度为0.3%浓度下生长状况与对照组没有显著差异,即能够耐受动物体内胆盐等形成的高渗透压环境。

表1 乳酸菌GF103在不同浓度胆盐中培养24 h的活菌数Table 1 Viable counts of Lactobacillus sp.GF103 in bile salt with different concentrations after 24 h

表2 乳酸菌GF103在人工胃肠液中的活菌数Table 2 Viable counts of Lactobacillus sp.GF103 in simulated gastrointestinal fluid
耐酸试验验证了乳酸菌GF103能够耐受胃内低酸环境。但是胃中还有胃蛋白酶等一些其他因素的影响。于是笔者通过人工模拟胃液检测菌株的生长状况,乳酸菌GF103在人工胃液中生长0.5 h活菌数不受影响,3 h活菌数降低1 log值。乳酸菌GF103能够在人工模拟胃液中存活,由此笔者推测该菌株作为益生菌能够顺利通过胃环境而不至于导致活性完全损失。乳酸菌在动物胃肠道存活和增殖的另一个瓶颈就是必须能够经受小肠液对菌体的破坏作用[9],抵制胆盐和胰液素对它的毒害作用。耐胆盐的试验已经证明乳酸菌GF103能够耐受动物体内最高胆盐浓度0.3%。模拟人工肠液的试验证明,乳酸菌GF103能够耐受小肠液的环境,从而为菌株在肠道中存活和增殖成为可能。目前已有很多报道[18-20],利用体外方法筛选出能够耐酸、耐胆盐,并能抵抗人工模拟胃肠道液的益生菌,如芽孢杆菌、乳酸菌等,并通过饲喂动物证明其能够提高动物生长性能、减少腹泻、改善动物免疫力等。
4 结论
综合本试验的结果得知,乳酸菌GF103对病原菌大肠杆菌和金黄色葡萄球菌具有明显的抑制作用。通过16S rRNA基因序列分析鉴定乳酸菌GF103属于植物乳杆菌。体外评价其具有益生菌的耐酸、耐胆盐的特性,能适应动物胃肠道内环境。因此,可进一步研究其作为微生物添加剂对动物生长性能的影响。
[1] 吕桂霞,李春蕾,曹雁行,等.国内饲用抗生素替代品的研究简况[J].兽药与饲料添加剂,2008,13(4):12-14.
[2] FULLER R.Probiotics in human medicine[J].Gut,1991,32(4):439 -442.
[3] ROLFE R D.The role of probiotic cultures in the control of gastrointestinal health[J].The Journal of Nutrition,2000,130(2):396 -402.
[4] VERSCHUERE L,ROMBAUT G,SORGELOOS P,et al.Probiotic bacteria as biological control agents in aquaculture[J].Microbiology and Molecular Biology Reviews,2000,64(4):655 -671.
[5] 章文明,汪海峰,刘建新.乳酸杆菌益生作用机制的研究进展[J].动物营养学报,2012,24(3):389-396.
[6] COLLADO M C,SANZ Y.Method for direct selection of potentially probiotic Bifidobacterium strains from human feces based on their acid-adaptation ability[J].Journal of Microbiological Methods,2006,66(3):560-563.
[7] MISHRA V,PRASAD D N.Application of in vitro methods for selection of Lactobacillus casei strains as potential probiotics[J].International Journal of Food Microbiology,2005,103(1):109 -115.
[8] ACHARYA M R,SHAH R K.Selection of human isolates of Bifidobacteria for their use as probiotics[J].Applied Biochemistry and Biotechnology,2002,102/103:81-98.
[9] 张国庆,董晓芳,佟建明,等.一株芽孢杆菌的分离和鉴定[J].微生物学通报,2010,37(8):1159-1163.
[10] HUANG C H,QIAO S Y,LI D F,et al.Effects of lactobacilli on the performance,diarrhea incidence,VFA concentration and gastrointestinal microbial flora of weaning pigs[J].Asian-Australasian Journal of Animal Sciences,2004,17(3):401 -409.
[11] PRESCOTT L M,HARLEY JP,KLEIN D A.Microbiology(5th ed.)[EB/OL].[S.l.]:McGraw-Hill Higher Education,2002[2012 - 07 - 27].http://highered.mcgraw - hill.com/sites/0072320419/student_view0/glossary_a - f.html.
[12] 刘虹,姚文,于卓腾,等.一组鸡源乳酸杆菌产乳酸及其耐受特性研究[J].微生物学通报,2006,33(5):1-5.
[13] 吴惠芬,毛胜勇,姚文,等.2株猪源乳酸菌对低pH值和胆盐耐受性及热稳定性研究[J].华中农业大学学报,2005,24(3):265 -268.
[14] WASSON K,CRILEY JM,CLABAUGH M B,et al.Therapeutic efficacy of oral lactobacillus preparation for antibiotic-associated enteritis in guinea pigs[J].Contemporary Topics in Lab oratory Animal Science,2000,39(1):32 -38.
[15] HYRONIMUSB,LE MARREC C,SASSIA H,et al.Acid and bile tolerance of spore-forming lactic acid bacteria[J].International Journal of Food Microbiology,2000,61(2/3):193 -197.
[16] PETAJA E,MYLLYNIEMI P,PETAJA P,et al.Use of inoculated lactic acid bactria in fermenting sour cabbage[J].Agricultural and Food Science in Finland,2000,9(1):37 -48.
[17] CHOI M H,PARK Y H.Selective control of lactobacilli in kimchi with nisin[J].Letters in Applied Microbiology,2000,30(3):173 -177.
[18] GIANG H H,VIET T Q,OGLE B,et al.Growth performance,digestibility,gut environment and health status in weaned piglets fed a diet supplemented with potentially probiotics complexes of lactic acid bacteria[J].Livestock Science,2010,129:95 -103.
[19] ROSS G R,GUSILS C,OLISZEWSKI R,et al.Effects of probioctics administration in swine[J].Journal of Bioscience and Bioengineering,2010,109(6):545-549.
[20] YU H F,WANG A N,LI X J,et al.Effect of viable Lactobacillus fermentum on the growth performance,nutrient digestibility and immunity of weaned pigs[J].Journal of Animal and Feed Science,2008,17:1761-1769.
