不同产地丹参药材HPLC指纹图谱分析及4种菲醌类成分含量的比较
2012-12-14高俊飞
袁 晓,高俊飞,袁 萍
(中国科学院武汉植物园,湖北武汉430074)
中药丹参为唇形科(Labiatae)植物丹参(Salvia miltiorrhiza Bge.)的干燥根及根茎,为常用中药材之一[1],主要产于安徽、河南、陕西、江苏、四川、河北、山东和浙江等省。丹参药材中主要含水溶性酚酸类与脂溶性菲醌类2大类成分,但仅对这2类成分进行检测,尚不足以有效控制丹参药材的质量。为了有效评价流通领域的丹参药材质量,已有研究者将多种仪器分析技术应用于丹参指纹图谱的研究,并试图从不同角度探讨丹参药材指纹图谱的特征性与专属性[2-4]。近10年来,对丹参药材的质量检测研究主要包括提取工艺和指纹图谱2个方面。
目前,获取指纹图谱的主要方法有色谱法、光谱法、X射线衍射法和分子生物技术等,其中,色谱技术是近年来发展较快、应用较广泛的分析方法之一。高效液相色谱(HPLC)技术通过流动相的梯度洗脱,表征中药材中多种化学成分的综合信息,具有分离效能高、分析速度快等特点,已被广泛用于多种植物的指纹图谱分析[5-8]。
作者采用HPLC方法获得7个产地丹参药材的HPLC指纹图谱,并据此初步建立了丹参药材HPLC指纹图谱的共有模式谱;在此基础上,对来源于7个产地的丹参药材中4种菲醌类成分(包括二氢丹参酮Ⅰ、丹参酮Ⅰ、隐丹参酮和丹参酮ⅡA)的含量进行检测和分析,以期为丹参药材的质量检测和真伪辨别提供实验依据。
1 材料和方法
1.1 材料
于2009年10月至12月分别在山东、河北、河南、陕西、安徽、四川和甘肃7个省份采集或收购丹参药材,经中国科学院武汉植物园吴金清研究员鉴定。
实验使用的主要仪器包括L-2000型高压液相色谱仪(日本日立公司)、万分之一电子分析天平(上海奥豪斯仪器有限责任公司)、JK5200DB型数控超声波清洗器(合肥金尼克机械制造有限公司)和微型植物试样粉碎机(河北黄骅市中兴仪器有限公司)。使用的二氢丹参酮Ⅰ(dihydrotanshinoneⅠ)、丹参酮Ⅰ(tanshinoneⅠ)、隐丹参酮(cryptotanshinone)和丹参酮ⅡA(tanshinoneⅡA)标准品均由湖北省药品检验所提供,乙腈为色谱纯级(美国TEDIA公司),水为双重蒸馏水,其余试剂均为分析纯。
1.2 方法
1.2.2 标准品溶液制备及标准曲线绘制 精密称取二氢丹参酮Ⅰ、丹参酮Ⅰ、隐丹参酮和丹参酮ⅡA标准品适量,加入适量甲醇,分别配制成质量浓度0.08、0.02、0.01 和0.04 mg·mL-1的标准品溶液。分别精密吸取4种标准品溶液各1、2、5、7和10 μL进样,按照上述色谱条件对标准品溶液进行HPLC分析。以峰面积为纵坐标Y、标准品溶液的进样量为横坐标X绘制标准曲线。其中,获得的二氢丹参酮Ⅰ的线性方程为Y=1 913 134 943X-11 354;丹参酮Ⅰ的线性方程为Y=369 303 783X-6 045;隐丹参酮的线性方程为Y=1 954 057 167X-6 228;丹参酮ⅡA的线性方程为Y=2 323 839 427X-49 154。
1.2.3 供试样品溶液制备和HPLC分析 参照文献[7-8]的方法进行供试样品溶液的制备。将丹参药材粉碎后过60目筛,精密称定药材粉末1.00 g,加入30 mL甲醇,混匀后置于40℃水浴中用超声波辅助提取30 min,冷却至室温并用甲醇补足减失的质量,于6 000 r·min-1离心 10 min,取上清液,用 0.45 μm微孔滤膜过滤,滤液即为供试样品溶液。按照上述色谱条件,取供试样品溶液直接进样,进行HPLC分析。
1.2.4 方法学考察
1.2.4.1 精密度实验 选取山东产供试样品溶液,按照上述色谱条件进样分析,连续进样6次。8个共有色谱峰相对保留时间的RSD值均小于2.51%,相对峰面积的RSD值均小于1.73%,表明仪器精密度达到HPLC指纹图谱检测的要求。
1.2.4.2 重复性实验 取山东产供试样品溶液6份,分别按照上述色谱条件进样分析。6份样品8个共有峰的相对保留时间和相对峰面积无显著差异,RSD值分别小于2.75%和1.43%,表明该方法重复性良好,符合HPLC指纹图谱检测的要求。
1.2.4.3 稳定性实验 参考文献[9-10]的方法进行稳定性实验。取山东产供试样品溶液6份,分别于室温条件下放置0、2、4、6、12 和 24 h,按照上述色谱条件进样分析。8个共有峰相对保留时间的RSD值均小于2.71%,相对峰面积的RSD值均小于1.56%,表明在24 h内供试样品溶液的成分稳定,符合HPLC指纹图谱检测的要求。
1.2.4.4 加样回收率实验 参考文献[11]的方法进行加样回收率实验。分别精密称取山东产丹参药材粉末1.00 g、二氢丹参酮Ⅰ标准品约5 mg、丹参酮Ⅰ标准品约3 mg、隐丹参酮标准品约8 mg和丹参酮ⅡA标准品约3 mg,用甲醇溶解并定容至50 mL,用0.45 μm微孔滤膜过滤后待用,按此法平行制备6份滤液,按照上述色谱条件进样分析。采用外标法计算样液中二氢丹参酮Ⅰ、丹参酮Ⅰ、隐丹参酮和丹参酮ⅡA的含量并计算加样回收率,加样回收率的平均值依次为99.5%、99.4%、101.2% 和 100.5%,RSD 值依次为 0.2%、0.1%、0.5%和 0.8%。
1.3 数据处理和分析
根据7个产地丹参样品的HPLC指纹图谱中各共有峰的相对峰面积,计算平均比值;以各产地的峰面积平均值计算相关系数和夹角余弦的值。将不同产地丹参指纹图谱数据导入2004版“中药指纹图谱相似度”软件计算系统,计算其相似度。
2 结果和分析
2.1 不同产地丹参药材的HPLC指纹图谱及其共有模式谱分析
通过对7个产地丹参供试样品溶液的HPLC分析,对测定的峰数、峰面积值和保留时间等相关参数进行分析和比较,制定优化的丹参HPLC指纹图谱。7个样品的HPLC色谱图均有21个色谱峰,其中8个为共有特征峰(图1),与标准品对比后可确定4、5、6和7号峰分别为二氢丹参酮Ⅰ、丹参酮Ⅰ、隐丹参酮和丹参酮ⅡA。这8个共有特征峰可作为判别丹参质量的群体特征峰,其中4号峰分离度良好、保留时间居中、峰面积稳定,故将其作为参照峰。以4号峰为参照峰构建的丹参药材HPLC指纹图谱的共有模式谱(即特征指纹图谱)见图2。
必须使H型钢对正,不应出现中心偏斜。一般施焊时先焊下部,为了补偿这部分焊接过程中所造成的上缩,应把H型钢的上部间隙放大0.5~2.0mm,作为反变形量。如发现有缺陷,必须铲平重焊。
2.2 不同产地丹参药材HPLC指纹图谱中共有峰的相对保留时间及相对峰面积分析
以4号峰为参照峰,经计算获得的7个产地丹参样品HPLC指纹图谱中各共有峰的相对保留时间和相对峰面积分别见表1和表2。
结果表明:不同产地丹参样品中同一成分的相对保留时间基本相同,RSD值均小于0.086%,表明不同产地丹参药材的成分组成差异不大。而不同产地丹参样品间同一成分的相对峰面积却有较大差异,例如,甘肃产样品中1号峰的相对峰面积最大(0.766),山东和四川产样品中1号峰的相对峰面积最小(仅0.003),前者是后者的255倍,表明不同产地丹参样品中同一成分的含量有明显差异。
图谱相似度计算结果表明:产自甘肃、山东、河北、河南、安徽、四川和陕西的丹参药材的HPLC指纹图谱与共有模式谱的相似度均较高,相似度值分别为0.916、0.932、0.926、0.973、0.948、0.922 和 0.918。
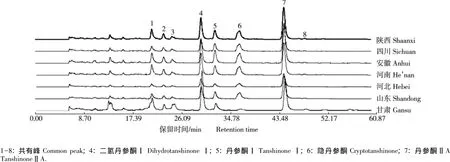
图1 来源于7个产地的丹参药材HPLC色谱图Fig.1 HPLC chromatogram of medicinal materials of Salvia miltiorrhiza Bge.from seven locations
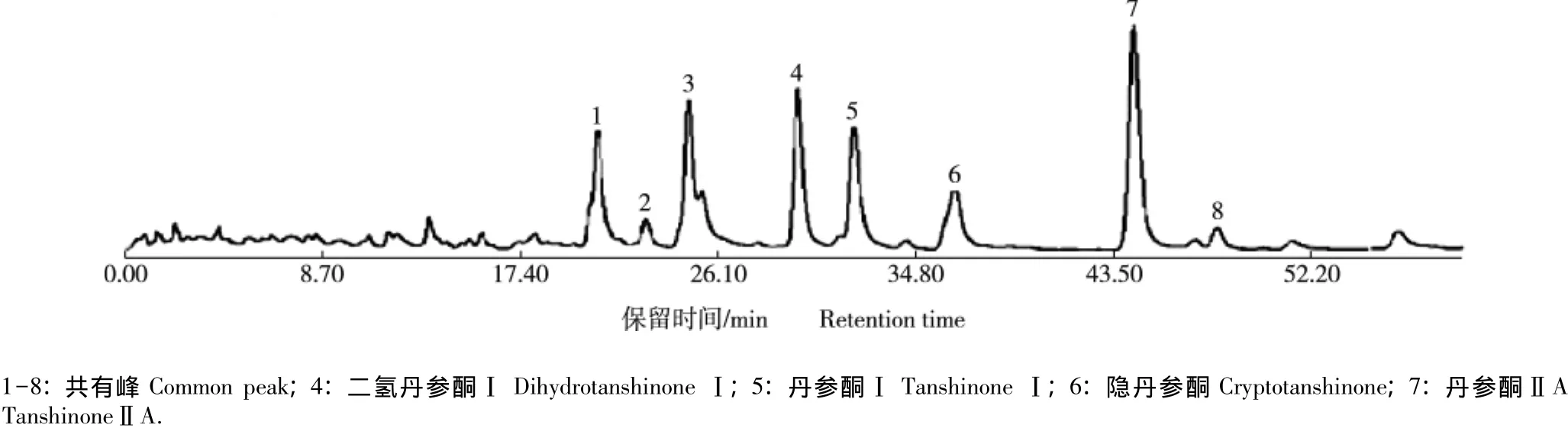
图2 丹参药材HPLC指纹图谱的共有模式谱(以4号峰为参照峰)Fig.2 Common pattern of HPLC fingerprint of medicinal materials of Salvia miltiorrhiza Bge.(taking No.4 peak as the reference peak)
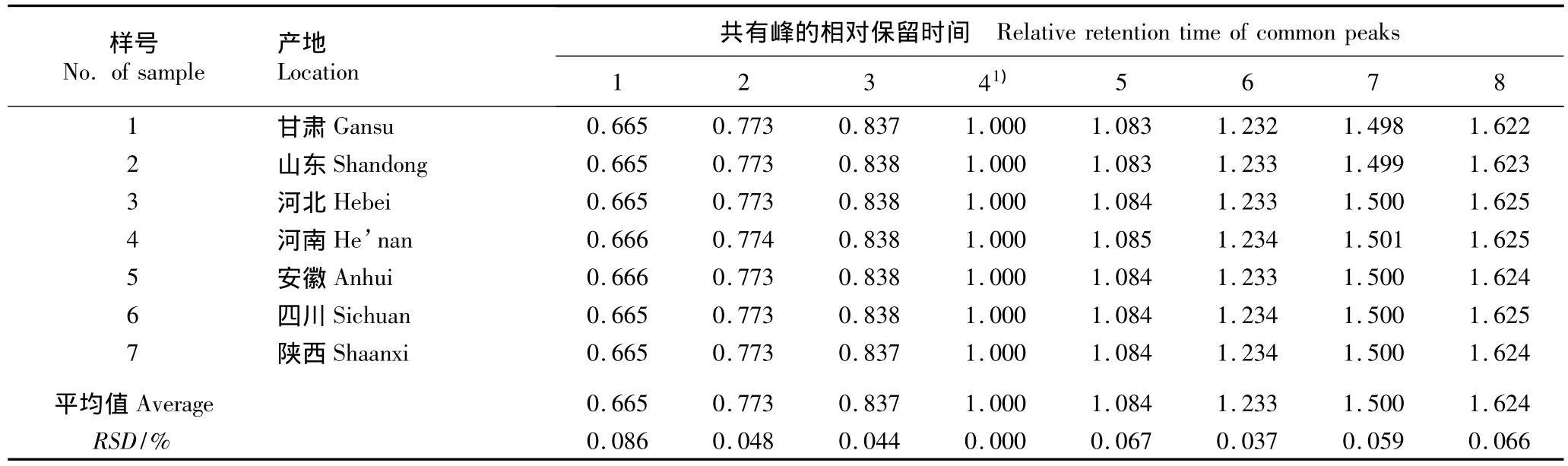
表1 不同产地丹参药材HPLC指纹图谱中共有峰的相对保留时间Table 1 Relative retention time of common peaks in HPLC fingerprint of medicinal materials of Salvia miltiorrhiza Bge.from different locations
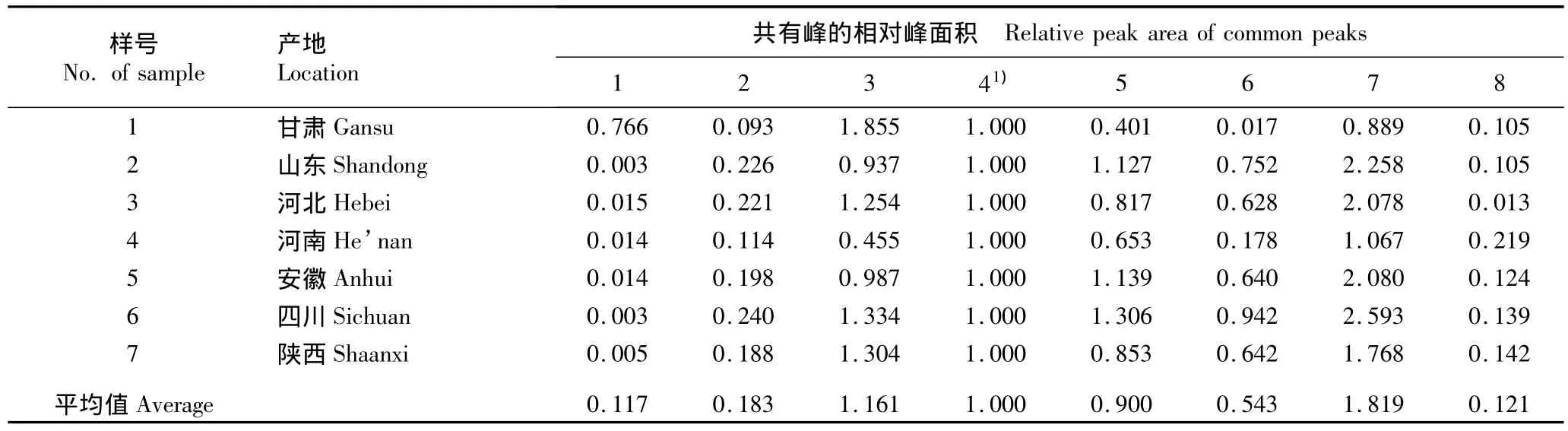
表2 不同产地丹参药材HPLC指纹图谱中共有峰的相对峰面积Table 2 Relative peak area of common peaks in HPLC fingerprint of medicinal materials of Salvia miltiorrhiza Bge.from different locations
2.3 丹参药材中4种菲醌类成分的含量分析
在供试丹参药材的HPLC色谱图中可以确定4个色谱峰为菲醌类成分,即4、5、6和7号峰,分别为二氢丹参酮Ⅰ、丹参酮Ⅰ、隐丹参酮和丹参酮ⅡA。来源于7个产地的丹参药材中这4种菲醌类成分的相对含量见表3。
由表3可见:不同产地丹参药材中这4种成分的相对含量有很大差异。由产地间的比较看,河南产丹参药材中这4种菲醌类成分的相对含量均最高,安徽、甘肃和陕西产丹参药材中这4种成分的相对含量也均较高,而河北产丹参药材中均最低。
由表3还可见:不同产地丹参药材中这4种菲醌类成分的含量组成均有一定差异,其中,隐丹参酮含量在7个产地药材中均最低;甘肃产丹参药材中二氢丹参酮Ⅰ含量最高,丹参酮ⅡA含量次之;河北、河南及陕西产丹参药材中均为丹参酮ⅡA含量最高,二氢丹参酮Ⅰ含量次之;山东、安徽和四川产丹参药材中均为丹参酮ⅡA含量最高,丹参酮Ⅰ含量次之。
比较结果表明:不同产地丹参药材中菲醌类成分整体含量有明显差异,且各成分间的含量比例也有明显差异,这种差异可能与不同产地丹参药材的质量差异有关。
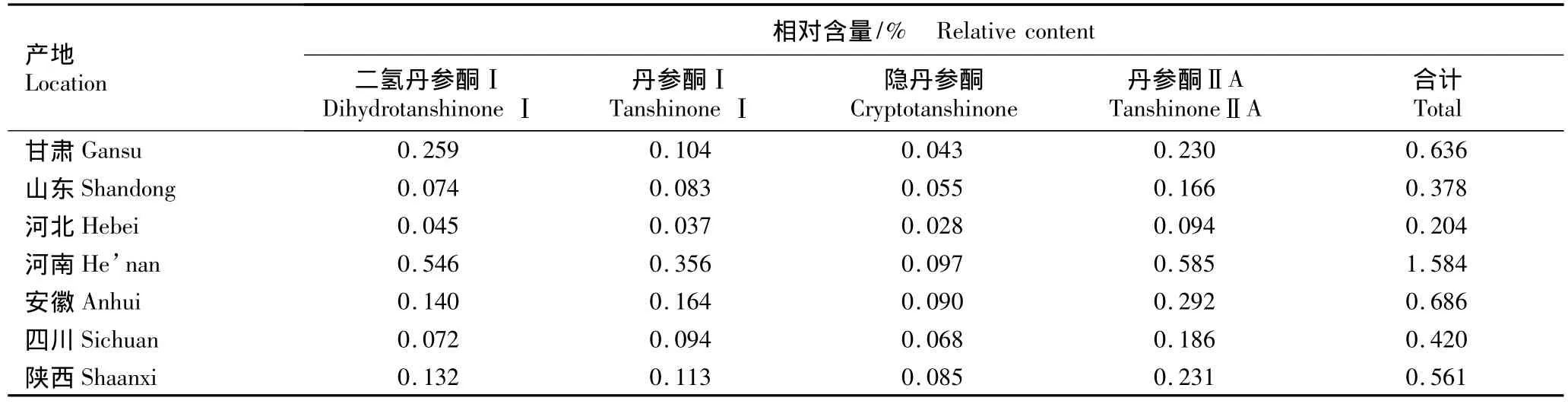
表3 来源于7个产地的丹参药材中4种菲醌类成分的相对含量Table 3 Relative content of four phenanthraquinone compounds in medicinal materials of Salvia miltiorrhiza Bge.from seven locations
3 结 论
研究结果表明:不同产地丹参药材的HPLC指纹图谱与其共有模式谱的相似性良好,相似度值为0.916~0.973,说明在同一年份采集的不同产地丹参药材的成分基本稳定。
河南产丹参药材中二氢丹参酮Ⅰ(0.546%)、丹参酮Ⅰ(0.356%)、隐丹参酮(0.097%)和丹参酮ⅡA(0.585%)的相对含量均高于其他产地,而来源于河北的丹参药材中二氢丹参酮Ⅰ(0.045%)、丹参酮Ⅰ(0.037%)、隐丹参酮(0.028%)和丹参酮ⅡA(0.094%)的相对含量则最低,表明不同产地丹参药材中有效成分含量及比例差异极大。
在丹参药材的HPLC色谱图中共有21个峰,其中有8个较明显且分离度较好的共有峰,由这8个共有峰构成了丹参药材的HPLC指纹图谱的共有模式谱。本方法操作简单且稳定性良好,建议以此共有模式谱作为丹参药材真伪辨别的标准之一。
[1]国家药典委员会.中华人民共和国药典:2010年版(一部)[M].北京:中国医药科技出版社,2010:70.
[2]孙国祥,王荧荧,孙金山.三级系统指纹定量法评价丹参五波长 HPLC指纹图谱[J].中南药学,2010,8(11):863-868.
[3]王立萍,周凤琴.近十年来丹参指纹图谱的研究进展[J].齐鲁药事,2009,28(2):101-103.
[4]LI Y G,SONG L,LIU M,et al.Advancement in analysis of Salviae miltiorrhizae Radix et Rhizoma(Danshen)[J].Journal of Chromatography A,2009,1216(11):1943-1953.
[5]孙国祥,孙金山,赵 新.丹参水溶性成分HPLC数字化指纹图谱研究[J].中南药学,2008,6(3):355-360.
[6]唐旭利,刘 静,李国强,等.丹参药材水溶性成分HPLC化学指纹图谱研究[J].中成药,2008,30(3):313-317.
[7]王 鸣,肖超成,陈 雨,等.不同产地茅苍术水溶性成分的HPLC指纹图谱研究[J].植物资源与环境学报,2009,18(1):12-15.
[8]李胜南,高山林,蒋 桃.太子参商品药材及其四倍体植株块根的高效液相指纹图谱[J].植物资源与环境学报,2007,16(2):36-39.
[9]周毅生,孟 江,咸银库,等.丹参多酚酸HPLC指纹图谱研究[J].中国药房,2009,20(27):2118-2119.
[10]罗国安,梁琼麟,王义明,等.中药指纹图谱质量评价、质量控制与新药研发[M].北京:化学工业出版社,2009.
[11]国家药品监督管理局.中药注射剂指纹图谱研究的技术要求(暂行)[J].中成药,2000,22(10):671.
