基于RAPD标记的南苍术居群遗传多样性分析
2012-12-14郭建林葛燕芬孙小芹李密密杭悦宇
郭建林,葛燕芬,孙小芹,李密密,夏 冰,杭悦宇
〔江苏省·中国科学院植物研究所(南京中山植物园)江苏省植物迁地保护重点实验室,江苏南京210014〕
中国传统中药材苍术为菊科(Compostiae)苍术属(Atractylodes DC.)植物南苍术〔A.lancea(Thunb.)DC.〕和北苍术〔A.chinensis(DC.)Koidz.〕的干燥根[1]。迄今为止,对苍术原植物的分类处理仍有一定的争议。《中国高等植物图鉴》[2]将药材苍术的原植物定为南苍术和北苍术;而《中国植物志》[3]和《Flora of China》[4]则将南苍术和北苍术合并为苍术〔A.lancea(Thunb.)DC.〕。
南苍术又称茅苍术,主要分布于江苏、浙江、安徽和湖北等狭小区域内,传统认为江苏茅山地区为南苍术的道地产区。由于没有进行规模性栽培,南苍术的野生资源遭到掠夺式采挖,使得南苍术特别是茅山的南苍术野生资源濒临枯竭[5]。因而,有研究者建议将野生茅苍术列入珍稀濒危保护植物名录中[6]。
已有研究表明:道地与非道地南苍术在挥发油含量及组成上有明显不同,江苏分布的南苍术挥发油的主成分是苍术酮和苍术素,而湖北分布的南苍术挥发油的主成分则是苍术醇和 β-桉叶醇[7-11];王鸣等[12]的研究结果显示:江苏产南苍术水溶性成分中主要含有苍术苷A,与湖北产茅苍术水溶性成分中的主成分有一定差异;但张贝贝等[13]综合考虑南苍术中苍术素、β-桉叶醇、苍术素醇和苍术内酯Ⅱ含量指标,认为主产地南苍术的质量优于道地产区。为明确苍术的遗传变异状况,任冰如等[14]采用RAPD标记对10个苍术居群的遗传关系进行了分析,结果显示供试的7个南苍术居群和3个北苍术居群均具有较近的遗传关系,南苍术和北苍术之间的差异较小,支持将北苍术定为变种;郭兰萍等[15]也采用RAPD方法对南苍术和北苍术进行了研究,结果表明苍术的化学成分和遗传分化与其地理分布均有一定的相关性,以地域为界划分南苍术和北苍术有一定的道理。由此可见,不同产地南苍术的有效成分均具有一定的变异,其药材质量与产地存在一定的相关性,对其药材道地性的确认难以有统一的标准,且对中药苍术原植物分类地位的确认仍较为混乱。
为了进一步明确苍术种下遗传变异状况,了解不同产地南苍术的遗传差异,作者利用RAPD分子标记技术对南苍术主要分布区(包括江苏、湖北和安徽)7个野生居群的遗传多样性和遗传分化水平进行了比较,并采用聚类分析法对居群的遗传关系进行了分析,以期为中药苍术原植物的确定及其药材道地性的研究提供分子水平的实验依据。
1 材料和方法
1.1 材料
于2003年11月、2006年4月和6月分别在湖北、江苏和安徽7个南苍术野生居群中确定28个样株,样株间距离不小于20 m;分别采集每一样株的新鲜幼嫩叶片,用硅胶快速干燥后常温密封保存、待用。采集样品均经江苏省·中国科学院植物研究所杭悦宇研究员鉴定,基本采集信息见表1。
DNA纯化回收试剂盒购自北京莱博生物实验材料研究所;RAPD引物由上海Invitrogen生物技术公司合成;10×PCR buffer(含Mg2+)、dNTPs和 Taq DNA 聚合酶均购自上海申能博彩生物科技有限公司;100 bp DNA ladder为Fermentas公司产品。使用的主要仪器有PE-9600型PCR扩增仪(美国Perkin Elmer公司)和WV-BP330型凝胶扫描分析系统(江苏捷达科技发展有限公司)。
1.2 方法
1.2.1 总DNA 提取及纯化 参照 Paterson等[16]的CTAB法提取基因组总DNA,并加以改进。取1~3 g叶片,置入液氮中研磨至粉末状,加入65℃提取缓冲液650 μL,65℃温育1 h,期间每隔10 min轻轻摇晃1次;加入V(三氯甲烷)∶V(异戊醇)=24∶1混合液650 μL,轻轻颠倒摇晃后于室温下静置5~10 min;于4℃、12 000 r·min-1离心12 min,取上清液,加入2倍体积的无水乙醇,于-20℃冰箱中放置2 h;4℃、12 000 r·min-1离心 12 min,取沉淀;用体积分数70%乙醇洗涤沉淀,于4℃、12 000 r·min-1离心5 min,弃上清液,DNA沉淀自然风干;将获得的DNA粗样用DNA纯化回收试剂盒进行纯化后溶解于无菌双蒸水中,-20℃贮藏、备用。1.2.2 PCR扩增反应及产物检测 以江苏湖山居群3个单株的基因组总DNA为模板进行RAPD引物筛选,从80条RAPD引物中选取18条扩增条带丰富、信号强且稳定性高的引物对所有单株的基因组总DNA进行PCR扩增。
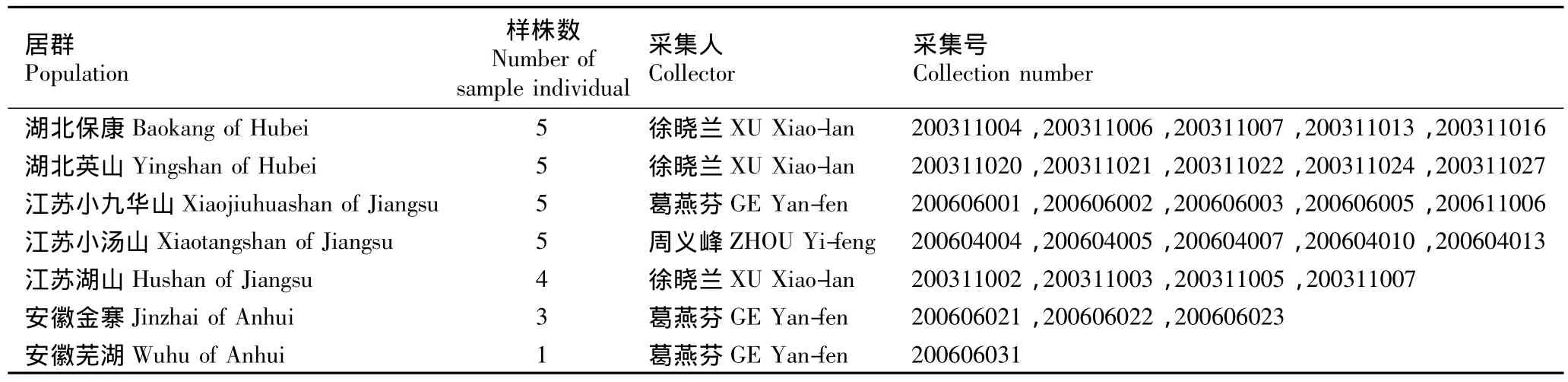
表1 供试南苍术7个居群的基本采集信息Table 1 Basic collection information of seven populations of Atractylodes lancea(Thunb.)DC.tested
PCR反应在PE-9600型 PCR扩增仪上进行。反应体系总体积为20 μL,包括模板 DNA 30 ng、10×PCR buffer(含 Mg2+)2.0 μL、10 mmol·L-1dNTPs 0.3 μL、5 μmol·L-1引物 2.0 μL 和 5 U·μL-1Taq DNA聚合酶 0.2 μL,用灭菌双蒸水补足至 20 μL。
扩增反应程序为:94℃预变性3 min;94℃变性45 s,38 ℃退火30 s,72 ℃延伸90 s,共 38 个循环;最后于72℃延伸5 min。反应结束后将产物置于4℃保存。
将PCR扩增产物用质量体积分数1.4%的琼脂糖凝胶(含0.5 μg·mL-11×EB)电泳 1.5 h,用 WVBP330型凝胶扫描分析系统进行观察和拍照。电泳时以100 bp DNA ladder作为分子量标记。
1.3 数据分析
将重复性好、清晰且迁移率相同的条带作为同源位点进行处理,有条带的位点记为“1”、无条带的位点记为“0”,转化为二元数据矩阵;应用 POPGENE v1.31软件计算有效等位基因数(Ne)、Nei’s基因多样性指数(H)、Shannon信息指数(I)、基因分化系数(Gst)和基因流(Nm);采用UPGMA法对7个居群28个单株间的遗传关系进行聚类分析;居群内单株间和地区间、居群间的变异通过DCFA 1.1软件和AMOVA法进行计算[17]。
2 结果和分析
2.1 RAPD扩增结果分析
利用筛选出的18条RAPD引物、以南苍术7个居群28个单株的基因组总DNA为模板进行PCR反应,扩增结果详见表2。由表2可见:引物E-04扩增出的条带数最少,仅有4条,且没有扩增出多态性条带;引物AB-05和B-08扩增出的条带数最多,达到15条,且引物B-08扩增出的多态性条带数最多,达到13条;引物AH-15扩增出的多态性条带百分率最高,达到90.00%。28个单株18条引物共扩增出193条重复性好且清晰的条带,其中多态性条带有111条;平均每条引物扩增出10.72条带,其中多态性条带6.17条;多态性条带百分率的平均值为57.51%,表明南苍术种内遗传多样性及遗传变异程度较低。
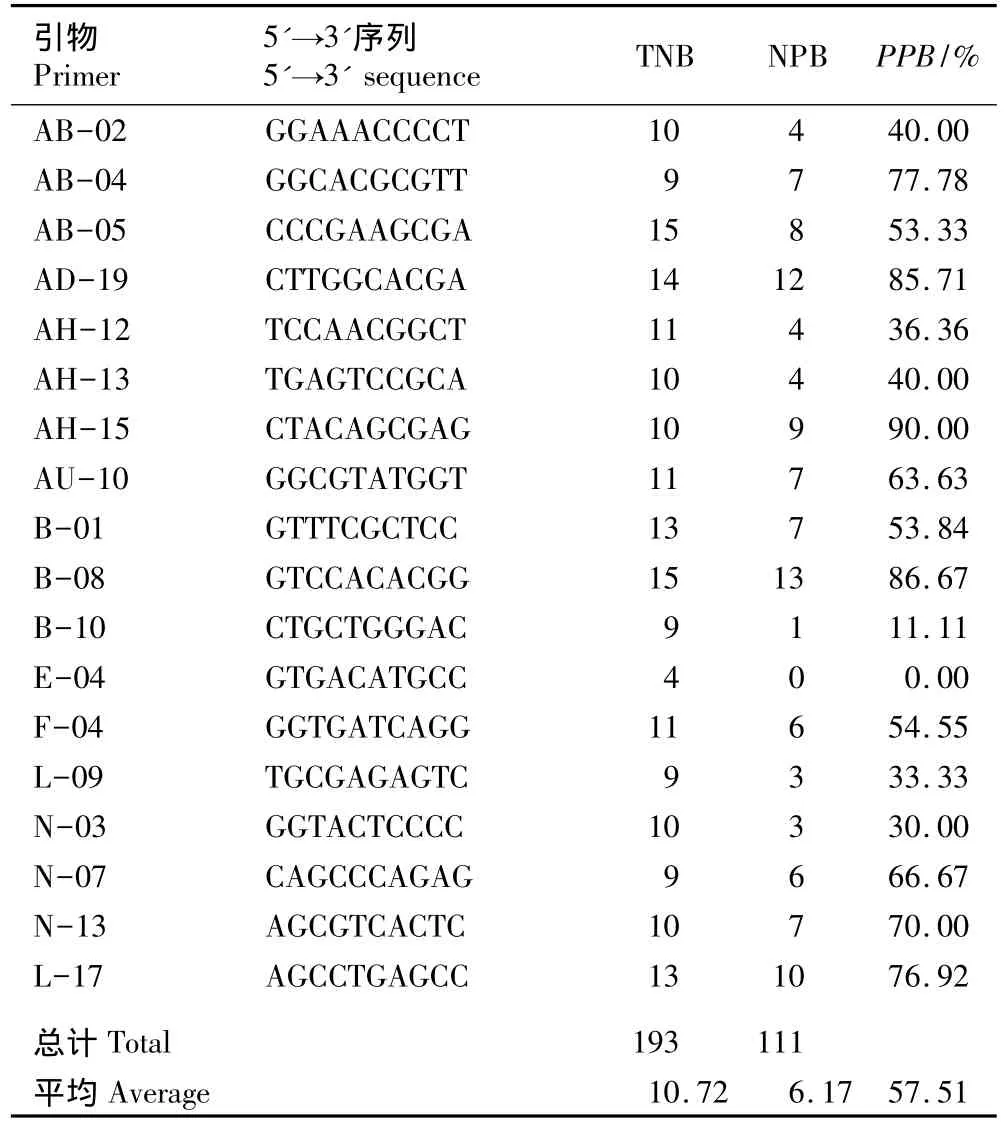
表2 用于南苍术RAPD-PCR反应的引物序列及其扩增结果1)Table 2 Primersequencesused forRAPD-PCR reaction of Atractylodes lancea(Thunb.)DC.and their amplification results1)
2.2 居群遗传多样性分析
南苍术7个居群的遗传多样性指数见表3。结果表明:从省级水平看,多态性条带百分率最高的为江苏(45.60%),湖北次之(44.04%)、安徽(19.17%)最低;而有效等位基因数、Nei’s基因多样性指数和Shannon信息指数均为湖北最高、江苏次之、安徽最低。从居群水平看(芜湖居群只有1个单株,无法计算各指标,因此不进行统计),各居群多态性条带百分率由高到低依次排序为湖北保康、湖北英山、江苏小九华山和湖山、江苏小汤山、安徽金寨,而各居群有效等位基因数、Nei’s基因多样性指数和Shannon信息指数由高到低则均依次排序为湖北保康、湖北英山、江苏湖山、江苏小九华山、江苏小汤山、安徽金寨。从7个居群的总水平看,南苍术的多态性条带百分率、有效等位基因数、Nei’s基因多样性指数和Shannon信息指数分别为 57.51%、1.317 4、0.187 2 和 0.282 7,表明南苍术居群间的遗传多样性水平较低。
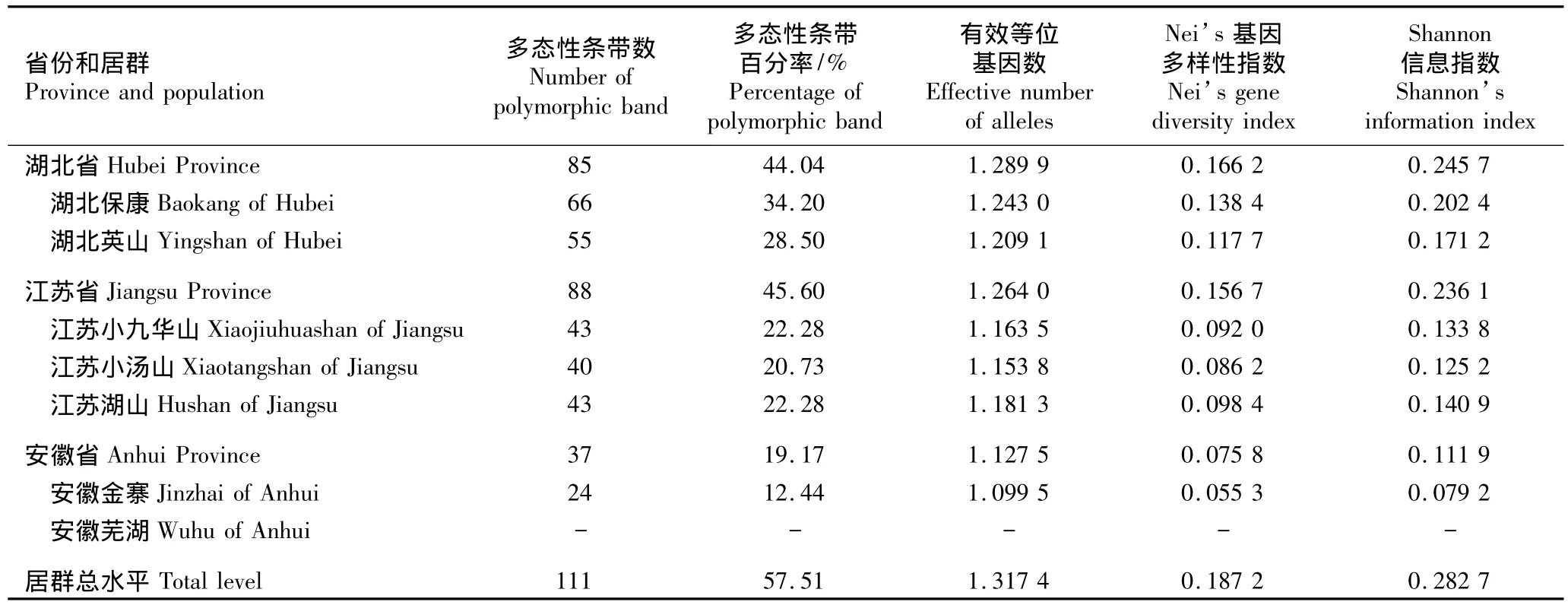
表3 南苍术7个居群的遗传多样性指数Table 3 Genetic diversity indexes of seven populations of Atractylodes lancea(Thunb.)DC.
2.3 居群间的聚类分析
基于RAPD标记分析结果获得的南苍术7个居群的遗传距离见表4。由表4可见:7个居群间的遗传距离为0.150 7~0.252 1,其中,安徽金寨和安徽芜湖2个居群间的遗传距离最小,仅为0.150 7;江苏湖山和安徽芜湖2个居群间的遗传距离大,为0.252 1。
基于RAPD扩增结果,应用POPGENE v1.31软件对7个居群28个南苍术单株进行聚类分析,结果见图1。聚类分析结果表明:来自同一个居群的单株均聚在一起,表明南苍术同一居群单株间的遗传变异较小,遗传背景相似。根据聚类结果,7个居群首先可分为2组:第1组仅有湖北保康居群,显示湖北保康居群与其他居群间有较远的遗传关系;第2组包含其余的6个居群,其中,安徽芜湖居群的1个单株与安徽金寨居群聚在一起,表明它们之间可能具有较近的遗传关系;湖北英山居群与江苏小九华山居群首先聚在一起,随后依次与江苏小汤山、安徽金寨居群聚类,最后才与江苏湖山居群聚在一起,表明江苏湖山居群与江苏其他2个居群具有一定的遗传距离,而湖北英山居群与江苏小九华山居群具有较近的遗传关系,由此看出7个居群的聚类结果与居群的地理分布无明显关系。

表4 基于RAPD标记分析的南苍术7个居群的遗传距离1)Table 4 Genetic distance among seven populations of Atractylodes lancea(Thunb.)DC.based on RAPD marker analysis1)

图1 基于Nei’s遗传距离的南苍术7个居群28个单株的聚类图Fig.1 Cluster dendrogram of 28 individuals of Atractylodes lancea(Thunb.)DC.from seven populations based on Nei’s genetic distance
2.4 居群间的遗传分化分析
采用AMOVA法对供试南苍术7个居群进行遗传变异方差分析,结果表明:地区间、地区内居群间及居群内的变异分别占总变异的8.39%、29.88%和61.74%。而用POPGENE v1.31软件计算出的基因分化系数(Gst)为0.206 5,即7个居群总的遗传变异主要发生在居群内(79.35%),总变异的20.65%来自居群间,比AMOVA法的分析结果略低。基因流(Nm)为1.921 5,说明供试南苍术7个居群间没有产生明显的遗传分化。
3 讨 论
聚类分析结果显示:位于湖北西部罗田地区的保康居群单独成组,说明该居群的遗传分化较其他居群明显;而属于大别山区的湖北英山和安徽金寨居群与属于茅山地区的江苏小九华山、江苏小汤山和江苏湖山居群聚为一组,表明后5个居群遗传关系较近。这一结果与郭兰萍等[18]的“湖北房县与江苏句容的南苍术居群聚为一类”的研究结论相近,但与任冰如等[14]的“大别山区英山居群与其他各居群的遗传距离最大”的结论有较大差异。南苍术是一个外部形态多变且受地理-气候环境影响很大的类群,有很多过渡类型,例如,胡世林等[19]报道了在大别山区邻近的湖北罗田有1个稳定的种下变异类群,定名为罗田苍术(Atractylodes lancea subsp.luotlanensis Hu et Feng);彭华胜等[20]也认为大别山区外缘的低山地区(如桐城等地)分布的是典型的南苍术的原形态类型,而在安徽潜山、舒城、岳西和金寨等地则分布着南苍术和罗田苍术的过渡类型。而从本研究结果看,湖北保康居群也与其他居群有较大的遗传距离,存在种下变异的可能,其与其他居群的分类关系有待确定。
Bussell[21]基于 RAPD 数据分析了 35 种植物(其中29个为异交植物)的遗传结构,结果表明:异交植物基因分化系数(Gst)的平均值为0.193,6种自交植物Gst的平均值为0.625。本研究中,各居群间的遗传变异并不大,Gst为0.206 5,略高于异交植物Gst的平均值,但远低于自交植物 Gst的平均值(0.59)[22]。Hogbin等[23]认为:异交物种的遗传变异大多分布在群体内,群体间的遗传变异通常占27%以下。本实验结果与之相符。
基因流(Nm)对居群内遗传变异的分化有重要影响,具有有限基因流的物种其遗传分化往往大于那些具有广泛基因流的物种。一般认为:Nm大于1,说明基因流能抑制居群内遗传漂变的作用,防止居群分化;Nm小于1,说明遗传漂变可导致居群明显的遗传分化[24-25]。南苍术 7 个居群的 Nm为 1.921 5,远低于异交和风媒植物 Nm的平均水平(5.380)[26],但略高于一般广布种的 Nm水平 (1.881)[27]。按照Slatkin[24]和 Hamrick 等[26]的观点,若每代迁入个体数的Nm大于1,说明基因流足以抵制遗传漂变的作用,同时也可防止居群分化的发生。在植物中,基因流是借助花粉、种子、孢子、植株个体以及其他携有遗传物质的物体为媒介进行的,其中花粉和种子的扩散是2种最主要的形式[28]。苍术是自交不亲和植物,主要靠昆虫传粉,异花授粉的结实率约为60%,且果实结实率受虫害及天气的影响很大,危害率达80%~90%,种子寿命仅为1 ~2 d[29-31],因此,南苍术居群间通过花粉与种子进行基因交流的概率比较小,这也是居群间遗传分化不大的原因之一。
综上所述,7个南苍术居群整体的遗传多样性水平偏低,居群间遗传分化不大,但由于它们在生物学特性及次生代谢产物组成上存在一定的差异,因而,建议可根据各居群主要成分的药理作用选择使用。
[1]国家药典委员会.中华人民共和国药典:2010年版(一部)[M].北京:中国医药科技出版社,2010:150.
[2]中国科学院植物研究所.中国高等植物图鉴:第4册[M].北京:科学出版社,1975:601-602.
[3]中国科学院中国植物志编辑委员会.中国植物志:第七十八卷第一分册[M].北京:科学出版社,1987:23-28.
[4]WU Z Y,RAVEN P H,HONG D Y.Flora of China:Vol.20/21[M].Beijing:Science Press,2011:40.
[5]贺善安,贺慧生,吕 晔,等.茅苍术资源的保护和利用[J].植物资源与环境,1993,2(1):1-6.
[6]宗世贤,袁昌齐,金九宁.江苏省稀有濒危药用植物的现状和保护[J].中国野生植物资源,1996(1):1-5.
[7]TAKEDA O,MIKI E,TERABAYASLLI S,et al.Variation of essential oil components of Atractylodes lancea growing in China[J].Natural Medicines,1995,49(1):18-23.
[8]吉 力,敖 平,潘炯光,等.苍术挥发油的气相色谱-质谱联用分析[J].中国中药杂志,2001,26(3):182-185.
[9]郭兰萍,刘俊英,吉 力,等.茅苍术道地药材的挥发油组成特征分析[J].中国中药杂志,2002,27(11):814-819.
[10]欧阳臻,杨 凌,宿树兰,等.茅苍术挥发油的气相色谱-质谱指纹图谱研究[J].药学学报,2007,42(9):968-972.
[11]徐晓兰,冯 煦,王 鸣,等.野生与栽培茅苍术挥发油成分的比较分析[J].植物资源与环境学报,2007,16(1):28-30.
[12]王 鸣,肖超成,陈 雨,等.不同产地茅苍术水溶性成分的HPLC指纹图谱研究[J].植物资源与环境学报,2009,18(1):12-15.
[13]张贝贝,方 婧,许海玉,等.HPLC测定道地产地和主产地茅苍术中β-桉叶醇及其他成分的含量[J].中国实验方剂学杂志,2011,17(8):116-118.
[14]任冰如,贺善安,於 虹,等.用RAPD技术评估苍术居群间的亲缘关系[J].中草药,2000,31(6):458-461.
[15]郭兰萍,黄璐琦,王 敏,等.南北苍术的RAPD分析及其划分的初步探讨[J].中国中药杂志,2001,26(3):156-158.
[16]PATERSON A H,BRUBAKER C L,WENDEL J F.A rapid method for extraction of cotton(Gossypium spp.)genomic DNA suitable for RFLP or PCR analysis[J].Plant Molecular Biology Reporter,1993,11(2):122-127.
[17]张富明,葛 颂.群体遗传学研究中的数据处理方法Ⅰ.RAPD数据的AMOVA分析[J].生物多样性,2002,10(4):438-444.
[18]郭兰萍,黄璐琦,蒋有绪,等.苍术遗传结构的RAPD分析[J].中国药学杂志,2006,41(3):178-181.
[19]胡世林,冯学锋,吉 力,等.苍术及其异域变种[J].中草药,2000,31(10):781-784.
[20]彭华胜,王德群.南苍术与野生白术的开花动态研究[J].现代中药研究与实践,2007,22(3):20-22.
[21]BUSSELL J D.The distribution of random amplified polymorphic DNA(RAPD)diversity among populations of Isotoma petraea(Lobeliaceae)[J].Molecular Ecology,1999,8(5):775-789.
[22]NYBOM H.Comparison of different nuclear DNA markers for estimating intraspecific genetic diversity in plants[J].Molecular Ecology,2004,13(5):1143-1155.
[23]HOGBIN P M,PEAKALL R.Evaluation of the contribution of genetic research to the management of the endangered plant Zieria prostrata[J].Conservation Biology,1999,13(3):514-522.
[24]SLATKIN M.Gene flow and the geographic structure of natural populations[J].Science,1987,236:787-792.
[25]刘占林,李 珊,阎桂琴,等.华山新麦草自然居群的遗传结构和种内遗传多态性研究[J].遗传学报,2001,28(8):769-777.
[26]HAMRICK J L,GODT M J W.Allozyme diversity in plant species[M]∥BROWN A H D,CLEGG M T,KAHLER A L,et al.Plant Population Genetics,Breeding and Genetic Resources.Sunderland:Sinauer Assoc Inc.,1995:43-63.
[27]HAMRICK J L.Gene Flow and Distribution of Genetic Variation in Plant Population[M].New York:Academes Press,1987:53-67.
[28]黄璐琦.分子生药学[M].2版.北京:北京大学医学出版社,2006:415-416.
[29]徐友贵,黄 弛.茅苍术野生资源研究[J].基层中药杂志,1989,3(3):4-5.
[30]徐友贵,田中联,王小明,等.茅苍术生物学特性研究初报[J].中国中药杂志,1992,17(1):18-20.
[31]范瑞红,徐 君,刘 征,等.苍术人工栽培技术[J].中国林副特产,2010(5):77-78.
