水稻Xa21基因启动子序列分析及其在不同条件下的表达特征
2012-12-14牟少亮刘志钦蔡汉阳何水林
牟少亮,刘志钦,赖 燕,蔡汉阳,何水林
(福建农林大学:a.生命科学学院,b.作物遗传改良与综合利用教育部重点实验室,c.作物科学学院,福建福州350002)
在自然生态环境中植物遭受各种病害的危害,并在长期进化过程中形成复杂的抗病机制,包括PTI(PAMP triggered immunity)和ETI(effector triggered immunity)2种彼此相互关联的抗病反应[1-2]。其中ETI是由抗性基因R(resistance gene)介导的专化性抗病反应,与PTI相比,其强度大而持久。目前已经克隆获得多种植物的R基因并对其抗病功能进行了分析,结构分析结果表明:这些R基因可分成NBSLRR、eLRR-TM、eLRR-TM-pkinase、STK(serinethreonine kinase)和其他5大类型[3]。它们的作用符合“基因对基因”学说,在植物抗病基因工程中具有重要的应用价值,但迄今为止对这些抗病基因表达及调控机制的研究报道还很少[4]。
水稻(Oryza sativa L.)是重要的粮食作物之一,白叶枯病〔Xanthomonas campestris pv.oryzae(Ishiyama)Dye〕是水稻生产上仅次于稻瘟病〔Magnaporthe oryzae(Hebert)Barr.〕的主要病害,不仅可导致水稻大幅度减产,而且还影响稻米品质[5]。由于其危害严重,化学防治难以奏效,因此,培育抗病品种是有效防治水稻白叶枯病的重要手段之一[6]。目前,已报道的水稻白叶枯病抗性基因有30多个[7],其中,Xa21基因是最早克隆的水稻白叶枯病广谱抗性基因,属于STKLRR类抗性基因,定位于水稻第11号染色体。Xa21基因编码的蛋白可以通过胞外LRR(leucine-rich repeat)域识别病原物的无毒基因编码产物,然后将信号传导到细胞内活化STK的表达,进而激活细胞内的防御反应[7-8]。研究表明:Xa21基因可下调其信号通路上游调节蛋白的编码基因,激活PR(pathogenesisrelated)基因表达[9];Xa21基因介导的抗病反应受发育时期的调控,植株在2叶期感病、5叶期有75%抗病、9叶期之后完全抗病[10]。虽然关于Xa21基因的表达已有报道[10-11],但这些研究结果存在争议。
为了进一步阐明水稻Xa21基因的表达及其调控机制,作者以水稻品种‘日本晴’(‘Nipponbare’)为实验材料,对Xa21基因5'端的上游启动子进行克隆及序列分析,并获得了其与GUS(β-葡萄糖苷酸酶)报告基因的转基因水稻T1代株系,通过分析转基因水稻中GUS基因表达的组织和器官特异性及其对不同逆境和逆境相关激素信号分子的应答情况,确定水稻Xa21基因5'端上游启动子的表达特性,以期为抗白叶枯病水稻品种的育种研究奠定实验基础。
1 材料和方法
1.1 材料
实验用水稻品种‘日本晴’、大肠杆菌〔Escherichia coli(Migula)Castellani et Chalmers〕菌株DH10B和根癌农杆菌〔Agrobacterium tumefaciens(Smith et Towns.)Conn.〕菌株EHA105均为本实验室保存的实验材料;pMD18-T质粒和DL2000均购自宝生物工程(大连)有限公司;pDNOR-207和pMDC163质粒由瑞士苏黎世大学Curtis教授惠赠。
1.2 方法
1.2.1 启动子克隆和测序 参照GenBank上公布的水稻品种‘日本晴’基因组DNA序列进行上、下游引物的设计,其中,上游引物Xa21-F序列为5'-AGA GTTGCTGCCCCTTGAT-3',下游引物Xa21-R序列为5'-GTGCAAGCTAAGACAGCAAGA-3'。
参照文献[12]采用CTAB法提取基因组总DNA,并以其为模板进行PCR扩增。扩增反应在Tgradient型PCR仪(德国Biometra公司)上进行。反应体系总体积为 50 μL,包括0.2 μg 模板 DNA、10×PCR buffer 5 μL、2.5 mmol·L-1dNTPs 2 μL、10 μmol·L-1上下游引物各2 μL和5 U·μL-1Ex Taq DNA聚合酶0.4 μL,用灭菌双蒸水补足至50 μL。扩增程序为:95℃预变性5 min;94℃变性30 s,54℃退火40 s,72℃延伸2 min,共计35个循环;最后于72℃延伸10 min。
扩增反应结束后将获得的PCR产物用质量体积分数1%琼脂糖凝胶进行电泳检测,以DL2000为Marker;采用天根生化科技(北京)有限公司生产的DNA纯化回收试剂盒进行产物回收,并将回收产物连接到pMD-18T载体上,交送北京三博远志生物技术有限公司测序。
1.2.2 GUS融合表达载体的构建 利用Gateway技术[13],分别以 pDNOR-207和 pMDC163为入门载体和目的载体,构建Xa21基因启动子的GUS融合表达载体。PCR验证采用Xa21基因启动子的特异扩增引物,验证正确后转化到根癌农杆菌EHA105菌株中用于水稻遗传转化。
1.2.3 水稻遗传转化及转基因植株的获得 以水稻品种‘日本晴’的成熟胚为受体材料,参照Toki等[14]的方法进行愈伤组织的诱导和转化。从获得的转基因水稻植株中提取DNA,利用潮霉素基因特异引物HypF和HypR进行PCR验证,其中,上游引物HypF序列为5'-ACACAGCCATCGGTCCAGAC-3',下游引物HypR序列为5'-ATCTTAGCCAGACGAGCGGG-3'。
1.2.4 GUS检测与定量分析 根据潮霉素基因特异引物对转基因水稻的PCR验证结果,收集阳性植株的T1代种子;选择T1代种子分离比接近3∶1的株系进行Xa21基因启动子驱动的GUS活性的组织染色和定量分析。参照Jefferson[15]的方法,对T1代转基因水稻的根、茎和叶分别进行GUS组织化学染色分析,GUS染色液包含0.2 mol·L-1磷酸钠缓冲液(pH 7.0)、0.1 mol·L-1铁氰化钾、0.1 mol·L-1亚铁氰化钾、1.0 mol·L-1乙二胺四乙酸二钠和质量体积分数0.1%X-Gluc。取T1代转基因水稻的根、茎和叶,并在不同发育时期(水稻3叶期、5叶期和8至9叶期)采集叶片,参照曾凡锁等[16]的分光光度法测定GUS活性,以1 min内使PNPG(4-硝基苯基-β-D-吡喃半乳糖苷)水解生成1 nmol·L-1对硝基苯酚的酶量为1个酶活力单位。
1.2.5 对转基因植株的处理方法 收获的T1代转基因种子经潮霉素抗性筛选后进行培养,7~8 d后将正常萌发的绿色幼苗移栽至装有土壤的塑料花盆中,待幼苗长到4至5叶期时分别进行各种处理,对照组植株不进行任何处理,然后取样按照上述方法进行GUS定量分析。机械损伤处理方法:用解剖刀在幼苗叶片上切割数处2~3 cm伤口,12 h后取叶片进行GUS活性测定。干旱处理方法:停止浇水,48 h后待幼苗叶片出现微蔫状态时取叶片进行GUS活性测定。激素处理方法:分别用500 μmol·L-1水杨酸(SA)、100 μmol·L-1脱落酸(ABA)和100 μmol·L-1茉莉酸甲酯(MeJA)进行叶面喷洒,每株10 mL,12 h后取叶片进行GUS活性测定。
1.3 数据处理
采用Excel 2003和SPSS 10.0软件对实验数据进行统计和处理;GUS活性为10个单株的平均值。
2 结果和分析
2.1 水稻Xa21基因启动子的克隆和序列分析
以水稻品种‘日本晴’为实验材料,通过PCR扩增得到1条长1 982 bp的片段(图1),将该片段的测序结果(图2)与GenBank上报道的水稻品种‘日本晴’的序列进行比对,显示二者的序列同源性百分率为99.7%。将获得的此片段序列登录至启动子顺式元件预测网站 (http:∥bioinformatics.psb.ugent.be/webtools/plantcare/html/)进行分析[17],结果表明:除了启动子的基本元件(TATA-box和CAAT-box)外,在该片段上还预测到一些逆境信号相关元件,如:GCC-box(乙烯应答元件)、A-box(顺式调控元件)、TC-rich repeats(逆境应答元件)、MBS(MYB结合位点)、LTR(低温应答元件)和W-box(病原菌应答元件),表明扩增获得的水稻Xa21基因启动子可能在外界逆境胁迫时具有诱导能力。
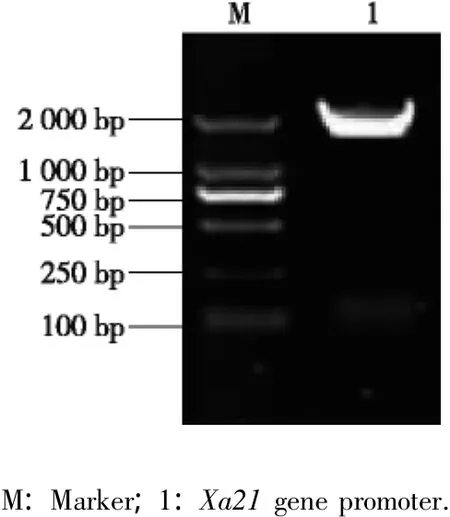
图1 水稻品种‘日本晴’Xa21基因启动子的PCR扩增结果Fig.1 PCR amplification result of Xa21 gene promoter of cultivar‘Nipponbare’of Oryza sativa L.
2.2 在转基因水稻中Xa21基因启动子的表达特征

图2 水稻品种‘日本晴’Xa21基因启动子序列及其相关元件Fig.2 Sequence of Xa21 gene promoter of cultivar‘Nipponbare’of Oryza sativa L.and its related elements

图3 T1代转基因水稻不同器官GUS活性的组织化学染色结果Fig.3 Histochemical staining result of GUS activity in different organs of T1 strain of transgenic rice(Oryza sativa L.)
2.2.1 在不同器官中的表达特征 GUS组织化学染色分析结果表明(图3):在T1代转基因水稻的根、茎和叶中都能检测到GUS活性,特别是在根尖的中柱组织中GUS活性明显高于其他组织(图3-D),具有一定的组织表达特异性。而GUS活性定量检测结果显示(表1):转基因水稻幼苗根的GUS活性是叶片的2.31倍,且二者间的差异达到极显著水平(P<0.01);茎的GUS活性是叶片的1.93倍,二者间的差异达到显著水平(P<0.05);根的GUS活性略高于茎,但二者间的差异不显著(P>0.05)。
表1 T1代转基因水稻不同器官中GUS活性比较(±SD)1)Table 1 Comparison of GUS activity in different organs of T1 strain of transgenic rice(Oryza sativa L.)(±SD)1)

表1 T1代转基因水稻不同器官中GUS活性比较(±SD)1)Table 1 Comparison of GUS activity in different organs of T1 strain of transgenic rice(Oryza sativa L.)(±SD)1)
1)同列中不同的小写和大写字母分别表示在0.05和0.01水平上差异显著Different small letters and capitals in the same column indicate the significant difference at 0.05 and 0.01 levels,respectively.
?
2.2.2 在不同发育时期的表达特征 T1代转基因水稻3叶期、5叶期和8至9叶期叶片的GUS活性见表2。由表2可见:由Xa21基因启动子驱动的GUS活性受到水稻发育时期的影响;在8至9叶期叶片的GUS活性极显著高于3叶期(P<0.01),是3叶期的2.68倍;8至9叶期叶片的GUS活性也显著高于5叶期(P<0.05),是5叶期的 2.00倍;而5叶期叶片的GUS活性略高于3叶期,但差异不显著(P>0.05)。表明随转基因水稻苗龄的增长,Xa21基因启动子驱动的GUS活性逐渐增加。
表2 不同发育期T1代转基因水稻叶片中GUS活性比较(±SD)1)Table 2 Comparison of GUS activity in leaf of T1 strain of transgenic rice(Oryza sativa L.)at different developmental stages(±SD)1)
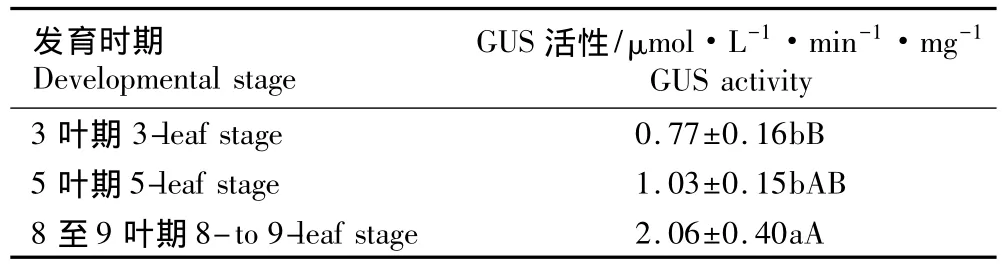
表2 不同发育期T1代转基因水稻叶片中GUS活性比较(±SD)1)Table 2 Comparison of GUS activity in leaf of T1 strain of transgenic rice(Oryza sativa L.)at different developmental stages(±SD)1)
1)同列中不同的小写和大写字母分别表示在0.05和0.01水平上差异显著Different small letters and capitals in the same column indicate the significant difference at 0.05 and 0.01 levels,respectively.
?
2.2.3 在不同逆境及激素处理条件下的表达特征通过GUS活性定量分析,在干旱、机械损伤以及不同激素处理条件下T1代转基因水稻叶片中GUS的活性见表3。由表3可见:机械损伤12 h后,转基因水稻叶片中的GUS活性显著高于对照(P<0.05),为对照的1.24倍;干旱处理48 h后,转基因水稻叶片中的GUS活性变化并不明显;用100 μmol·L-1茉莉酸甲酯处理12 h后,转基因水稻叶片中的GUS活性极显著高于对照(P<0.01),为对照的 1.39倍;经 500 μmol·L-1水杨酸和100 μmol·L-1脱落酸处理 12 h后,转基因水稻叶片中的GUS活性与对照差异不显著。
表3 在不同处理条件下T1代转基因水稻叶片中GUS活性比较(±SD)Table 3 Comparison of GUS activity in leaf of T1 strain of transgenic rice(Oryza sativa L.)under different treatments(±SD)
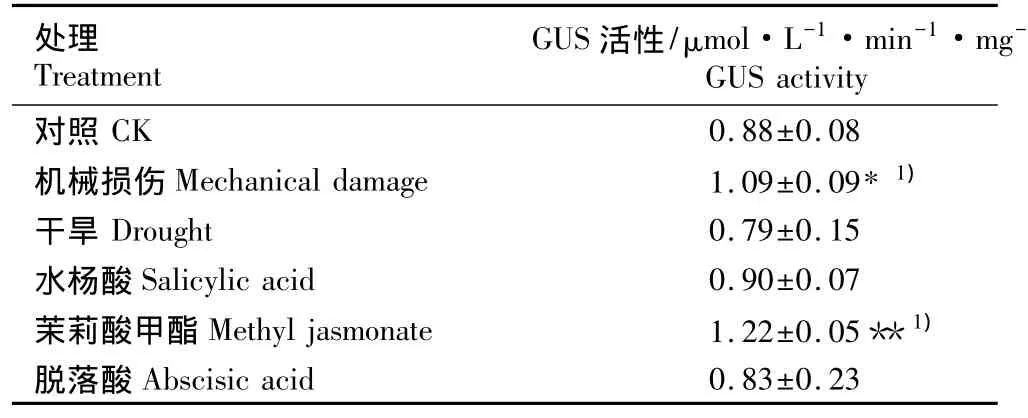
表3 在不同处理条件下T1代转基因水稻叶片中GUS活性比较(±SD)Table 3 Comparison of GUS activity in leaf of T1 strain of transgenic rice(Oryza sativa L.)under different treatments(±SD)
1)**:对照与处理组间差异极显著(P<0.01)The extremely significant difference between the control and treatment group(P<0.01);*:对照与处理组间差异显著(P<0.05)The significant difference between the control and treatment group(P<0.05).
?
3 讨论和结论
研究结果表明:从水稻品种‘日本晴’中扩增得到1条长度为1 982 bp的片段,该片段与GeneBank中登录的水稻品种‘日本晴’Xa21基因启动子序列的同源性高达99.7%,据此推断该序列为Xa21基因启动子。通过顺式作用元件预测该序列包含有GCC-box、A-box、TC-rich repeats、MBS、LTR 和 W-box 等逆境信号相关元件。GUS活性分析结果显示:该启动子在水稻的根、茎和叶中均能表达,其中在根中的表达量最高,特别是在根尖的中柱组织中集中表达;在不同发育时期以及在不同的逆境和外源激素处理条件下,该启动子均能表达,但表达量有明显差异,其中,8至9叶期表达量最高,机械损伤以及100 μmol·L-1茉莉酸甲酯处理均能促进该启动子的表达。
基因的结构、表达与其功能之间相互适应,这是生物在长期进化过程中形成的一种重要的适应机制。Century等[10]的研究结果表明:水稻不同发育时期Xa21基因的表达变化不显著,而且转基因植株对白叶枯病和创伤处理不敏感,说明Xa21基因很可能是在转录后水平进行调控;而Park等[11]的研究结果则表明:白叶枯病可以诱导水稻Xa21基因的表达,在幼苗期和成苗期过量表达Xa21基因都可以增加水稻的抗病性。造成上述研究结果不一致的原因可能是不同研究者采用的PCR反应引物不同所致。由于水稻基因组中抗病基因家族很大,不同成员之间存在着序列同源性,研究人员在设计引物时模板区域的选择有一定差异,因此难以获得基因家族特定成员特异性表达的数据。启动子是基因表达调控的重要元件,启动子的活性在很大程度上可以反映基因的表达情况,因此通过分析基因启动子的表达特征推测基因的表达,可以弥补上述研究的不足之处。根据本研究结果,推测水稻Xa21基因的表达明显受水稻发育时期的影响,随着水稻苗龄的增长,Xa21基因的表达水平逐渐升高,说明在水稻不同发育期的抗性差异与Xa21的表达密切关联。
水稻白叶枯病是一种细菌性病害,自然条件下从寄主的伤口或自然开放的孔口(如水孔)侵入,进入木质部后繁殖并转移到植株的全身,其危害主要发生在叶片及叶鞘部位[5]。Chen 等[18]的研究结果表明:在水稻根系中,Xa21基因也能对白叶枯病病原菌产生抗性。本研究结果表明:Xa21基因启动子驱动的GUS活性在水稻根尖的中柱区域表达量明显较高,这与Xa21介导的白叶枯病抗性特征相吻合[18]。茉莉酸(JA)是植物体内重要的内源性信号分子,茉莉酸信号途径参与了水稻对白叶枯病的抗病反应[19-20]。在本研究中,外源茉莉酸甲酯可以显著增强水稻中Xa21基因启动子驱动的GUS活性,也说明Xa21介导的白叶枯病抗性依赖于茉莉酸信号通路。
[1]JOENS J D G,DANGL J L.The plant immune system[J].Nature,2006,444:323-329.
[2]赵开军,李岩强,王春连,等.植物天然免疫性研究进展及其对作物抗病育种的可能影响[J].作物学报,2011,37(6):935-942.
[3]王友红,张鹏飞,陈建群.植物抗病基因及其作用机理[J].植物学通报,2005,22(1):92-99.
[4]MOHR T J,MAMMARELLA N D,HOFF T,et al.The Arabidopsis downy mildew resistance gene RPP8 is induced by pathogens and salicylic acid and is regulated by W-box cis elements[J].Molecular Plant-Microbe Interactions,2010,23(10):1303-1315.
[5]王运丰.水稻白叶枯病的综合防治措施[J].农村实用科技信息,2011(8):38.
[6]毛凌华,聂元元,李 瑶,等.水稻白叶枯病抗性基因及其分子标记辅助选择育种研究进展[J].江西农业学报,2011,23(8):115-117.
[7]鄂志国,王 磊.水稻抗病性基因的克隆和功能研究进展[J].遗传,2009,31(10):999-1005.
[8]SONG W Y,WANG G L,CHEN L L,et al.A receptor kinase-like protein encoded by the rice disease resistance gene,Xa21[J].Science,1995,270:1804-1806.
[9]GAN Q,BAI H,ZHAO X F,et al.Transcriptional characteristics of Xa21-mediated defense responses in rice[J].Journal of Integrative Plant Biology,2011,53(4):300-311.
[10]CENTURY K S,LAGMAN R A,ADKISSON M,et al.Developmental control of Xa21-mediated disease resistance in rice[J].The Plant Cell,1999,20(2):231-236.
[11]PARK C J,LEE S W,CHERN M,et al.Ectopic expression of rice Xa21 overcomesdevelopmentally controlled resistanceto Xanthomonas oryzae pv.oryzae[J].Plant Science,2010,179(5):466-471.
[12]张 睿,陶建敏,蔡斌华,等.藤稔葡萄花发育相关基因启动子的克隆及功能分析[J].植物资源与环境学报,2011,20(4):17-23.
[13]CURTIS M D,GROSSNIKLAUS U.A gateway cloning vector set for high-throughput functional analysis of genes in planta[J].Plant Physiology,2003,133(2):462-469.
[14]TOKI S,HARA N,ONO K,et al.Early infection of scutellum tissue with Agrobacterium allows high-speed transformation of rice[J].The Plant Journal,2006,47(6):969-976.
[15]JEFFERSON R A.Assaying chimeric genes in plants:the GUS gene fusion system[J].Plant Molecular Biology Reporter,1987,5(1):387-405.
[16]曾凡锁,钱晶晶,康 君,等.转基因白桦中GUS基因表达的定量分析[J].植物学报,2009,44(4):484-490.
[17]LESCOT M,DÉHAIS P,THIJS G,et al.PlantCARE,a database of plant cis-acting regulatory elements and a portal to tools for in silico analysis of promoter sequences[J].Nucleic Acids Research,2002,30(1):325-327.
[18]CHEN F,GAO X J,MIAO Y S,et al.Plasma membrane localization and potential endocytosis of constitutively expressed Xa21 proteins in transgenic rice[J].Molecular Plant,2010,3(5):917-926.
[19]MAHMOOD T,JAN A,KAKISHIMA M,et al.Proteomic analysis of bacterial-blight defense-responsive proteins in rice leaf blades[J].Proteomics,2006,6(22):6053-6065.
[20]SHEN X L,YUAN B,LIU H B,et al.Opposite functions of a rice mitogen-activated protein kinase during the process of resistance against Xanthomonas oryzae[J].The Plant Journal,2010,64(1):86-99.
