糖尿病C57BL/6小鼠STZ剂量的选择及CD2AP在糖尿病肾病蛋白尿进展中的表达变化
2012-12-09唐文庄钟良宝
唐文庄,钟良宝
(海南医学院附属医院肾内科,海南 海口 570102)
·实验研究·
糖尿病C57BL/6小鼠STZ剂量的选择及CD2AP在糖尿病肾病蛋白尿进展中的表达变化
唐文庄,钟良宝*
(海南医学院附属医院肾内科,海南 海口 570102)
目的 探索不同STZ剂量对C57BL/6小鼠糖尿病(DM)模型的影响和CD2相关蛋白(CD2AP)在糖尿病肾病蛋白尿进展中的表达变化。方法 采用雄性近交系C57BL/6小鼠,以110mg/kg、130mg/kg和150mg/kg的STZ用量分别一次性腹腔注射诱导小鼠糖尿病模型,72h后检测小鼠的成模率。小鼠代谢笼收集DM小鼠24h尿量,Bradford法进行24h尿蛋白定量,观察蛋白尿出现的时间。STZ注射后喂养12周,统计各组DM小鼠的死亡率,检测DM小鼠相关血尿生化指标及肾脏病理变化。RT-PCR检测糖尿病模型制备后第1、2、3、4、6、8、10、12周糖尿病小鼠CD2AP表达的变化。结果 130mg/kg剂量的STZ能较好诱导DM的发生(成模率为90%),且血糖水平不至于过高[(21.16±2.46)mmol/L]。12周后,该组DM小鼠的死亡率远低于150mg/kg STZ注射组(22.2%vs 60.0%,P<0.05)。C57BL/6DM小鼠蛋白尿出现的时间为STZ注射后(17.2±5.8)d。CD2AP在糖尿病小鼠的肾脏有稳定的表达,且自第3周开始,CD2AP的表达开始出现明显的下调。结论 130mg/kg的STZ剂量是一次性诱导C57BL/6小鼠糖尿病肾病模型的最佳剂量;DM小鼠蛋白尿的出现可能与CD2AP的表达下调有关。
糖尿病;糖尿病肾病;CD2AP;模型;小鼠
糖尿病肾病(Diabetic nephropathy,DN)是糖尿病(Diabetes mellitus,DM)常见的慢性微血管并发症之一。一次性大剂量注射链脲佐菌素(STZ)诱导的速发型DM模型在糖尿病肾病的研究中较为常用,蛋白尿的出现是肾脏受累的主要外在指征[1-2]。然而,酮症酸中毒、感染、抵抗力低下等因素导致DM动物模型的死亡率较高,尤其是DM小鼠。此外,由于存在个体差异,部分小鼠在DM出现后相当长的一段时间并不出现明显的蛋白尿[3]。因此,降低糖尿病小鼠的死亡率和准确观察肾脏受累的情况对长程研究DN小鼠尤为重要。CD2AP是近年来发现的与蛋白尿发生密切相关的肾小球裂孔隔膜分子[4]。其在蛋白尿发病中的作用机制目前尚未阐明。本研究初步探索CD2AP在糖尿病肾病进展中的一般特点。
1 材料与方法
1.1 实验动物和试剂 100只7周龄雄性C57BL/6小鼠购自华中科技大学同济医学院附属同济医院器官移植所,体重22~28g。标准化饲养房笼子喂养,并饲以标准颗粒饲料,自由饮水。室温23℃~28℃,相对湿度50%~80%。小鼠代谢笼由华中科技大学同济医学院动物实验中心提供。链脲佐菌素(Streptozotocin,STZ)购自美国 Sigma公司。Trizol、DNaseⅠ均购自美国Invitrogen公司;逆转录试剂盒和TaqDNA聚合酶购自立陶宛MBI公司。引物设计参照GenBank中的mRNA序列,由上海生工生物工程技术服务有限公司合成。
1.2 动物分组及DM模型的建立 随机将35只C57BL/6小鼠分为四组:正常对照组(Control),5只;STZ110mg/kg注射组(STZ110),10只;STZ 130mg/kg注射组(STZ130),10只;STZ 150mg/kg注射组(STZ150),10只。所有小鼠适应性喂养1周后禁食12h。将STZ溶于无菌的0.1mol/L的pH 4.5柠檬酸缓冲液中,终浓度为1%。按以上不同剂量对小鼠进行一次性腹腔注射STZ,对照组腹腔注射等量无菌柠檬酸缓冲液。注药后72h小鼠尾尖取血,测血糖(One TouchⅡ血糖仪,美国强生公司),血糖≥16.7mmol/L者确定为DM诱导成功。统计不同STZ剂量下小鼠的DM模型的成功率。
1.3 蛋白尿的监测 将DM小鼠置于小鼠代谢笼喂养,定期监测血糖和收集24h尿量,采用考马斯亮蓝微量测定法进行24h尿蛋白定量。本研究中小鼠蛋白尿的诊断标准以文献[5]中的小鼠尿蛋白的正常范围为参照,即正常小鼠24h尿蛋白为(5~19)μg/体重(g)。若尿蛋白定量超过正常范围,且大于原24h尿蛋白量150%,连续出现2d以上者确定为小鼠病理性蛋白尿。所有小鼠精心喂养12周,对小鼠的生存状况做精确的记录,包括尿量、饮水量、血糖、尿糖、蛋白尿出现的时间、体重及有无死亡等。
1.4 标本采集及生化指标检测 实验结束前1d,用小鼠代谢笼收集24h尿量,称小鼠体重,测血糖;摘取小鼠眼球,由眼动脉处采集小鼠血液标本;留取双肾组织,剥离被膜,测量小鼠肾重,计算单侧肾重与体重的比值,即为小鼠的肾重指数。将小鼠肾脏固定于10%的中性甲醛中,石蜡包埋;用日本Autoanalyzer Hitachi 7150型全自动生化分析仪检测小鼠血尿生化指标,包括:肌酐、血尿素氮(BUN)、Na+和K+等。以血、尿肌酐值计算內生肌酐清除率(Ccr=尿肌酐/血肌酐×每分钟尿量),以此代表小鼠肾小球滤过率,并按小鼠体重进行标准化 [µl/min·BW(g)][6]。尿蛋白定量仍采用Bradford法[7]。
1.5 肾脏病理改变 将石蜡包埋的小鼠肾脏组织切为厚2μm的病理切片,经PAS和Masson染色后,光镜下观察肾脏病理改变。
1.6 RT-PCR检测CD2AP在蛋白尿进展中的表达变化 以130mg/kg的STZ制备7周龄C57BL/6小鼠糖尿病模型(65只),并设正常对照组小鼠5只。剔除未成模小鼠,分别于第1、2、3、4、6、8、10、12周各处死5只小鼠,取各组小鼠肾脏皮质,用Trizol抽提各组小鼠肾皮质总RNA,DNaseⅠ去除RNA中痕量的基因组DNA,合成cDNA。CD2AP引物正义链:5'-CGA GTT GGG GAA ATC ATC AG-3',反义链:5'-TGAGGTAGG GCCAGT CAAAG-3',产物大小:504bp;内参照GAPDH引物正义链:5'-CAT CAC CAT CTT CCA GGA GCG-3'反义链:5'-GAG GGG CCATCCACAGTC TTC-3',产物大小:357bp。PCR反应条件:94℃预变性4min,然后进入94℃30s、55℃45s、72℃ 1min的热循环共30个,最后72℃延伸10min。PCR产物电泳后用自动凝胶成像分析仪及其图象分析系统软件进行分析,以CD2AP与GAPDH吸光度比值表示CD2AP的表达量。
1.7 统计学方法 使用SPSS13.0软件进行统计学处理,实验数据均以均数±标准差(±s)表示,多组间数据比较采用方差分析,两组间均数比较采用成组t检验,相关分析采用Pearson法,P<0.05为差异有统计学意义。
2 结 果
2.1 STZ剂量与血糖水平、DM成模率、小鼠死亡率的关系 STZ注射72h,正常对照组小鼠的血糖为(5.34±0.77)mmol/L;STZ110mg/kg剂量诱导后小鼠的成模率仅为20%,130mg/kg和150mg/kg剂量的成模率分别达到90%和100%,但STZ150组平均血糖水平明显高于STZ130组(P<0.05)。Pearson相关分析显示血糖水平与STZ剂量之间有明显的相关性(r=0.993,P=0.007)。在110mg/kg STZ注射组中,未成模小鼠血糖水平与正常小鼠比较,差异有统计学意义(P<0.05),如表1所示。
表1 STZ剂量与血糖水平、DM成模率、小鼠死亡率的关系(±s)
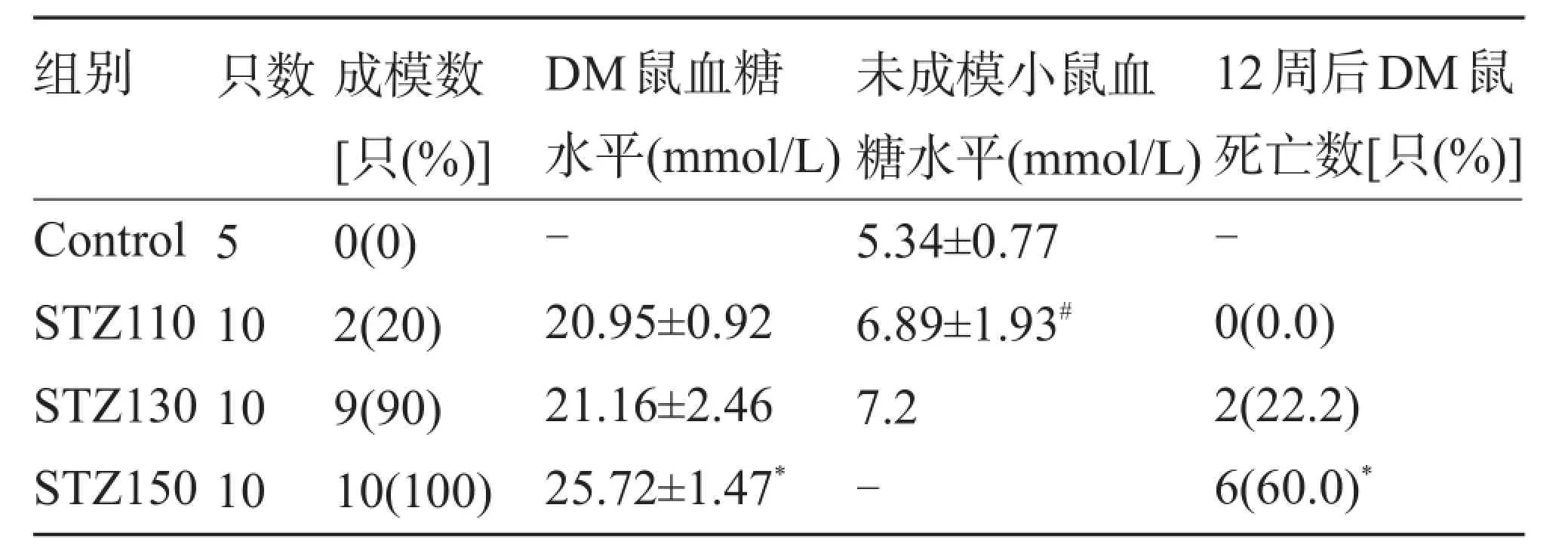
表1 STZ剂量与血糖水平、DM成模率、小鼠死亡率的关系(±s)
组别 只数成模数[只(%)]DM鼠血糖水平(mmol/L)未成模小鼠血糖水平(mmol/L)12周后DM鼠死亡数[只(%)]Control STZ110STZ130STZ15051010100(0)2(20)9(90)10(100)-20.95±0.9221.16±2.4625.72±1.47*5.34±0.776.89±1.93#7.2--0(0.0)2(22.2)6(60.0)*
同等条件下喂养DM小鼠12周后,130mg/kg STZ注射组DM小鼠死亡率为22.2%,而150mg/kg STZ注射组DM小鼠死亡率达60.0%。对DM小鼠进行回顾性分析,死亡DM小鼠(8只)造模时血糖为(25.84±1.35)mmol/L,未死亡DM小鼠(13只)造模时血糖为(22.15±2.16)mmol/L,差异有统计学意义,高血糖引起的酮症酸中毒为小鼠死亡的主要原因。
13只DM小鼠STZ诱导前24h尿量为(1.62±0.22)ml,24h尿蛋白定量为(0.25±0.06)mg。DM诱导成功后其尿量显著增多,在STZ注射后第1周24h尿量达到(5.43±0.61)ml,但24h尿蛋白定量并未有明显的增加(P>0.05)。DM小鼠蛋白尿出现的时间为(17.2±5.8)d。随着时间的延长,DM小鼠的24h尿量及24h尿蛋白定量呈逐步递增趋势,如图1所示。
2.2 DM小鼠24h尿量及蛋白尿出现的时间 剔除实验中不同时期死亡的8只DM小鼠,剩余13只DM小鼠STZ诱导前24h尿量为(1.62±0.22)ml,24h尿蛋白定量为(0.25±0.06)mg。DM诱导成功后其尿量显著增多,在STZ注射后第1周24h尿量达到(5.43±0.61)ml,但24h尿蛋白定量并未有明显增加(P>0.05)。DM小鼠蛋白尿出现的时间为(17.2±5.8)d。随着时间的延长,DM小鼠的24h尿量及24h尿蛋白定量呈逐步递增趋势,如图1所示。
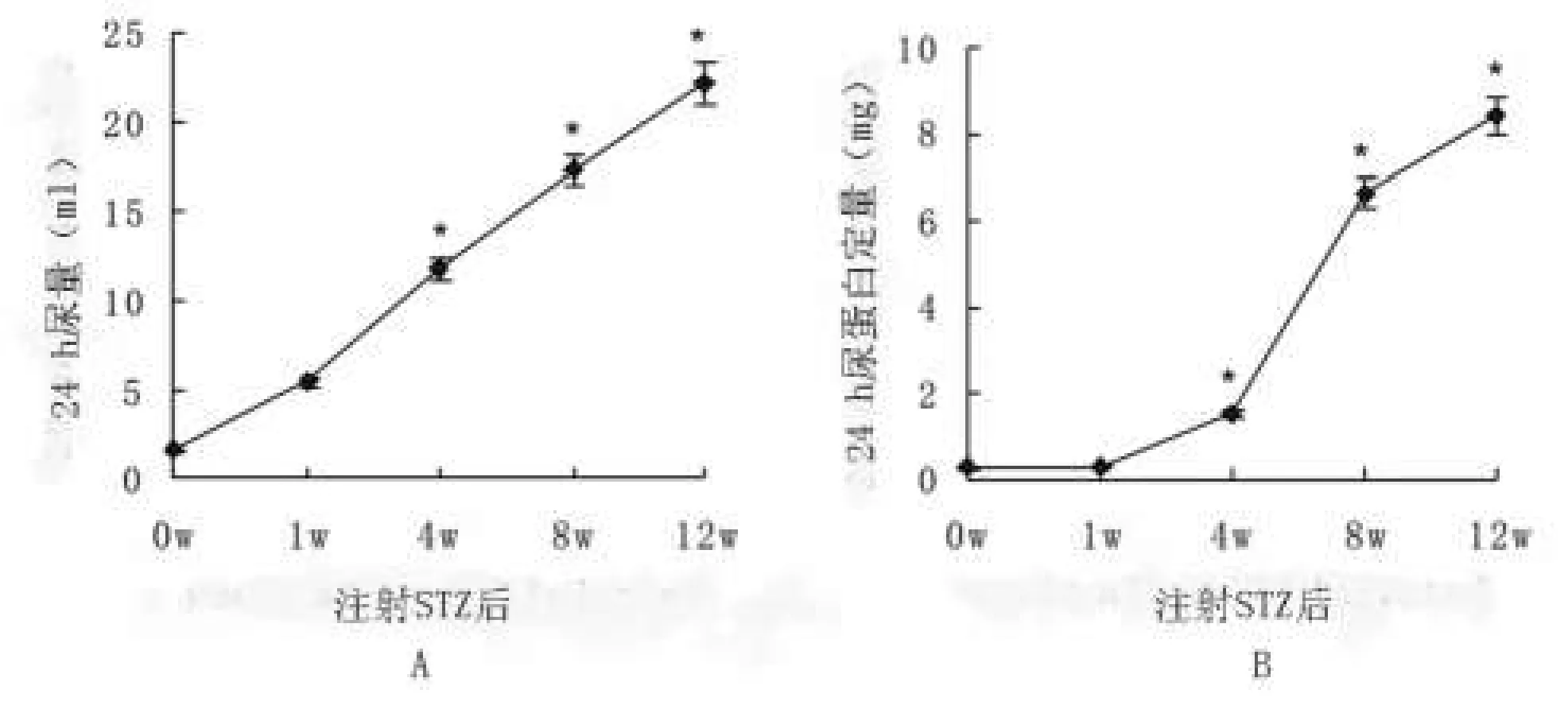
图1 不同时间点DM小鼠24h尿量及24h尿蛋白定量
2.3 肾脏生化指标的改变 糖尿病小鼠的肾重指数、血糖、糖化血红蛋白(HbA1c)和GFR均明显高于正常对照组小鼠(P<0.05),但血清肌酐水平未见明显升高(P>0.05);在血电解质指标上,糖尿病小鼠血清Na+浓度低于正常对照小鼠,而血清K+较正常小鼠有所增高(P<0.05),见表2。
表2 第12周各组小鼠生化指标(±s)

表2 第12周各组小鼠生化指标(±s)
注:与对照组比较,*P<0.05。
组别GFR[µl/min.BW(g)]2.84±0.547.13±0.84*只数正常对照组糖尿病组513肾重指数(mg/g)13.94±1.4319.43±2.16*血糖(mmol/L)5.54±0.8026.62±2.24*血HbA1c(%)3.85±0.578.45±0.88*血Na+(mmol/L)140.24±3.01135.67±3.50*血K+(mmol/L)6.28±0.687.55±1.62*血肌酐(µmol/L)8.52±1.617.73±3.05
2.4 肾脏病理变化 如图2A、2C所示:正常对照组小鼠肾小球及肾小管未见明显病理变化,而糖尿病小鼠的肾小球体积明显增大,肾小球肿胀,肾小囊扩张;肾小管上皮细胞浊肿;近端肾小管刷状缘脱落。PAS染色下,肾小球基底膜增厚,肾小球系膜细胞增生,系膜区增宽等病变明显可见(图2B)。Masson染色下,细胞核呈红色,基底膜胶原纤维呈蓝色,系膜水肿区呈淡蓝色,但未见肾间质纤维化,未见明显炎性细胞浸润(图2D)。

图2 第12周小鼠肾脏病理变化
2.5 CD2AP在蛋白尿进展中的表达变化 CD2AP mRNA在正常组及第1、2周糖尿病小鼠的肾脏皮质中有稳定的表达,且差异无统计学意义(P>0.05)。自第3周起,DM组小鼠肾脏皮质CD2AP mRNA的表达开始出现下调,随着病程的延长呈递减趋势,在观察期限的第12周表达最低(图3)。
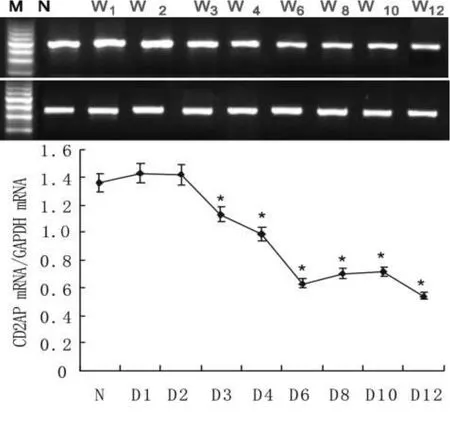
图3 CD2AP在各组小鼠肾脏皮质中的表达
3 讨论
STZ对胰岛β细胞具有高度选择性毒性作用,主要通过直接破坏胰岛β细胞或通过自身免疫机制导致β细胞损伤,使胰岛素分泌不足,表现为糖尿病特点。已有研究表明STZ的剂量与胰岛的损伤程度呈明显的正相关[8]。文献报道[9]小鼠的STZ使用剂量多为25~150mg/kg,亦有可达250mg/kg,一次性腹腔注射150mg/kg较常用。本研究发现,STZ剂量与糖尿病小鼠的成模率、血糖水平密切相关,高血糖导致的代谢紊乱是实验小鼠死亡的主要原因,选择STZ剂量是实验的关键。C57BL/6小鼠在110mg/kg STZ剂量诱导下,多数不表现为糖尿病,但其血糖水平仍高于正常对照小鼠,反映出STZ对胰岛有损伤,但有限。随着STZ剂量的增大,小鼠的血糖水平随之增加,DM成模率增高。糖尿病小鼠因高糖血症导致代谢紊乱,机体抵抗力低下,因而在实验过程中有较高的死亡率。在本研究中,12周内不同剂量诱导组小鼠的死亡率比较,STZ剂量大者,小鼠血糖水平高,其死亡的机会大。所以,130mg/kg的STZ剂量在DM小鼠存活上比应用高剂量STZ者有明显的优势。
正常小鼠每日亦有少量的尿蛋白排泄[5]。实验中,对C57BL/6DM小鼠24h尿蛋白量进行监测发现,STZ注射后第10天,即有个别小鼠开始出现蛋白尿,但大多数小鼠蛋白尿出现的时间主要集中出现在第3周。蛋白尿的出现是肾脏受累的明显特征,表明了糖尿病的并发症—糖尿病肾病的产生[10]。目前,越来越多的证据表明蛋白尿是肾脏损伤进行性加重的重要原因,积极干预蛋白尿的产生对延缓肾功衰的重要性[11]。
基质增生和间质纤维化是糖尿病肾病进展的主要病理特征[12]。为了了解C57BL/6小鼠12周后肾脏病变程度、病理分期及机体状况,我们检测了相关血尿生化指标及肾脏病理改变。肾小球滤过率的结果提示此期DM小鼠肾脏仍然处于高滤过状态;因高滤过、水肿导致的肾脏肥大,加之DM小鼠消瘦、体重减轻,故肾重指数明显增加。血肌酐的结果表明DM小鼠肾功能仍在正常范围。部分小鼠可以检测到低Na+、高K+血症,这可能与高血糖引起的渗透性利尿作用有关。肾脏病理主要以肾小球体积增大及基底膜增厚为主,伴有小管间质的水肿。Masson染色未见肾脏有明显的纤维化病变,说明DM小鼠12周的病程尚不足以引起肾脏进入终末肾衰竭的阶段。根据Mogensen对DN的分期标准[13],我们研究中STZ注射12周的小鼠主要处于DNⅢ期。
在此基础上,我们还初步探讨了CD2AP在糖尿病肾病进展中的表达规律。CD2AP在肾脏主要表达于肾小球上皮细胞(足细胞)和肾小管上皮细胞,它作为细胞内骨架蛋白间的衔接蛋白可能发挥着细胞粘附、迁移和形态维持等的功能[14]。研究中我们发现,CD2AP在正常肾脏有较高水平的表达,在蛋白尿出现之前2周内,CD2AP的表达无明显改变。当糖尿病小鼠在第3周开始出现病理性蛋白尿即糖尿病肾病的时候,CD2AP的表达也开始出现下调。随着病程的进展,DN小鼠的蛋白尿逐步增加,而CD2AP的表达呈逐步下降趋势,两者之间显示出负相关性。CD2AP这种表达的下调与蛋白尿发生之间的因果关系怎样?机制怎样?这些均有待于我们下一步进行的深入研究。
本研究表明,一次性腹腔注射STZ剂量130mg/kg,近交系C57BL/6糖尿病小鼠在第3周左右开始出现明显的蛋白尿,第12周肾脏组织为典型的Ⅲ期病理改变,此外,肾脏皮质组织CD2AP的表达下调。故130mg/kg的STZ剂量是一次性诱导C57BL/6小鼠糖尿病肾病模型的最佳剂量;DM小鼠蛋白尿的出现可能与CD2AP的表达下调有关。
[1]Burton C,Harris KP.The role of proteinuria in the progression of chronic renal failure[J].Am J Kidney Dis,1996,27(6):765-775.
[2]Rebuffe-Scrive M,Surwit R,Feinglos M,et al.Regional fat distribution and metabolism in a new mouse model(C57BL/6J)of non-insulin-dependent diabetes mellitus[J].Metabolism,1993,42(11):1405-1409.
[3]Leiter EH.Multiple low-dose streptozotocin-hyperglycaemia and insulitis in C57BL mice:Influence of inbred background,sex,and thymus[J].Proc NatlAcad Sci USA,1982,79:630-634.
[4]Durvasula RV,Shankland SJ.Podocyte injury and targeting therapy:an update[J].Curr Opin Nephrol Hypertens,2006,15(1):1-7.
[5]Meneton P,Ichikawa I,Inagami T,et al.Renal physiology of the mouse[J].Am J Physiol Renal Physiol,2000,278(3):339-351.
[6] Hackbarth H,Hackbarth D.Genetic analysis of renal function in mice.1.Glomerular filtration rate and its correlation with body and kidney weight[J].LabAnim.1981,15(3):267-272.
[7]雷作熹,罗 仁,董晓蕾,等.STZ诱导糖尿病肾病大鼠模型的建立[J].中国实验动物学报,2005,13(3):163-165.
[8]Gaulton GN,Schwartz JL,Eardley DD.Assessment of the diabetogenic drugs alloxan and streptozotocin as models for the study of immune defects in diabetic mice[J].Diabetologia,1985,28(10):769-775.
[9]Hard GC.Identification of a high-frequency model for renal carcinoma by the induction of renal tumors in the mouse with a single dose of streptozotocin[J].Cancer Res,1985,45(2):703-708.
[10]American-Diabetes Association.Diabetic nephropathy[J].Diabetes Care,2000,23(Suppl 1):69-72.
[11]Hovind P,Tarnow L,Parving HH.Remission and regression of diabetic nephropathy[J].Curr Hypertens Rep,2004,6(5):377-382.
[12]Yamamoto Y,Maeshima Y,Kitayama H,et al.Tumstatin peptide,an inhibitor of angiogenesis,prevents glomerular hypertrophy in the early stage of diabetic nephropathy[J].Diabetes,2004,,53(7):1831-1840.
[13]Mogensen CE,SchmitzA,Christensen CK.Comparative renal pathophysiology relevant to IDDM and NIDDM patients[J].Diabetes Metab Rev,1988,4(5):453-483.
[14]Kim JM,Wu H,Green G,et al.CD2-associated protein haploinsufficiency is linked to glomerular disease susceptibility[J].Science,2003,300(5623):1298-1300.
Selection of Streptozotocin dose on experimental C57BL/6diabetic mice and the temporal expression of CD2AP during proteinuria progression.
TANG Wen-zhuang,ZHONG Liang-bao.Department of Nephropathy,the AffiliatedHospital of Hainan Medical University,Haikou 570102,Hainan,CHINA
Objective To determine the optimal dose of Streptozotocin(STZ)for the establishment of C57BL/6mouse model of diabetic nephropathy,and to study the temporal expression of CD2AP during proteinuria progression.Methods Male C57BL/6mice were induced by three STZ doses(i.e.110mg/kg,130mg/kg and 150mg/kg,respectively)through once intraperitoneal injection.Blood glucose was measured at 72h later.24h urine volume was collected by metabolic cage and 24h urine protein was detected by Bradford method to monitor the time when proteinuria occurred.Twelve weeks later,the mortality of DM mice,the biochemical values and renal pathology were studied respectively.The expression of CD2AP mRNA was measured by semi-quantitative RT-PC on the 1th,2th,3th,4th,6th,8th,10th,12thweek.Results STZ dose of 130mg/kg could successfully induce C57BL/6mice developing into DM state(90%)and ensure that the levels of blood glucose not too high[(21.16±2.46)mmol/L].Twelve weeks later,the STZ dose of 130mg/kg could effectively lessen the mortality of DM mice than 150mg/kg(22.2%vs 60%,P<0.05).24h urine protein of DM mice was significantly elevated at(17.2±5.8)days since STZ injection.CD2AP could stably express in mice renal cortex,and exhibit a descending expression pattern since the third week after STZ injection.Conclusion 130mg/kg is the optimal dose of STZ to establish DN model with C57BL/6mice through once intraperitoneal injection.The occurrence and progression of proteinuria might closely correlated with the down-regulation of CD2AP.
Diabetes mellitus;Diabetic nephropathy;CD2AP;Model;Mouse
R749
A
1003—6350(2012)16—024—05
唐文庄(1975—),男,副主任医师,学士。
*通讯作者:钟良宝,教授。E-mail:zhonglb_5612@sina.com
10.3969/j.issn.1003-6350.2012.16.009
2012-03-08)
