实时三维经胸超声心动图评价右室不同部位起搏对左室收缩同步性和收缩功能的影响
2012-12-08TANJing
谭 静 TAN Jing
俞 杉 YU Sha
吴 强 WU Qiang
安亚平 AN Yaping
郭再雄 GUO Zaixiong
卜 婕 BU Jie
安置埋藏式起搏器是目前治疗缓慢性心律失常长期有效的措施,常规是将电极安置在右室心尖部(RVA),这样会导致心电传导顺序异于生理性心室激动顺序,从而影响心脏血流动力学及心功能[1]。近年来由于电极的改进,可以将其置于右室流出道(RVOT)间隔部,更靠近希氏束,理论上可以获取接近生理激动顺序的电活动。本研究旨在应用实时三维经胸超声心动图(real time three dimensional transthoracic echocardiography,RT-3D-TTE)评价右室不同部位起搏对左室收缩同步性和收缩功能的影响。
1 资料与方法
1.1 一般资料 2009-01~2010-01在贵州省人民医院心内科住院的埋藏式心脏起搏器安置术Ⅰ类适应证[2]的65例缓慢性心律失常患者,排除冠心病、先天性心脏病、心肌病、完全性左右束支传导阻滞、严重高血压,左室舒张末期内径>55mm,心功能Ⅲ~Ⅳ级(NYHA分级)、术后起搏比例<50%者。65例患者采用掷硬币随机法分为两组:RVOT组35例,RVA组30例,两组患者一般资料比较见表1。两组患者的病程以及合并高血压、糖尿病均匹配。
1.2 方法
1.2.1 仪器与设备 Philips iE33超声诊断仪,带X3-1矩阵三维全容积探头,频率1~3MHz;并配有安装Qlab 6.0软件的工作站。ECG-903数字式12导心电图机;Medtronic 2090程控仪;ST.Jude 3510程控仪。
1.2.2 安置埋藏式起搏器 根据患者病情和意愿分别选择VVI/VVIR和DDD/DDDR起搏器。心室电极均为螺旋电极,分别为Medtronic公司CAPSURE FIXNovus 5076型螺旋电极、ST.Jude Medical公司TENDRII SDX 1688T及1888T型螺旋电极。RVA起搏组将起搏电极固定于右室心尖部;RVOT起搏组在X线透视下将主动固定电极送入右心室流出道间隔部,并将起搏电极固定于QRS波时限相对较窄处。术中采用Medtronic 5318起搏分析仪测试起搏参数。当电极测试参数满意后,将电极导线与脉冲发生器连接,埋植于胸前皮下囊袋中。对于安置DDD/DDDR起搏器者,均将心房电极置于右心耳。
1.2.3 RT-3D-TTE检测 患者取左侧卧位,连接心电图,在心尖四腔观位置上获取理想的三维全容积图像并存储。再将图像导入安装有Qlab软件的工作站,使用3DQ advanced软件进行定量分析:调整图像切割,使3个平面清晰显示左室心尖四腔观、心尖两腔观和短轴观。首先确定舒张末期和收缩末期,然后选定心尖四腔观和两腔观的5个左室心内膜取样点,即二尖瓣瓣环水平的室间隔、侧壁、前壁、下壁以及任一切面的左室心尖部。该软件会自动勾画出动态三维心内膜轮廓,若软件描绘的心内膜轮廓与实际吻合不佳,可手动逐帧作局部调整,使其达到最佳吻合状态,生成的三维模型自动分为17个容积节段(左室17节段按照美国心脏病协会推荐的17节段模型划分[3])。软件自动测量每个节段达到最小收缩容积的时间(Tmsv)、标准差(Tmsv SD)以及最大时间差(Tmsv Dif);自动显示左室射血分数(LVEF)。自动计算16个节段(6个基底段、6个中间段、4个心尖段)Tmsv的标准差(Tmsv 16-SD)以及最大时间差(Tmsv 16-Dif)。采用Tmsv 16-SD和Tmsv 16-Dif作为评价左室收缩同步性的参数,采用LVEF作为评价左室收缩功能的参数。采用二维超声心动图测量左室长轴切面的左室舒张末期内径(LVEDD),以评价左室重构。
1.2.4 随访 分别于术后1个月、3个月、6个月和12个月进行随访,采用Medtronic 2090型及ST.Jude 3510型起搏器程控仪测试各项起搏参数,观察心室累积起搏比例,并在整个随访期间尽量维持不变。同时行超声心动图检查。
1.3 统计学方法 采用SPSS 13.0统计软件,计量资料首先进行拟合优度检验,数据以表示,组内比较采用配对t检验,组间比较采用两独立样本t检验;计数资料采用Fisher精确概率法,P<0.05为差异有统计学意义。
2 结果
2.1 一般资料比较 RVOT组与RVA组患者年龄、性别和植入起搏器类型差异无统计学意义(P>0.05)。见表1。
2.2 RVOT组与RVA组内比较 所有受检者均获得满意的RT-3D-TTE的全容积图像。RVA组术后1个月、3个月、6个月、12个月Tmsv 16-SD和Tmsv 16-Dif测值均大于术前当天,差异有统计学意义(P<0.05);术后6个月、12个月LVEDD大于术前,LVEF小于术前,差异有统计学意义(P<0.05)。RVOT组术后1个月、3个月、6个月、12个月Tmsv 16-SD和Tmsv 16-Dif测值均大于术前当天,差异有统计学意义(P<0.05);LVEDD、LVEF与术前比较,差异均无统计学意义(P>0.05)。见表2、图1、2。

表1 RVOT组和RVA组患者一般资料比较
2.3 RVOT组与RVA组间比较 RVOT组和RVA组术前Tmsv 16-SD、Tmsv 16-Dif、LVEDD 和 LVEF差异无统计学意义(P>0.05)。与RVA组比较,RVOT组术后1个月、3个月差异无统计学意义(P>0.05);术后6个月、12个月Tmsv 16-SD、Tmsv 16-Dif和LVEDD较小,LVEF较大,差异有统计学意义(P<0.05)。见表2。
表2 RVOT组与RVA组Tmsv 16-SD、Tmsv 16-Dif测值( )
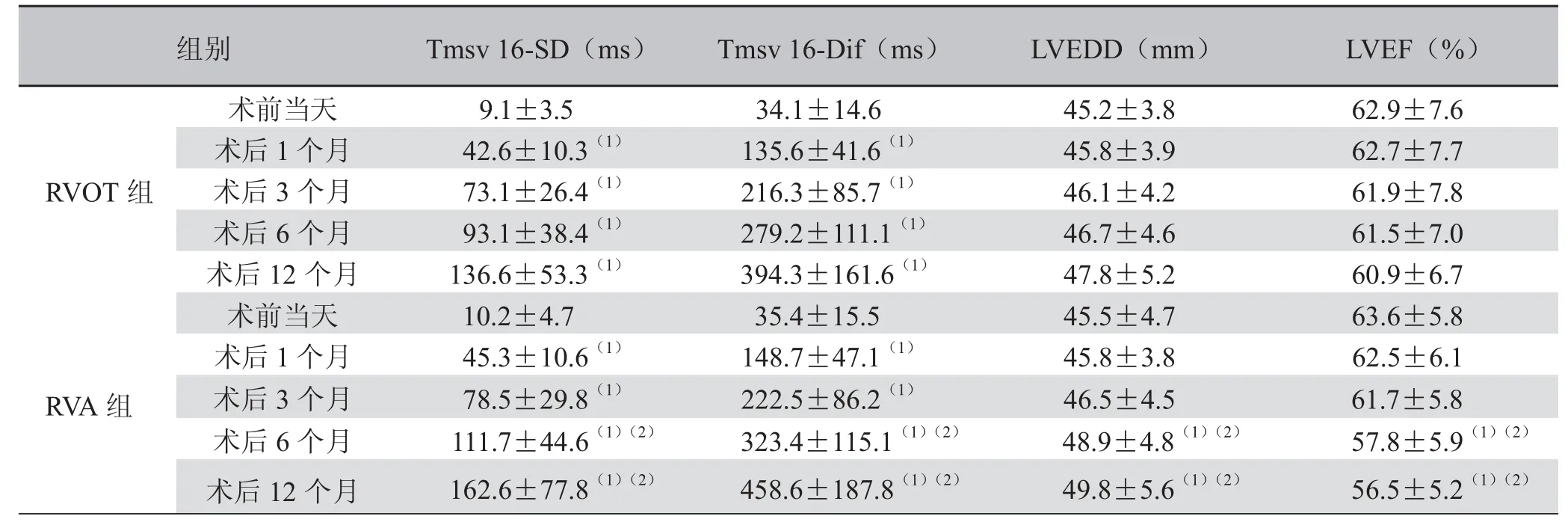
表2 RVOT组与RVA组Tmsv 16-SD、Tmsv 16-Dif测值( )
注:(1)与术前当天比较,P<0.05;(2)与RVOT组比较,P<0.05
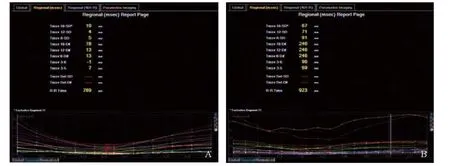
图1 A.起搏术前,左室收缩的同步性曲线;B.RVA起搏术后,左室收缩同步性减低
3 讨论
正常的电激动顺序经由房室结传至蒲肯野纤维束,几乎同步激动左室各节段协调收缩。起搏器自应用以来挽救了许多患者的生命,但传统的RVA起搏最早的起搏点源于右室心尖部,逆行激动间隔并向右和左侧心室扩布,造成明显的电激动异常,引起医源性左束支传导阻滞。研究显示,长期RVA起搏会引起左室血流动力学紊乱和收缩不同步,心肌血流灌注减少,左室收缩功能降低[4~6]。
理论上,如果起搏后激动能从传导系统下传,接近正常的电生理激动顺序,对左室的收缩功能及同步性影响较小。RVOT间隔部起搏位点靠近His束部位,最早起搏点源于室间隔上部,由室间隔下传到心尖,其电激动顺序接近正常。史浩颖等[7]使用组织多普勒成像技术比较了9例患者右室不同部位起搏对左室收缩同步性的即刻影响,发现RVOT间隔部起搏时,QRS起始点距左室各节段收缩期速度峰值时间的标准差(Ts-SD)较RVA起搏低,但差异无统计学意义(P>0.05)。孙敏敏等[8]研究了短期内(3个月)RVA及RVOT起搏对左室收缩同步性的影响,提示RVOT起搏对左室收缩同步性的影响较小,术前左室收缩不同步者(Ts-SD≥32.6ms),RVOT起搏能改善其左室收缩同步性。
Yu等[9-11]用组织多普勒评价左室收缩的同步性,采用心尖切面左室基底段和中间段12个节段的收缩或舒张达峰时间的标准差(Ts-SD、Te-SD),12个左室节段内任2个节段Ts的最大差值、基底段室间隔和右室游离壁Ts的差值等作为评价心室机械同步性的指标,结果发现,12个左室节段的Ts-SD是评价左室收缩同步性最有力的指标,特异性和敏感性均为100%。近年来随着RT-3D-TTE的飞跃发展,其广泛应用于临床及科研。RT-3D-TTE可以克服二维超声的不足,在同一心动周期同时显示左室各节段,并评价各节段容积的变化规律,以此探讨左室收缩的机械同步性。关于实时三维超声的研究报道,心电图QRS波起始点距离左室最小容积点平均时间的标准差(T-SD)和心电图QRS波起始点距离左室最小容积点的最大时间差(Tmax)可有效评价左室心肌收缩的同步性[12]。
本研究采用16个节段的Tmsv SD以及Tmsv Dif作为评价左心室收缩同步性的指标,发现RVA起搏和RVOT起搏组术后1个月、3个月、6个月、12个月的测值均大于术前当天(P<0.05),Tmsv 16-SD在术后1个月均大于32.6ms,说明右心室起搏在短期内会导致左心室收缩不同步,而且这种不同步运动持续存在。与RVA起搏比较,RVOT的Tmsv 16-SD及Tmsv 16-Dif测值在术后1个月、3个月差异无统计学意义(P>0.05),而术后6个月、12个月测值小于RVA组(P<0.05),说明RVOT起搏与RVA起搏在短期内对左心室收缩同步性的影响无明显差异,与文献[7]报道一致。但6个月后,RVOT对左心室收缩同步性的影响小于RVA起搏。同时,RVOT组术后6个月、12个月LVEDD轻度增大,LVEF轻度减小,但差异无统计学意义(P>0.05)。而RVA起搏组术后6个月、12个月LVEDD增大,LVEF减小,差异有统计学意义(P<0.05)。本研究发现,RVOT组对左室整体收缩功能的影响小于RVA组。因此,RVOT间隔部是比较理想的右心室起搏位点。本研究随访时间较长,RT-3D-TTE方法先进可靠,但纳入研究对象的缓慢性心律失常类型不一致,可进一步分层研究。
RT-3D-TTE可用于研究左室收缩的不同步性。RVOT起搏和RVA起搏在短期内均可引起左室收缩的不同步且无明显差异;但长期来看,RVOT起搏对左室同步性的影响小于RVA起搏,是较理想的右室起搏位点。
[1]Fang F, Chan JY, Yip GW, et al.Prevalence anddeterminants of left ventricular systolic dyssynchrony in patients with normal ejection fraction received right ventricular apical pacing: a real-time three dimensional echocardiographic study.Eur J Echocardiogr, 2010, 11(2):109-118.
[2]方祖祥, 江洪, 朱中林, 等.埋置心脏起搏器及抗心律失常器指南(修订版).中国心脏起搏与心电生理杂志,2003, 17(5): 321-338.
[3]Cerqueira MD, Weissman NJ, Dilsizian V, et al.Standardized myocardial segmentation and nomenclature for tomographic imaging of the heart: a statement for healthcare professionals from the Cardiac Imaging Committee of the Council on Clinical Cardiology of the American Heart Association.Circulation, 2002, 105(4):539-542.
[4]Tse HF, Yu C, Wong KK, et al.Functional abnormalities in patients with permanent right ventricular pacing: the effects of sites of electrical stimulation.J Am Coll Cardiol, 2002,40(8): 1451-1458.
[5]O'Keefe JH Jr, Abuissa H, Jones PG, et al.Effect of chronic right ventricular apical pacing on left ventricular function.Am J Cardiol, 2005, 95(6): 771-773.
[6]Manolis AS.The deleterious consequences of right ventricular apical pacing: time to seek alternate site pacing.Pacing Clin Electrophysiol, 2006, 29(3): 298-315.
[7]史浩颖, 汪芳, 孟伟栋, 等.组织多普勒评价右室不同部位起搏对左室收缩功能和同步性的影响.中华心血管病杂志, 2005, 33(11): 1002-1005.
[8]孙敏敏, 舒先红, 潘翠珍, 等.组织多普勒显像评价右心室不同部位起搏对左心室收缩同步性的影响.中华超声影像学杂志, 2008, 17(6): 476-478.
[9]舒嫦群, 潘翠珍, 施月芳, 等.实时三维超声心动图评价左心室心肌收缩同步性的初步临床研究.中华超声影像学杂志, 2005, 14(9): 645-648.
[10]Yu CM, Fung WH, Lin H, et al.Predictors of left ventricular reverse remodeling after cardiac resynchronization therapy for heart failure secondary to idiopathic dilated or ischemic cardiomyopathy.Am J Cardiol, 2003, 91(6): 684-688.
[11]Yu CM, Lin H, Fung WH, et al.Comparison of acute changes in left ventricular volume, systolic and diastolic functions, and intraventricular synchronicity after biventricular and right ventricular pacing for heart failure.Am Heart J, 2003, 145(5): E18.
[12] Yu CM, Fung JW, Zhang Q, et al.Tissue Doppler imaging is superior to strain rate imaging and postsystolic shortening on the prediction of reverse remodeling in both ischemic and nonischemic heart failure after cardiac resynchronization therapy.Circulation, 2004, 110(1): 66-73.
