HIV阴性肺隐球菌病CT表现
2012-12-08KONGXun
孔 迅 KONG Xun
高 莉 GAO Li
王霄英 WANG Xiaoying
肺隐球菌病(pulmonary cryptococcosis,PC)是一种较少见的亚急性或慢性肺部真菌感染性疾病,通常由吸入新型隐球菌孢子引起。近年来,随着艾滋病患者的增加、糖皮质激素及免疫抑制剂的广泛应用,肺隐球菌感染有增多的趋势,但其临床表现及影像学表现无明显特异性,常易误诊。本研究回顾性分析经病理或临床证实的20例肺隐球菌病的CT图像及临床资料,旨在提高对本病的认识及诊断水平。
1 资料与方法
1.1 一般资料 2000-04~2011-10经病理或临床证实的20例肺隐球菌病患者,其中男12例,女8例;年龄20~72岁,平均(48±15)岁。有基础病9例,其中Cushing病1例,糖尿病1例,肾病综合征2例,天疱疮1例,湿疹1例,斑秃1例,白细胞减少症并长期粉尘接触史1例,既往患过肺结核1例;无基础病11例,其中养鸽子史1例,近期有桑拿史1例。临床表现:咳嗽12例,咳痰6例(白色泡沫痰4例,咯血2例),喘憋6例,发热7例,头痛1例,皮疹1例,无症状因体检发现5例;合并中枢神经系统隐球菌病1例,皮肤隐球菌病1例。诊断方法:经病理证实15例,其中手术切除1例,CT引导下穿刺7例,支气管镜活检7例;肺泡灌洗液培养出隐球菌1例;血清抗原阳性4例,且抗真菌治疗后症状好转,病灶减小或消失,抗原滴度下降。20例中除1例因术前诊断不明确行手术治疗外,其余19例均行抗真菌治疗。
20例患者根据基础疾病史及用药史,分为免疫正常组及免疫抑制组。免疫抑制组包括有激素或免疫抑制剂长期应用史,或有白细胞减少症者;免疫正常组无激素或免疫抑制剂应用史。
1.2 仪器与方法 使用GE LightSpeed 16层multidetector CT(MDCT) 和 Philips Brilliance 64层MDCT。GE Lightspeed 16层MDCT扫 描 参 数:120kV,200~ 250 mAs,螺距 0.98∶1,转速 0.7s,16×0.625mm,标准算法重建,重建层厚1mm;Philips Brilliance 64层MDCT扫描参数:120kV,自动毫安选择(范围50~500mA),螺距0.68∶1,转速0.75s,64×0.625mm,标准算法重建,重建层厚1mm;另有3例行高分辨率CT(HRCT)扫描,120kV,200mAs,层厚1mm,层间距10mm,扫 描 时 间 1s, 矩 阵 512×512, 视 野(FOV)280mm×280mm,采用高分辨率骨算法重建。所有患者均于深吸气末屏气扫描,从肺尖扫面至肺底。12例行1次CT扫描,8例行2次以上CT扫描。
1.3 图像分析 所有图像均在导入PACS系统上观察,采用肺窗(窗宽700Hu,窗位-800Hu),纵隔窗(窗宽300Hu,窗位30Hu),部分行多平面重组(MPR)。根据病变的主要形态,将肺隐球菌病分为结节肿块型(结节影指直径≤3cm的类圆形或椭圆形病灶;肿块影指直径>3cm的类圆形或椭圆形病灶)、实变型和混合型。病变分布以肺门为界分为上肺与下肺,以胸膜下外1/3范围为界分为外周部与中央部,观察病变的分布。图像由2名放射科医师在不知临床病史的情况下进行盲法阅片。根据以上标准对肺部病灶进行分型,记录每次CT扫描图像上病变的类型、分布、形态、数目和大小,通过随访CT和胸片影像观察病变演变过程。
1.4 统计学方法 采用SPSS 17.0软件,率的比较采用χ2检验,P<0.05表示差异有统计学意义。”
2 结果
2.1 病灶CT分型及形态
2.1.1 结节肿块型 8例。①孤立性病灶3例,均位于下肺,其中左肺下叶1例,右肺下叶2例。直径1.8~8.5cm,病灶边缘部分光滑,边界尚清。分叶1例,周围见短毛刺1例(图1)。支气管气相1例,空洞2例,空洞形态不规则(图2)。②多发病灶5例,单肺2例,双肺3例。5例多发病灶均累及下叶,直径0.8~3.2cm,大小不等,部分边界不清,晕征3例(图3)。支气管气相3例,空洞4例,其中1例空洞为治疗后出现。结节肿块型病灶分布以肺外周为主6例,中央为主1例,随机分布2例,合并胸膜增厚1例,胸腔积液2例。
2.1.2 实变型 7例。①局限病灶3例,其中上肺1例,下肺2例。CT表现为局限于一个肺叶的楔形或片状的密度增高影,实变密度较高,边界较清晰,2例病变以外周分布为主,1例以中央分布为主。1例周围可见少许磨玻璃密度影,1例病灶内可见支气管气相及不规则坏死(图4)。②多发病灶4例(图5),以上肺为主1例,以下肺为主3例,单肺1例,双肺3例。CT表现为外周或随机分布于单肺或双肺的多发片状或斑片状密度增高影,边界不清,周围可见磨玻璃密度影,3例病灶内见支气管气相,空洞2例,合并胸腔积液2例。
2.1.3 混合型 5例,其中上肺1例,下肺4例。CT表现为结节、团块、实变及磨玻璃影混合存在,3例病变以外周分布为主,2例随机分布。病变内见支气管气相3例(图6),晕征3例,空洞2例,毛刺2例。
所有病例及结节肿块型中,病灶在上肺、下肺的分布及中央、外周、随机分布差异有统计学意义(P<0.05),见表1,其中晕征、空洞和支气管气相的发病率较高,分别为30%、55%和50%;免疫正常患者与免疫抑制患者晕征发生率差异较明显。免疫抑制患者和免疫功能正常患者的CT影像学改变见表2。
2.2 治疗后影像学变化 19例均行抗真菌治疗,随访2个月~2年,病灶在影像学上均表现为不同程度的减小,2例基本消失。在治疗过程中,病灶体积减小,边界渐清晰,趋于结节样改变(图7~9)。
3 讨论
3.1 流行病学及临床表现 肺隐球菌病是一种较少见的亚急性或慢性真菌感染[1]。新生隐球菌广泛存在于自然界,尤其是土壤及禽粪中,没有荚膜,易形成气溶胶,可经呼吸道吸入至肺泡引起肺隐球菌。但隐球菌在人体组织内形成一层厚厚的荚膜,不易形成气溶胶,因此未发现本病在人与人之间传播[2]。中枢神经系统最常受累,其次是肺[3]。本组有长期粉尘接触史1例,养鸽子史1例,桑拿史1例,可能与其接触有关。近年来肺隐球菌病的发病率逐年增加,常见于免疫功能低下者,HIV感染者发病率达5% ~10%[4]。Chang等[5]发现在免疫抑制患者中,合并中枢系统感染患者的比例大于免疫正常患者,两者差异有统计学意义。本研究认为在免疫抑制患者中,更易合并其他系统的隐球菌感染。
肺隐球菌病临床表现无明显特异性,常见于体检或在其他疾病时发现[6,7]。本组5例为无症状体检发现者。
3.2 CT表现 肺隐球菌病的影像学表现具有多样性,与患者的病程及机体的免疫状态相关。急性早期或免疫力低下的患者病理常形成胶样变,病变以炎性渗出、凝固性坏死及脓肿形成为主,CT表现为片状、斑片状影或大片实变影,可伴空洞影,随着病程迁延,部分渗出性病灶转变为增生性病灶,形成非干酪性肉芽肿,CT表现为结节或肿块影[8]。肺隐球菌病的影像学表现有:结节肿块型、浸润实变型、弥漫混合型,弥漫性粟粒影、间质型病变、空洞、胸腔积液及淋巴结肿大也是肺隐球菌病的特征性表现[5,9,10],但常见于免疫抑制或免疫低下患者。本组CT表现无弥漫性粟粒影及间质型病变。
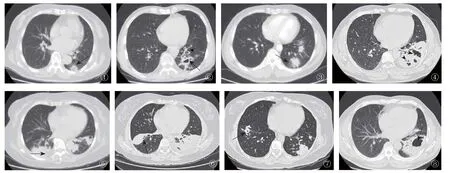
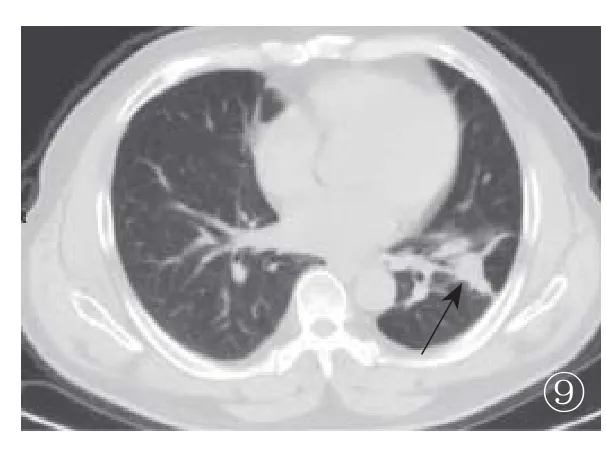
图1 左肺下叶后基底段胸膜下单发结节,边界不清,周围见毛刺、晕征,内可见低密度。图2 患者叶空洞,内可见液平(箭),近端支气管弥漫增厚(箭头)。图3 左肺下叶多发结节,外周分布为主,周围见晕征(箭)、毛刺,内可见支气管气相,伴邻近胸膜增厚。图4 左肺大片实变影,密度较高,边界清,内可见不规则空洞(箭)、支气管气相(箭头),伴左侧胸腔积液。图5 双肺下叶胸膜下实变影,内可见支气管气相(箭),密度较高,边界尚清。图6 混合型病灶,右下肺肿块影,左下肺实变影,内可见支气管气相(箭),密度高,边界清。图7 图6患者治疗20d后病灶缩小、局限,右肺病灶内见小空洞(箭)。图8 图4患者治疗3个月后复查,病灶实质成分减少,蜂窝样坏死病灶部分融合吸收,形成空洞气液平(箭)。图9 图4患者治疗1年后,病灶空洞及液平消失,病灶机化(箭)
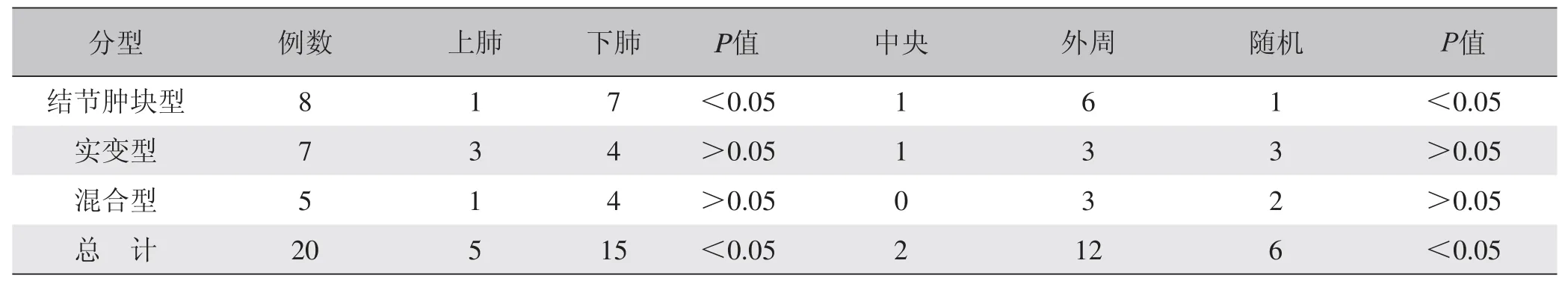
表1 肺隐球菌病CT表现分型及分布
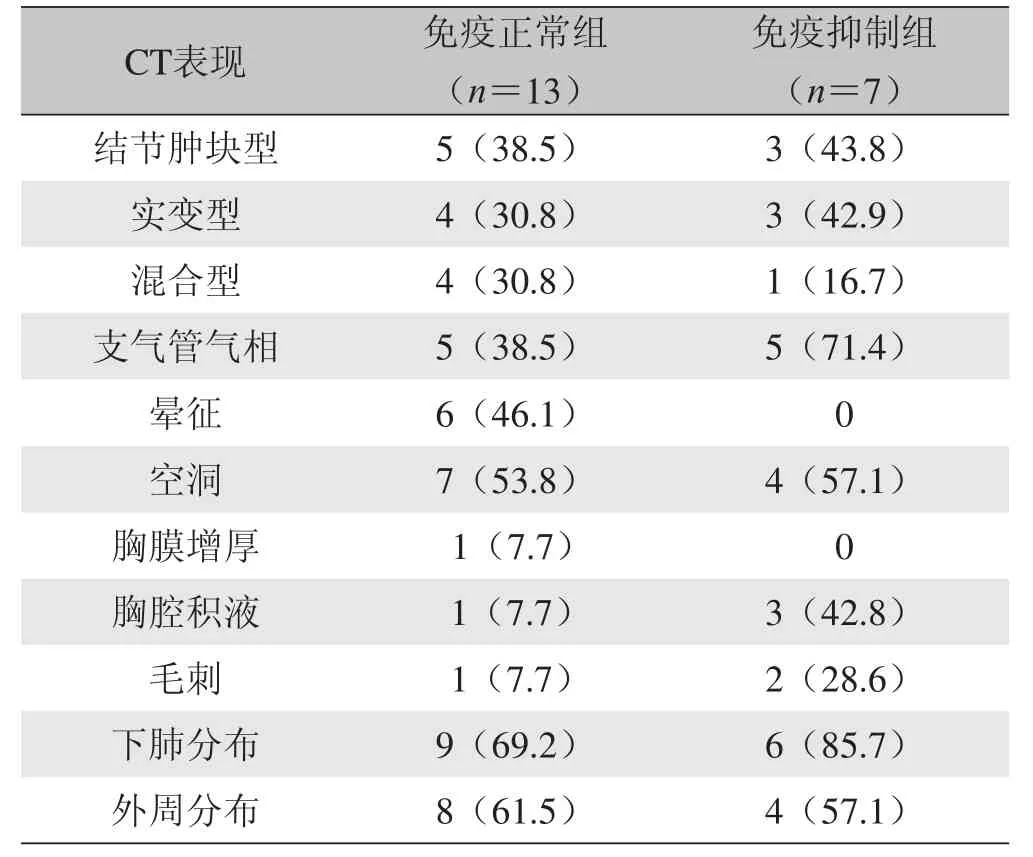
表2 免疫正常患者及免疫抑制患者CT表现比较[n(%)]
3.2.1 结节肿块型8例 病程1~3个月。结节大小不一,4例边缘光滑,可伴有分叶(1例)、邻近胸膜增厚(1例)、胸腔积液(2例)及毛刺(1例),但无胸膜凹陷征,4例出现晕征。病灶以在下肺、外周分布为主,与文献[11,12]报道相同。结节肿块型是免疫功能正常者最常见的类型,占所有类型病变的72% ~91%[5,13,14],但本组中,免疫正常组结节肿块型病变仅5例,可能与病例数较少、患者病程不同有关。
3.2.2 实变型7例 病程5d~1个月,较结节肿块型病变病程短。局限性实变影密度较一般炎症高,形态为胸膜下楔形影或趋于结节样改变,边界清,周围磨玻璃改变少,可能与其早期病理改变为胶样变或向慢性期转变形成非干酪性肉芽肿有关。多发性病灶随机分布于双肺,病变周围模糊,可见磨玻璃密度影,与其他感染或肉芽肿性病变不易鉴别。
3.2.3 晕征6例 为结节或肿块周围环绕的磨玻璃密度影,病理组织为肉芽肿周围炎症[10],具有一定的鉴别诊断意义。晕征在免疫正常组的出现率明显高于免疫抑制组。
3.2.4 空洞11例 Chang等[5]和Zinck等[10]分析了肺隐球菌病的CT表现,认为空洞多见于免疫功能受抑制的患者。空洞的出现可能预示着隐球菌感染更严重,需要更积极的抗真菌治疗[15]。但本组免疫正常组(7例)与免疫抑制组(4例)空洞的出现率差异无统计学意义,可能的原因为本组中免疫抑制组患者的免疫功能不如文献中免疫抑制患者(主要为AIDS)的免疫功能受损严重。本组中2例患者在治疗过程中出现空洞,空洞可随治疗而消失。空洞的出现不一定与免疫状态有关,其不仅可出现于治疗前,也是治疗后的一种表现。
3.2.5 支气管气相10例 出现率较高,于3种类型病变中均可见,支气管气相大多见于病灶近端,并不贯穿整个病灶。20例患者中仅1例出现病变近端支气管壁弥漫增厚,走行紊乱,可能与其合并皮肤肺隐球菌病及免疫功能低下有关,余支气管近端管壁形态良好,未见增厚,远端支气管逐渐变窄深入病灶内。
3.2.6 病灶分布 以下肺(15/20)、外周(12/20)为主,分布情况差异有统计学意义,有助于本病的诊断。
3.3 鉴别诊断 肺隐球菌病的CT表现多样,极易误诊。本组中,除2例在诊断前已知为肺隐球菌感染,其余18例诊断为肉芽肿性病变5例,炎性病变7例,特殊感染4例(结核3例,真菌1例),肺癌2例。单发结节或肿块型病灶需与肺癌、肺脓肿、炎性假瘤等鉴别。肺隐球菌病病灶边缘较光滑,毛刺、分叶及胸膜凹陷征少见,支气管壁光滑不厚,晕征多见,可与肺癌肿块相鉴别。肺脓肿可表现为类圆形肿块,周围可见晕征,内见空洞、液平,但其临床表现较重,伴高热、咳脓痰等症状,短期抗感染治疗后病灶缩小明显。多发结节或肿块需与肺结核、肺韦格肉芽肿、肺转移瘤等鉴别。肺隐球菌病好发于下肺外带,大小不均,可见晕征等征象有助于鉴别。大叶实变型肺隐球菌病常误诊为普通细菌性炎症,但肺隐球菌病实变密度较高,边界清,磨玻璃密度少见,与一般细菌性大叶性肺炎表现不同。
[1]Jarvis JN, Harrison TS.Pulmonary cryptococcosis.Semin Respir Crit Care Med, 2008, 29(2):141-150.
[2]牟向东, 李若瑜, 万喆, 等.血清乳胶凝集试验诊断肺隐球菌病的临床对照研究.中华结核和呼吸杂志, 2008,5(31): 360-363.
[3]Hung MS, Tsai YH, Lee CH, et al.Pulmonary cryptococcosis: clinical, radiographical and serological markers of dissemination.Respirology, 2008, 13(2):247-251.
[4]应可净, 江立斌, 胡红杰, 等.非人类免疫缺陷病毒感染者肺隐球菌病14例影像学分析.中华放射学杂志,2006, 40(1): 104-105.
[5]Chang WC, Tzao C, Hsu HH, et al.Pulmonary cryptococcosis: clinical and radiographic characteristics in immunocompetent and immunocompromised patients.Chest, 2006, 129(2): 333-340.
[6]Wu B, Liu H, Huang J, MD, et al.Pulmonary cryptococcosis in non-AIDS patients.Clin Invest Med,2009, 32(1): 70-77.
[7]Kishi K, Homma S, Kurosaki A, et al.Clinical features and high-resolution CT findings of pulmonary cryptococcosis in non-AIDS patients.Respir Med, 2006, 100(5):807-812.
[8]Kerkering TM, Duma RJ, Shadomy S.The evolution of pulmonary cryptococcosis: clinical implications from a study of 41 patients with and without compromising host factors.Ann Inter Med, 1981, 94(5):611-616.
[9]Lindell RM, Hartman TE, Nadrous HF, et al.Pulmonary cryptococcosis: CT findings in immunocompetent patients.Radiology, 2005, 236(1):326-331.
[10]Zinck SE, Leung AN, Frost M.Pulmonary cryptococcosis:CT and pathologic findings.Comput Assist Tomogr, 2002,26(3): 330-334.
[11]吴伟本, 俞同福, 徐海, 等.肺隐球菌病的CT表现.中国真菌学杂志, 2010, 5(4): 227-229.
[12]徐礼裕, 柳德灵, 余英豪, 等.病理确诊的肺隐球菌病38例临床分析.中华结核和呼吸杂志, 2011, 34(9):653-656.
[13]邵江, 史景云, 尤正千, 等.肺隐球菌病的CT表现.中华放射学杂志, 2004, 38(8): 831-833.
[14]Kishi K, Homma S, Kurosaki A.Clinical features and highresolution CT fi ndings of pulmonary cryptococcosis in non-AIDS patients.Respiratory Medicine, 2006, 100(5):807-812.
[15]Friedman EP, Miller RF, Severn A, et al.Cryptococcal pneumonia in patients with the acquired immunodeficiency syndrome.Clin Radiol 1995, 50(11): 756-760.
