参术胶囊对脾虚胃癌小鼠T细胞活化信号的影响
2012-12-06邓青秀谢晓芳
邓青秀,彭 成,敖 慧,谢晓芳
(成都中医药大学,四川 成都 610075)
参术胶囊处方来源于《证治准绳》中治疗脾气虚证之“参术膏”。实验研究表明参术胶囊能明显改善瘤细胞的异型性,并能通过调控与代谢、离子通道和运输蛋白等相关基因来发挥治疗脾虚胃癌转移鼠[1-2]。机体的免疫功能状态与脾虚胃癌的发生密切相关。因此,本研究以诱发性脾虚胃癌小鼠为模型,观察参术胶囊对脾虚胃癌小鼠T细胞活化信号的影响,进一步明确参术胶囊抗肿瘤作用的分子机制和作用靶点。
1 材料与方法
1.1 主要试剂和仪器 免疫组化一抗:MHC-Ⅰ大鼠抗小鼠IgG(英国ABCAM公司,货号:ab15681),MHC-Ⅱ大鼠抗小鼠(美国MILLIPORE公司,批号:NRG1810099),B7-1兔抗大鼠IgG(北京博奥深公司,批号909002W),CD4兔抗大鼠IgG(北京博奥深公司,批号:900283W),CD8兔抗大鼠IgG(北京博奥深公司,批号900280W),SABC免疫组化试剂盒(武汉博士德生物工程有限公司,批号:11888800),碱磷酶底物AP-Red试剂盒(北京中衫金桥有限公司,批号:P106723C),显色剂 DAB(武汉博士德生物工程有限公司,批号:112452Q)。电子天平PA2003(上海天平仪器厂),Olympus-BX50光学显微镜(日本)。
1.2 药物 参术胶囊(由成都中医药大学药学院提供,由红参皂苷、白术油、红参白术复合多糖,每g提取物含10 g原生药,批号20080401),胃复春片(杭州胡庆余堂药业有限公司,0.359克/片,批号:20090712),山西白醋(山西老陈醋集团有限公司,标准代号:GB18187.2000),N-亚硝基二乙胺(DENA)(日本TCI公司,批号:BW03821)。
1.3 诱发性脾虚胃癌模型的制备 KM小鼠,♀♂各半,体质量22~26 g,由成都中医药大学动物中心提供[SPF级,许可证号SCXK(川)2008-11]。按体重随机取17只小鼠作为空白组,其余按以下方法造模:禁食24 h后首日给予山西白醋 15 ml·kg-1·d-1,次日给予 10 ml·kg-1·d-1灌胃,连续9 d,d 10给予 N-亚硝基二乙胺(DENA)按2.8 mg·kg-1·d-1灌胃,连续 110 d。
1.4 动物分组和处理 将剩余的227只小鼠随机分成5组,其中模型组56只,阳性组51只,高剂量组46只,中剂量组34只,低剂量组40只,其中模型组不予处理,阳性组按718 mg·kg-1·d-1灌胃给药胃复春片,高剂量组按参术胶囊 440 mg·kg-1·d-1,中剂量组按 220 mg·kg-1·d-1,低剂量组按110 mg·kg-1·d-1灌胃给药,连续30 d。每隔 10 d测量体重、5 min自发活动、观察脾虚表现(饮水量、自发活动数、精神状态,有无便溏、腹胀、耸毛、眯眼等)。治疗30 d后称取小鼠重量,再脱颈椎处死小鼠,取胃于10%福尔马林固定,石蜡包埋、切片、HE染色,镜下观察胃组织切片的变化。每组随机取10只动物标本,按免疫组化SABC法操作流程进行,浆或膜呈棕黄色-黄色表达为阳性。采用OlympusBX50显微镜,在40×10倍光学显微镜下,用泰盟 BI-2000医学图像分析系统将免疫组化图像采集,半定量分析表达情况。每张切片(每例动物标本)随机选取5个视野,计数阳性(表达)细胞个数,取平均数。
1.5 统计学方法 采用SPSS13.0统计学软件。计量资料以±s表示,用单因素方差分析法进行组间差异显著性分析。
2 实验结果
2.1 一般状态表现 脾虚胃癌模型组在实验过程中动物出现不同程度的脾虚表现,小鼠毛色灰暗、失去光泽、形体瘦弱、行动迟缓、精神萎靡不振、摄食量和饮水量减少。用药30 d后,参术胶囊高、中、低剂量组均能明显提高模型动物的存活率、体重及5 min自发活动数。
2.2 胃组织病理表现 胃癌模型组组织结构紊乱,呈浸润性生长,与周围组织分界不清,癌细胞中等偏大,呈圆形、椭圆形、多边形及不规则形,胞质较少,核染色较深,呈椭圆形、三角形及不规则形,数呈空泡形,核分裂象较多,核仁粗大,位于核中或偏位,多数具有一个核仁,少数有两个或者以上染色深。用药30d后,胃复春片组、参术胶囊高、中、低剂量均能明显减轻病理改变。
2.3 参术胶囊对诱发性脾虚胃癌模型T细胞活化信号的影响 模型组胃组织表达的MHC-Ⅰ、MHC-Ⅱ、B7-1、CD4、CD8阳性细胞数均低于正常组。胃复春片组和参术胶囊高剂量组均能明显增加模型动物胃组织 MHC-Ⅰ、MHC-Ⅱ、B7-1、CD4、CD8的表达(P<0.05)。参术胶囊低剂量组MHC-Ⅰ、B7-1、CD4、CD8阳性细胞数较模型增加明显(P<0.05),MHC-Ⅱ表达的阳性细胞数较模型有增加趋势。参术胶囊中剂量组能明显增加模型动物MHC-Ⅰ、MHC-Ⅱ、B7-1、CD4的表达(P<0.01),CD8表达的阳性细胞数有增加趋势。
Tab 1Effect of Shenshu capsules on T activation signals of spleen-deficient gastric cancer mice(±s,n=10)
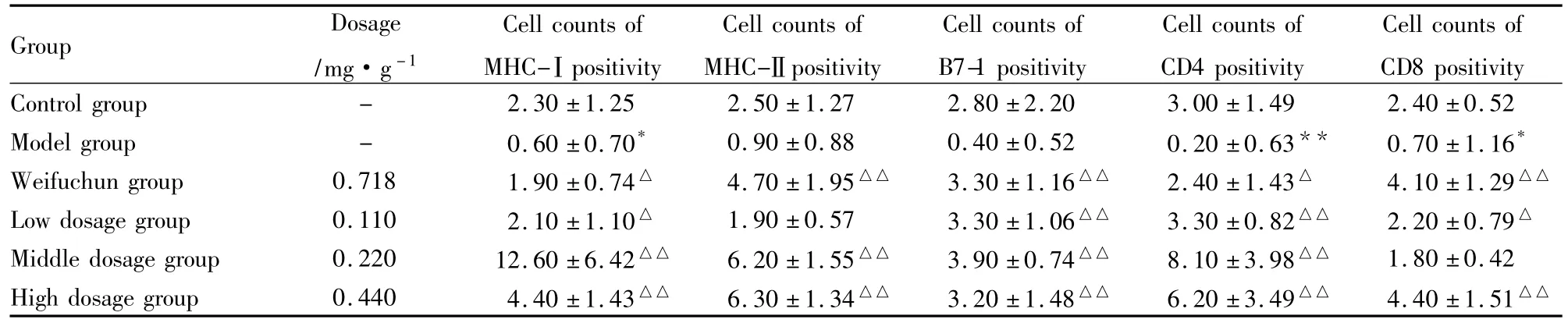
Tab 1Effect of Shenshu capsules on T activation signals of spleen-deficient gastric cancer mice(±s,n=10)
*P <0.05,**P <0.01 vs control;△P <0.05,△△P <0.01 vs model
Group Dosage/mg·g-1 Cell counts of MHC-Ⅰpositivity Cell counts of MHC-Ⅱpositivity Cell counts of B7-1 positivity Cell counts of CD4 positivity Cell counts of CD8 positivity Control group - 2.30 ±1.25 2.50 ±1.27 2.80 ±2.20 3.00 ±1.49 2.40 ±0.52 Model group - 0.60 ±0.70* 0.90 ±0.88 0.40 ±0.52 0.20 ±0.63** 0.70 ±1.16*Weifuchun group 0.718 1.90 ±0.74△ 4.70 ±1.95△△ 3.30 ±1.16△△ 2.40 ±1.43△ 4.10 ±1.29△△Low dosage group 0.110 2.10 ±1.10△ 1.90 ±0.57 3.30 ±1.06△△ 3.30 ±0.82△△ 2.20 ±0.79△Middle dosage group 0.220 12.60 ±6.42△△ 6.20 ±1.55△△ 3.90 ±0.74△△ 8.10 ±3.98△△ 1.80 ±0.42 High dosage group 0.440 4.40 ±1.43△△ 6.30 ±1.34△△ 3.20 ±1.48△△ 6.20 ±3.49△△ 4.40 ±1.51△△
3 讨论
细胞表面MHC-Ⅰ、MHC-Ⅱ类分子和共刺激分子的弱表达与丢失,导致免疫细胞的应答无能是导致肿瘤细胞逃逸机体免疫监视和逃逸特异性CTL抗肿瘤免疫应答的重要机制[3-4]。中药药理研究结果发现,许多中药在调节机体免疫功能方面独具优势[5-8]。本研究发现,脾虚胃癌模型胃组织内 CD4、CD8、MHC-Ⅰ、MHC-Ⅱ、B7-1 表达下调,T 细胞活化信号减弱,使T细胞处于无能状态,导致肿瘤细胞逃避免疫监视。经参术胶囊治疗后,能明显改善胃组织的病理变化,上调胃组织内 CD4、CD8、MHC-Ⅰ、MHC-Ⅱ、B7-1 的表达。说明参术胶囊是通过增强T细胞活化双信号T细胞受体(TCR)与抗原肽—MHC复合物和共刺激分子B7-1的表达,使T细胞活化的信号转导借助于CD3分子及CD4/CD8分子和CD28等分子的辅助,将胞外刺激信号传递至细胞内部,使转录因子活化,转位到核内,活化相关基因。
CD8+T细胞的激活不同于CD4+T细胞的激活。CD8+T细胞作用的靶细胞一般低表达或不表达协同刺激分子,不能有效激活初始CD8+T细胞,而需要CD4+T细胞产生的IL-2等细胞因子的辅助增殖,才能分化为CD8+T细胞,本研究发现参术胶囊有可能通过增强CD4+T的表达,进而增强CD8+T细胞的活性,并通过细胞凋亡和细胞裂解机制杀伤肿瘤细胞,抑制脾虚胃癌的发生发展。
[1]叶 冰,彭 成.参术胶囊对脾虚胃癌转移鼠胃癌细胞形态影响的研究[J].实验动物科学与管理,2006,23(3):15-8.
[1]Ye B,Peng C.Study on Morphology effects of Shenzhu capsules on gastric cancer cells in spleen-deficiency gastric cancer metastasis mice[J].Lab Anim Sci Adm,2006,23(3):15-8.
[2]敖 慧,彭 成,林代华,等.参术胶囊治疗脾虚胃癌转移鼠模型的基因表达谱研究[J].云南中医学院学报,2010,33(1):7-11.
[2]Ao H,Peng C,Lin D H,et al.Study on gene Expression profile induced by the model with spleen-deficiency and gastric cancerometastasis in mice treated by Shenzhu Capules[J].J Yunnan Coll Tradit Chin Med,2010,33(1):7-11.
[3]Santori F R,Arsov I,Vukmanovic S.Modulation of CD8+T cell response to antigen by the levels of self MHC class I[J].J Immunol,2001,166(9):5416.
[4]Schwartz R H.A cell culture model for T lymphocyte clonal anergy[J].Science,1990,4961:1349-56.
[5]朱 伟,孙红光,朱 迅.黄芩有效成分SBM对炎症模型及免疫功能的影响[J].中国药理学通报,2008,24(9):1147-50.
[5]Zhu W,Sun H G,Zhu X.Effects of Scutellaria baicalensis fraction on inflammatory animal model and immune function[J].Chin Pharmacol Bull,2008,24(9):1147-50.
[6]沈自尹,吴志军,于立华,等.淫羊藿总黄酮对皮质酮诱导免疫功能低下大鼠的保护作用及配伍研究[J].中国药理学通报,2007,23(8):1061-3.
[6]Shen Z Y,Wu Z J,Yu L H,et al.Study the protection and combination on the total flavones of epimedium to the immunodeficiency rats induced by corticosterone[J].Chin Pharmacol Bull,2007,23(8):1061-3.
[7]张维东,张月英,王朝霞,等.柞蚕雄蛾提取液对荷瘤大鼠放疗后免疫功能的影响[J].中国药理学通报,2008,24(8):1115-6.
[7]Zhang W D,Zhang Y Y,Wang Z X,et al.Effect of the extract from male zooid of an antheraea pernyi on immune function in tumor bearing rats after radiation therapy[J].Chin Pharmacol Bull,2008,24(8):1115-6.
[8]曲婷婷,金 岩,柳越冬,等.人参皂苷Rb1、Rg1与5-氟脲嘧啶对荷瘤小鼠免疫功能的影响[J].中医研究,2006,19(5):16-8.
[8]Qu T T,Jin Y,Liu Y D,et al.Effect of ginsenoside Rb1 and Rg1 and 5-fluorouracil on the immune function of tumor-bearing mice[J].Tradit Chin Med Res,2006,19(5):16-8.
