高脂乳对大鼠神经炎症的产生及其机制的初步研究
2012-12-06胡金凤楚世峰齐孟和吴苗苗陈乃宏
何 鑫,胡金凤,楚世峰,齐孟和,3,吴苗苗,陈乃宏
(1.天然药物活性物质与功能国家重点实验室,中国医学科学院药物研究所,北京 100050;2.天津中医药大学,天津 300193;3.内蒙古医学院,呼和浩特 010059)
炎症是一个对外来入侵(如压力、外伤、感染等)进行复杂的细胞及分子应激并试图抵抗这种入侵的过程[1]。神经系统发生的炎症反应(神经炎症)是脑中小胶质细胞、星形胶质细胞的激活并使得细胞因子、趋化因子、神经递质和氧自由基(ROS)等炎症介质释放的过程[2]。神经炎症的发生与神经退行性疾病的发生密切相关。神经退行性疾病包括阿尔采末病、帕金森病、亨廷顿病、肌萎缩,tauopathies、年龄相关的黄斑退化等,研究表明[3],在这些疾病的病理现象中均观察到神经炎症的发生。
大量的研究报道称现今社会的发展致使人们饮食结构发生改变,高脂饮食充斥人们的生活。流行病学调查发现,大量的摄入胆固醇及脂肪使得高脂血症频发,进而引起其它的病变如肥胖症、脑血栓、冠心病、脂肪肝、高血压、糖尿病、脑卒中及一些神经退行性疾病等[4]。并且,高脂饮食导致的神经系统疾病伴随着神经炎症的发生,也有很多研究者对此进行了大量的实验研究,但是所采用的高脂饮食模型的造模方法均是通过给予高脂饲料进行饲养[5-7],该方法是由动物自由摄取高脂饲料,其摄入量不可控,从而使得动物模型组内差异较大。而如若定量通过灌胃给予高脂乳,动物摄取脂肪及胆固醇的量变为可控的,可缩小动物组内差异,而使模型较稳定。所以本文致力于定量给予高脂乳造模研究其对神经炎症的激发及相关机制。
1 方法
1.1 动物及分组 SD大鼠,30只,♂,体质量240~270 g;北京维通利华实验动物技术有限公司[SCXK(京)2009-0017]。
1.2 造模方法 大鼠随机分为空白组、模型组,每组15只。空白组灌胃给水,1 ml/100 g,模型组灌胃给予高脂乳(高脂乳配方:油相-猪油100 g,胆固醇40 g,胆酸钠 4 g;水相-水 120 ml,丙二醇 80 ml,吐温-80 100 ml,丙硫氧嘧啶 4 g),1 ml/100 g,两组自由饮食饮水,造模2个月。
1.3 Western blot分析蛋白表达及磷酸化水平大鼠断头取脑后,冰上分离海马、皮层、纹状体。按100 g·L-1的稀释比例,用组织匀浆器匀浆,匀浆液4℃,12 000×g离心20 min,收集上清。采用 BCA定量试剂盒进行蛋白定量后,加入上样缓冲液煮沸变性。蛋白样品经12%SDS-PAGE胶分离后转移至PVDF膜上,3%BSA室温封闭2h,加入一抗4℃过夜,TBS-Tween洗涤3次后加上HRP标记的二抗,室温孵育2 h,再经TBS-Tween洗涤3次后加上ECL发光液进行检测。
1.4 ELISA法检测炎症因子含量 海马、皮层、纹状体组织匀浆同上。匀浆液4℃,12 000×g离心10 min,收集上清。按照大鼠ELISA试剂盒操作说明测定脑匀浆液中炎症因子TNF-α、IL-1β的含量。

Fig 1 Expression of OX42 and GFAP in hippocampus,cortex and striatum of rats fed on high-fat dairy is determined by Western blot(n=5)
1.5 免疫组织化学观察星形胶质细胞的激活 造模结束后,10%水合氯醛350 mg·kg-1腹腔麻醉大鼠。4%多聚甲醛经心脏灌流,取脑置于甲醛溶液中固定24小时后,石蜡包埋、切片(片厚8 μm)。石蜡切片常规脱蜡至水,92℃枸橼酸盐缓冲液(pH 6.0)中抗原热修复10 min,室温冷却30 min,加入3%双氧水室温作用10 min以消除内源性过氧化物酶活性,非特异性位点用羊血清室温封闭15 min。加一抗GFAP稀释液(1∶50)4℃过夜,加生物素标记二抗37℃孵育1 h,再加三抗37℃孵育1 h。DAB显色,双蒸水终止反应。常规脱水至透明,中性树胶封片。采用正置显微镜观察胶质细胞在不同部位的表达情况。
2 结果
2.1 高脂乳对小胶质细胞和星形胶质细胞的活性的影响 OX42、GFAP分别是小胶质细胞及星形胶质细胞特异性标记物,本实验采用Western blot检测了高脂乳对这两种蛋白表达的影响,进而确定高脂乳对神经炎症细胞激活的影响。实验结果如Fig 1所示,与空白组相比,高脂饮食可明显增加大鼠脑海马、皮层、纹状体OX42、GFAP表达量,表明高脂乳可激活小胶质细胞和星形胶质细胞。Fig 2实验结果表明,高脂乳可使星形胶质细胞形态发生改变:细胞膨胀、肥大,突起变长,表明星形胶质细胞被激活。
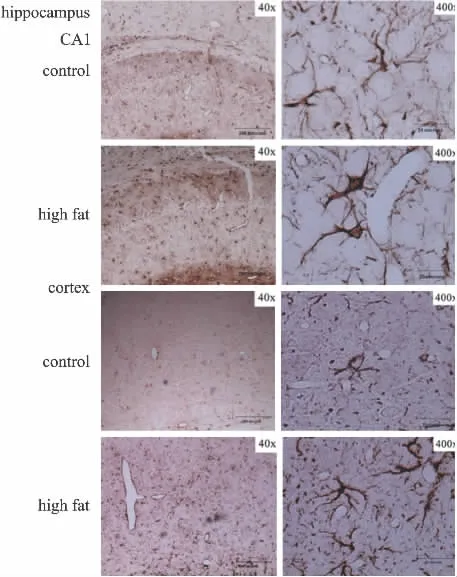
Fig 2 Immunohistochemical analysis of GFAP expression in hippocampus and cortex of rats fed on high-fat dairy
2.2 高脂乳对炎症因子产生及COX2表达的影响ELISA试剂盒检测结果表明,高脂乳能使大鼠海马、皮层、纹状体产生的炎症因子TNF-α和IL-1β的含量与空白组比明显增加(Fig 3)。并且,COX2在炎性因子刺激下可被激活,高脂乳能使大鼠脑的海马、皮层、纹状体的COX2的表达量明显增加(Fig 4),提示COX2被激活。
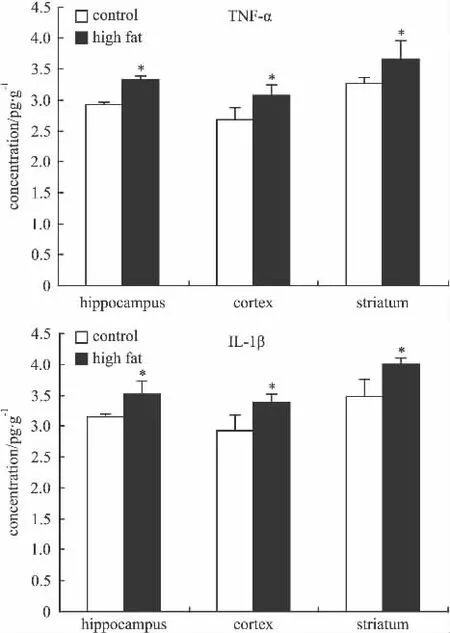
Fig 3 Effect of high-fat dairy on the content of TNF-α and IL-1β in hippocampus,cortex and striatum of rats detected by ELISA kits(n=5)
2.3 高乳脂对MAPKs表达的影响 丝裂原活化蛋白激酶(MAPKs)是广泛表达的丝氨酸/酪氨酸激酶,包括3个主要家族:ERKs、JNKs和p38 MAPKs,研究表明,其在炎症、细胞应激、凋亡、细胞周期和生长等多种生理和病理过程中起重要作用。我们的研究发现,高脂乳可使大鼠脑海马、皮层、纹状体的p38、JNK、ERK磷酸化水平与空白组比增加,但其表达量无改变(Fig 4),提示MAPK可能参与高脂乳激活的神经炎症过程。
3 讨论
本实验研究了高脂乳对SD大鼠脑海马、皮层、纹状体内神经炎症的激活情况,结果表明,高脂乳能够激活上述部位的小胶质细胞和星形胶质细胞,使TNF-α和IL-1β的产生增加,COX-2表达增加,引发脑内炎症,作用机制可能与激活了MAPK信号通路有关。
高脂饮食损伤中枢神经系统已得以确定,但其致病机制尚不明确。近年很多研究报道高脂饮食引发神经系统疾病可能是由于它激活神经炎症而导致的。而定量给予高脂乳,模型可控、较稳定。并且高脂乳所致动物脑内炎症未见报道,所以本实验对高脂乳所致神经炎症的激活进行了研究。实验结果表明,高脂乳可增加海马、皮层、纹状体内神经炎症细胞——小胶质细胞和星形胶质细胞的标记物表达量,使TNF-α和 IL-1β的产生增加,COX-2表达增加,从而证实高脂乳也可激活脑部神经炎症。
小胶质细胞和星形胶质细胞均属于神经胶质细胞,是参与脑内炎症反应的主要免疫细胞。小胶质细胞的激活表现在形态和功能改变两方面,形态观察可见起激活时胞体肿胀、突起增长,功能改变即在激活时会大量分泌不同的免疫调节肽,如细胞活素类(TNF-α和IL-1β)、趋化因子及一些非特异性的炎症因子[8]。星形胶质细胞被激活后细胞肿胀,并大量增生,产生炎性蛋白(COX2)及炎性因子[9]。本实验研究发现,高脂饮食可增加小胶质细胞标记蛋白OX42以及星形胶质标记物GFAP,而且免疫组化结果也显示,星形胶质细胞膨胀、肥大,突起变长,表明这两种炎症细胞被激活。COX2是催化花生四烯酸合成PGE2过程中的限速酶,据报道COX2与炎症反应密切相关[10]。本实验研究发现高脂乳促进COX2蛋白表达,提示高脂乳可能通过促进COX2表达,进而促进PGE2合成而发挥神经炎症作用,但其对COX2酶活性有无影响有待于进一步研究。
MAPK是介导细胞反应的重要信号系统,参与介导细胞生长、发育、分裂、分化、死亡以及细胞间的功能同步等多种细胞过程。经典的MAPK主要包括ERK、JNK、p38三个亚族,近年来也发现另一亚族ERK5/BMK1。激活的MAPK可通过磷酸化转录因子、细胞骨架相关蛋白、酶类等多种底物来调节多种细胞生理过程[11]。研究也发现,MAPK能被多种炎性刺激所激活,在介导炎症反应和细胞因子生成中起着重要的作用,表明其对炎症的发生、发展起重要调控作用[12]。我们的研究表明,在小胶质细胞、星形胶质细胞激活产生神经炎症的部位——海马、皮层、纹状体,也观察到 ERK、p38、JNK通路的激活,提示MAPK通路的激活可能参与高脂乳所致的神经炎症反应过程。
总之,本研究对高脂乳导致神经系统退行性疾病的作用机制进行了初步研究,证实了高脂乳可能通过激活MAPK途径介导神经炎症的发生、发展,这为阐释高脂饮食所致神经退行性疾病提供了理论依据。

Fig 4 Expression of high-fat dairy on the expression of COX2,ERK,JNK and p38 MAPK and the phosphorylation of MAPK in hippocampus,cortex and striatum of rats determined by Western Blot(n=5)
[1]Infante-Duarte C,Waiczies S,Wuerfel J,et al.New developments in understanding and treating neuroinflammation[J].J Mol Med,2008,86(9):975-85.
[2]Young-Jung L,Sang Bae H,Sang-Yoon N,et al.Inflammation and Alzheimer’s Disease[J].Arch Pharmacal Res,2010,33(10):1539-56.
[3]Choi D K,Koppula S,Choi M,et al.Recent developments in the inhibitors of neuroinflammation and neurodegeneration:inflammatory oxidative enzymes as a drug target[J].Expert Opin Ther Pat,2011,20(11):1531-46.
[4]Freeman L R,Haley-Zitlin V,Stevens C,et al.Diet-induced effects on neuronal and glial elements in the middle-aged rat hippocampus[J].Nutrit Neurosci,2011,14(1):32-44.
[5]Thirumangalakudi L,Prakasam A,Zhang R,et al.High cholesterolinduced neuroinflammation and amyloid precursor protein processing correlate with loss of working memory in mice[J].J Neurochem,2008,106(1):475-85.
[6]Nerurkar P V,Johns L M,Buesa L M,et al.Momordica charantia(bitter melon)attenuates high-fat diet-associated oxidative stress and neuroinflammation[J].Neuroinflammation,2011,8(64):1-19.
[7]Granholm A C,Bimonte-Nelson H A,Moore A B,et al.Effects of a saturated fat and high cholesterol diet on memory and hippocampal morphology in the middle-aged rat[J].J Alzheimers Dis,2008,14(2):133-45.
[8]Zhang F,Liu J,Shi J S.Anti-inflammatory activities of resveratrol in the brain:Role of resveratrol in microglial activation[J].Eur J Pharmacol,2010,636(2010):1-7.
[9]Rossi D,Volterra A.Astrocytic dysfunction:Insights on the role in neurodegeneration[J].Brain Res Bull,2009,80(2009):224-32.
[10]Cimino P J,Sokal I,Leverenz J.DOCK2 is a microglial specific regulator of central nervous system innate immunity found in normal and alzheimer’s disease brain[J].Am J Pathol,2009,175(4):1622-30.
[11]赵秀鹤.MAPK信号转导途径及其在神经系统疾病中作用的研究进展[J].国外医学神经病学神经外科学分册,2005,32(3):248-51.
[11]Zhao X H.MAPK signal transduction pathway and its role in nervous system disease research progress[J].Foreign Medical Sciences(Section on Neurology&Neurosurgery),2005,32(3):248-51.
[12]刘智良,罗成义.MAPK信号转导的现况及在脑创伤中的应用[J].中国临床神经外科杂志,2001,6(1):60-1.
[12]Liu Z L,Luo C H.The current status of the MAPK signal transduction pathway in traumatic brain injury[J].Chin J Clinical Neurosurgery,2001,6(1):60-61.
