小剂量氯胺酮对全麻围手术期免疫功能的影响
2012-12-04孙天小韩树海
孙天小 韩树海
全麻术后的患者常常伴随着免疫系统损伤,这可能与手术刺激及阿片类药物的应用有关,表现为炎症因子的过度表达和细胞介导的免疫反应受到抑制。炎症因子的过度表达不仅会引起严重的炎症和低血压、休克、多器官衰竭等复杂的术后并发症[1]。还将加重术后疼痛程度,而术后疼痛进一步促进炎症因子的表达[2],形成恶性循环。因此,给予镇痛药物减轻疼痛,可以抑制炎症因子的分泌,减少术后并发症,同时还能减少鸦片类药物的使用剂量。氯胺酮(ketamine,KTM)是N-甲基-D-天门冬氨酸(NMDA)受体非特异性拮抗剂。有研究报道,其可以降低术后疼痛评分,并减少吗啡用量,同时提示KTM与疼痛评分降低之间具有剂量正相关性[3]。在疼痛形成的早期阶段给予小剂量KTM即能够发挥镇痛的效果[4-5]。但术前应用KTM除具有良好术后镇痛作用外,是否能起到减轻由鸦片类药物产生的免疫功能损伤的作用尚无定论。由此,本研究旨在通过测定手术前后血清中炎症因子的表达,评估小剂量KTM对妇科腹腔镜术后早期免疫功能的影响。
1 资料与方法
1.1 一般资料 选取择期行妇科腹腔镜手术患者60例,年龄20~40岁,体重45~70 kg,ASA I级,无高血压病、冠心病史,心肺功能正常,无严重肝肾功能异常,既往无精神障碍、慢性疼痛、酗酒史。近期无应用镇痛、镇静药史,无麻醉性镇痛药物成瘾及吸毒史。将患者随机分为对照组与研究组,每组各30例。
1.2 麻醉方法 术前30 min肌注阿托品0.5 mg和安定10 mg。进入手术室后连续监测。两组患者均用咪唑安定0.1 μg/kg、丙泊酚20 mg/kg、芬太尼4 μg/kg和阿曲库铵6 μg/kg行静脉快速诱导气管插管。插管后通过麻醉机行机械通气。呼吸模式IPPV,监测VT和RR,吸呼比为1:2,控制PETCO235~45 mm Hg。全身麻醉维持均以微量输液泵持续泵入丙泊酚 60~80 μg/(kg·min),雷米芬太尼0.05~ 0.15 μg/(kg·min)和阿曲库铵6~8 μg/(kg·min)。研究组在切皮前给予KTM 0.3 mg/kg静脉注射,手术前10 min停止阿曲库铵泵入。对照组手术结束时停止丙泊酚和雷米芬太尼泵入。
1.3 检测方法 所有患者于手术前和术后4、24、48和72 h收集静脉血液样本(4 ml),不加抗凝剂,测定IL-1β、IL-2、IL-6和TNF-α血清含量。标本于室温放置2 h,3000 r/min离心15 min,溶血标本弃用重留。取血清500 μl置ep管,-78 ℃冰箱冻存,ELISA法定量测定血清IL-6、TNF-α浓度。人IL-1β、IL-2、IL-6和TNF-α酶联免疫分析试剂盒购自中美合资武汉中美科技有限公司,严格按照试剂盒操作要求操作。日本BIO-RAD Model 680酶标仪在450 nm波长测各孔的光密度(OD值),用Curve expert 1.3软件绘制标准曲线,计算相应样品浓度。
1.4 统计学处理 采用SPSS 13.0 统计软件进行统计学处理,组内各时间点前后比较采用方差分析,组间各时间点比较采用t检验,测量结果以均数±标准差()表示,P<0.05为差异有统计学意义。
2 结果
研究组和对照组术前IL-1β、IL-2、IL-6和TNF-α水平无显著性差异。术后各时间点炎症因子水平变化如下:IL-1β:术后24、48、72h两组患者血清IL-1β水平较术前均显著增加,但组间比较差异不具有统计学意义(P<0.05)。IL-2:术后各时间点,对照组IL-2表达均降低,而研究组IL-2与术前比较无明显变化。两组间各时间点比较均不具有统计学意义(P<0.05)。IL-6:术后4 h,对照组IL-6表达升高,但研究组没有变化,两组间比较差异具有统计学意义(P<0.05)。术后24、48及72 h,两组IL-6表达均有所增加,但两组间比较差异不具有统计学意义(P>0.05)。TNF-α:术后4 h,研究组TNF-α表达水平与术前相似,而对照组中TNF-α显著升高,组间比较差异具有统计学意义(P<0.05)。无论是对照组还是研究组,术后24,48和72 h TNF-α表达均升高。两组间术前及术后各时间点IL-1β、IL-2、IL-6和TNF-α表达情况见表1。
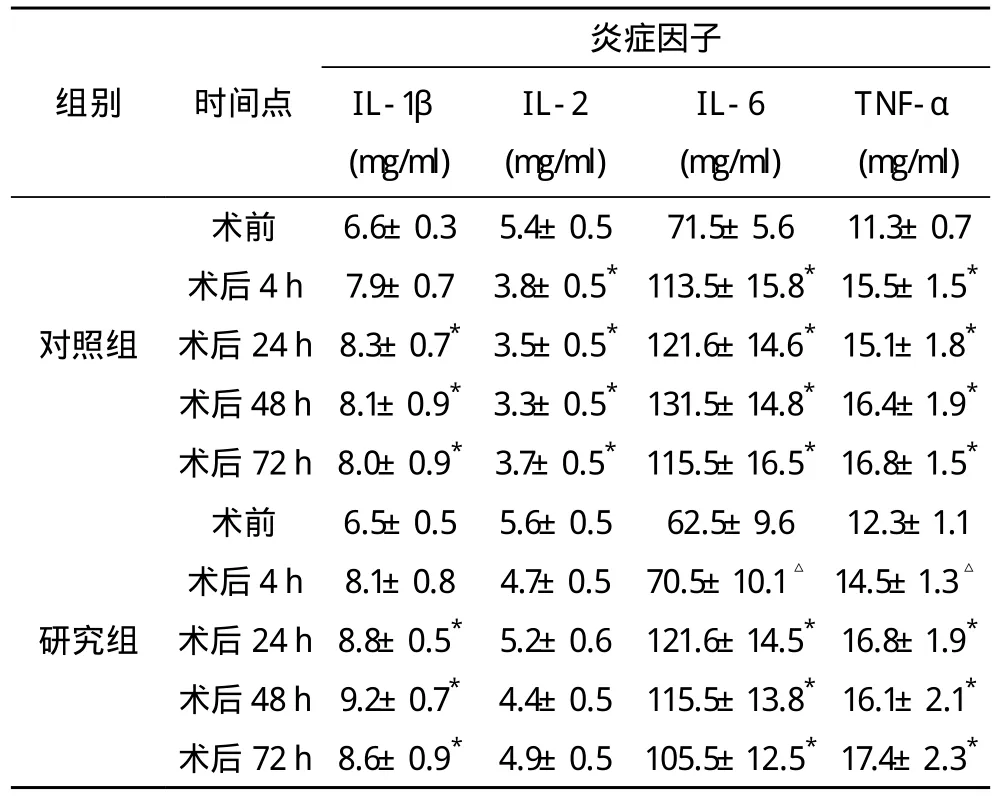
表1 两组间术前及术后各时间点IL-1β、IL-2、IL-6和TNF-α表达情况
3 讨论
本研究结果表明,在接受麻醉诱导后,患者血清中IL-6和TNF-α表达会增加,而给予小剂量的KTM会减缓这一变化,至少在手术后4 h具有这样的效果。此外,给予KTM可使术前IL-2水平保留24 h。部分学者指出,预先给予小剂量KTM会显著减少术后疼痛和对吗啡的需求[5]。而且,术后疼痛的减弱也使淋巴细胞增殖的抑制作用得到缓解,并削弱手术创伤产生的促炎症细胞因子反应。亦有研究表明,在体外循环心脏手术中,在诱导麻醉过程中给予小剂量KTM,术后7 d其血清内的IL-6水平都会显著降低[6]。KTM会抑制由于注射内毒素而产生的低血压、代谢性酸中毒以及细胞因子反应,而且抑制作用与KTM的用量无相关性[7]。Roytblat等[8]报道,在给予芬太尼麻醉的同时给予低剂量KTM,将会在腹式子宫切除术后4~72 h抑制IL-6的表达。对于严重烧伤的患者,无论是否使用芬太尼,低剂量的KTM都会使血清中的 IL-1,IL-6 和 TNF-α 减 少[9]。Kawasaki等[10-11]在体外对人类全血进行研究,发现KTM对LPS诱导的TNF-α、IL-6、IL-8具有抑制作用。TNF-α是第一个被发现可以通过巨噬作用刺激IL-6和IL-8分泌的细胞因子。鉴于KTM事实上也抑制TNF-α诱导的IL-6和IL-8的分泌,因此,IL-6和IL-8的减少不仅是由于TNF-α的抑制,同时也是由于KTM在对这些细胞因子的直接抑制效果。由于这项研究中的免疫性质只是测量了一些固定的时间点,因此,在患者中观测到的术后细胞因子分泌的减少可能是促炎症反应减弱或者延迟的一种体现。IL-6、TNF-α作为促炎症细胞因子,其作用已被广泛证明。有报道指出这些细胞因子在败血症、哮喘、心脏衰竭、创伤以及烧伤患者中会增加[12-16]。Feghali等[17]在其综述中详细描述了创伤条件下炎症因子在体液和组织中的重要作用。IL-6和TNF-α都参与了急性和慢性的炎症,且IL-6还具有调节细胞反应的作用。因此,可以推断由KTM介导的IL-6和TNF-α分泌阻断会对患者的康复起到良好的效果。另一方面,由于IL-2在调节细胞免疫和体液炎症反应中起到了重要作用,KTM保持其在术前水平同样可以避免术后并发症。
综上所述,本研究结果表明,全麻诱导前给予小剂量KTM会减弱IL-6和TNF-α表达,同时维持IL-2在手术前的水平,提示小剂量KTM在防止全麻术后早期免疫功能受损中具有重要价值。
[1]Dinarello C A.Proinflammatory and anti-inflammatory cytokines as mediators in the pathogenesis of septic shock[J].Chest,1997,112(1):321-327.
[2]Beilin B,Shavit Y,Trabekin E,et al.The effects of postoperative pain management on immune response to surgery[J].Anesth Analg,2003,97(1):822-827.
[3]Cherry D A,Plummer J L,Gourlay G K,et al.Ketamine as an adjunct to morphine in treatment of pain[J].Pain,1995,62(1):119-121.
[4]Tverskoy M,Oz Y,Isakson A,et al.Preemptive effect of fentanyl and ketamine on postoperative pain and wound analgesia[J].Anesth Analg,1994,78(1):205-209.
[5]Roytblat L,Korotkoruchko A,Katz J,et al.Postoperative pain:the effect of low-dose ketamine in addition to general anesthesia[J].Anesth Analg,1993,77(1):1161-1163.
[6]Roytblat L,Talmor D,Rachinsky M,et al.Ketamine attenuates the interleukin-6 response after cardiopulmary bypass[J].Anesth Analg,1998,87(2):266-271.
[7]Taniguchi T,Takemoto Y,Kanakura H,et al.The dose-related effects of ketamine on mortality and cytokine responses to endotoxininduced shock in rats[J].Anesth Analg,2003,97(2):1769-1772.
[8]Roytblat L,Roy-Shapira A,Geemberg L,et al.Preoperative low dose ketamine reduces serum interleukin-6 response after abdominal hys- terectomy[J].Pain Clin,1996,9(2):327-334.
[9]Xia JG,Peng J,Xiao H,et al.Effect of intravenous patientcontrolled intravenous analgesia with small dose of keta-mine during shock stage on cytokine balance in patients with severe burn[J].Zhongguo Wei Zhong Bing Ji Jiu Yi Xue,2006,18(1):32-35.
[10]Kawasaki C,Kawasaki T,Ogata M,et al.Ketamine isomers suppress superantigen-induced proin?ammatory cytokine production in human whole blood[J].Can J Anaesth,2001,48(2):819-823.
[11]Kawasaki T,Ogata M,Kawasaki C,et al.Ketamine suppresses proin?ammatory cytokine production in human whole blood in vitro[J].Anesth Analg,1999,89(2):665-669.
[12]Marano M A,Fong Y,Moldawer L L,et al.Serum cachectin tumor necrosis factor in critically ill patients with burns correlates with infections and mortality[J].Surg Gynecol Obstet,1990,170(1):32-38.
[13]Casey L C,Balk R A,Bone R C.Plasma cytokine and endotoxin levels correlate with survival in patients with the sepsis syndrome[J].Ann Intern Med,1993,119(2):771-778.
[14]Hill G A,Anderson J L,Lyden E R.Ketamine inhibits the proinflam-matory cytokine-induced reduction of cardiac intracellular cAMP accumulation[J].Anesth Analg,1998,87(2):1015-1019.
[15]Ying S,Robinson D S,Varney V,et al.TNFa mRNA expression in allergic inflammation[J].Clin Exp Allergy,1991,21(2):745-750.
[16]Matsumori A,Yamada T,Suzuki H,et al.Increased circulating cytokines in patients with myocarditis and cardiomyopathy[J].Br Heart J,1994,72(2):561-566.
[17]Feghali C A,Wright T M.Cytokines in acute and chronic inflammation[J].Front Biosci,1997,2(1):12-26.
