蛋白激酶与植物渗透胁迫耐受研究进展
2012-12-02吴祖建
杨 靓,吴祖建
(福建农林大学福建省植物病毒学重点实验室,福建福州350002)
Ferreira等在拟南芥中发现了P34cdc2蛋白激酶同系物之后(Ferreira et al.,1991),植物蛋白激酶的研究开始得到重视,虽然植物蛋白激酶的研究起步较晚,但是借助其他物种中蛋白激酶的研究平台,其发展速度较快。目前的研究表明,蛋白激酶基因在植物中广泛存在,据估计,蛋白激酶基因约占植物结构基因的1%-3%。植物中的蛋白激酶大都属于丝/苏氨酸类蛋白激酶,在植物体内是信号传递的重要载体(Bayer et al.,2012),它们通过催化功能蛋白的磷酸化,导致其构象发生改变,从而调节植物的生长、发育、自交不亲和、雄性不育、抗逆和抗病等多种生理过程。
1 蛋白激酶的分类
对于激酶的分类,有不同的方法,其中一种以其底物蛋白被磷酸化的不同位点分为5类:(1)丝/苏氨酸(Ser/Thr)蛋白激酶;(2)酪氨酸(Tyr)蛋白激酶;(3)组氨酸(His)蛋白激酶;(4)色氨酸(Try)蛋白激酶;(5)天冬氨酰基/谷氨酰基(Asp/Glu)蛋白激酶。目前植物中发现的蛋白激酶以前3类为主。而根据催化区氨基酸序列的相似性,又可将其分为五大组:AGC组、CaMK 组、CMGC 组、PTK 组和其它组,如下表(Bayer et al.,2012)。
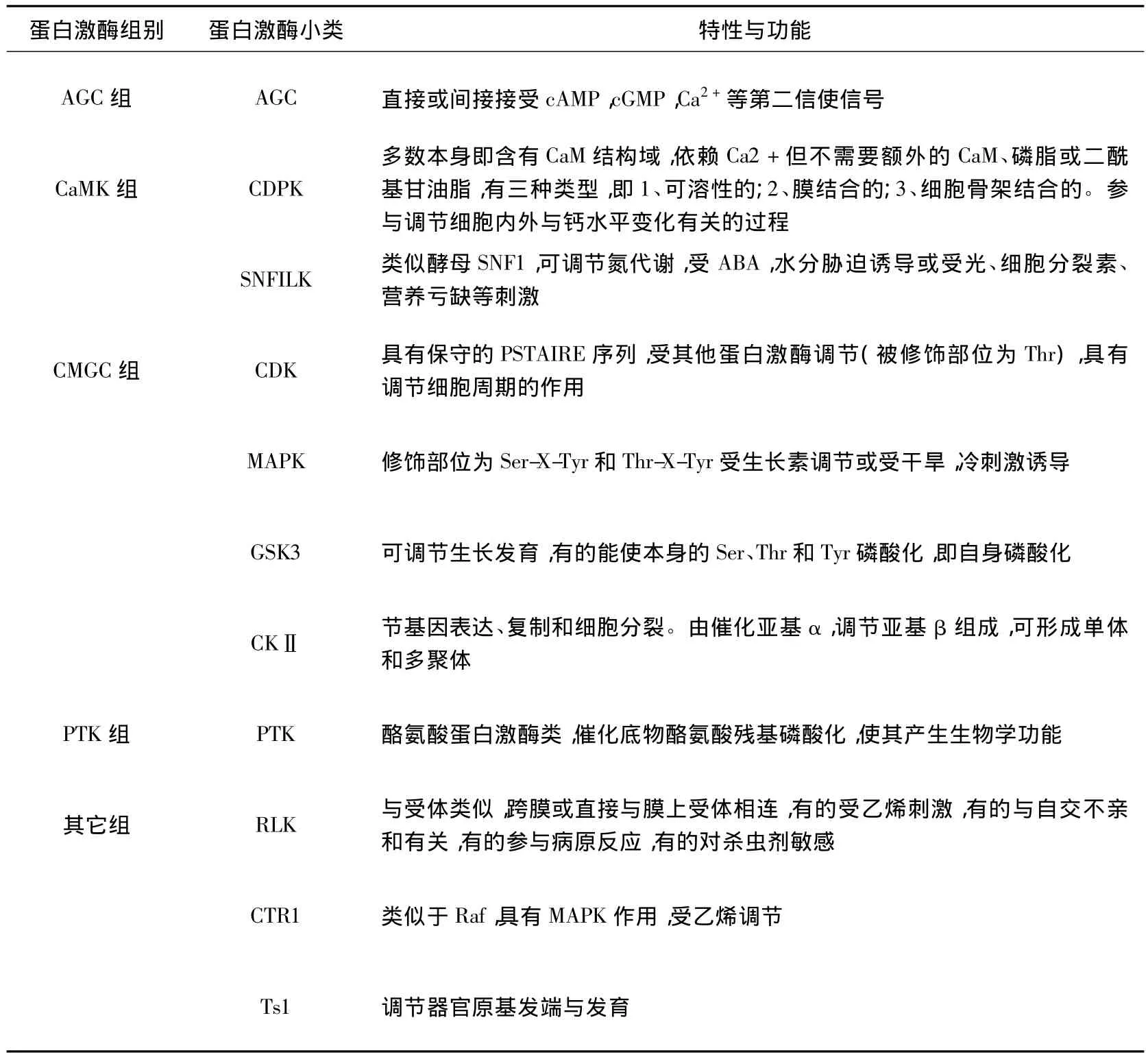
表1 植物中蛋白激酶的分类Table 1 Classification of protein kinases in plant
2 蛋白激酶的结构
迄今为止发现的所有蛋白激酶,虽然其种类不同,作用方式和功能千差万别,其作用底物也多种多样,然而在它们的催化区域都具有相似的氨基酸序列。通过对蛋白激酶氨基酸序列的保守性分析发现,催化功能域由大约250-300个氨基酸残基构成,包括12个亚区(Xu et al.,2011)。不同类型蛋白激酶的区别主要集中在Ⅵ、Ⅷ、Ⅸ亚域,例如:第Ⅵ区丝氨酸/苏氨酸蛋白激酶的保守序列为:Asp-Leu-Lys-Pro-Glu-Asn,而酪氨酸蛋白激酶的保守序列则为:Asp-Leu-Arg-Ala-Asn或Asp-Leu-Ala-Ala-Arg-Asn。如果找到同一家族特有编码基因的保守序列,就可以设计探针在cDNA或基因组文库中筛选其他家族成员;也可以目标蛋白激酶编码基因的保守序列,设计PCR引物,获取其同源基因(巩学千和陈受宜,1996)。
蛋白激酶对于底物蛋白中丝氨酸(Ser)、苏氨酸(Thr)等氨基酸残基的磷酸化是有选择性的,往往只使特定部位的残基磷酸化,这种选择性取决于蛋白激酶可以识别的一个保守序列,蛋白激酶对靶位点的识别是由其附近的蛋白质一级结构所决定。远距离的氨基酸及蛋白质的高级结构在此过程中的作用微乎其微,对于一种蛋白质,它所包含的磷酸化位点可能不止一个,它的作用可能在于不同位点发生磷酸化,使蛋白质产生不同的结构,而每种结构则对应于一种功能,从而使其功能更具多样化。另外,有些蛋白质的磷酸化往往是多个激酶协同作用的结果。
3 植物渗透胁迫响应相关蛋白激酶
植物在生长发育过程中经常受到低温、干旱等不良环境的胁迫。植物能够快速的感知和主动防卫环境的变化,这一过程涉及到植物对胁迫信号的识别与传导。大量的研究表明,蛋白激酶在植物信号识别与转导过程中起着至关重要的作用(图1)。与植物渗透胁迫信号传递关系最密切的主要有分裂原激活蛋白激酶(mitogen-activated protein kinase,MAPK)、钙依赖而钙调素不依赖的蛋白激酶(calcium-dependent and calmodulin-independent protein kinase,CDPK)、受体蛋白激酶(receptor protein kinase,RPK)、核糖体蛋白激酶(ribosomal-protein kinase)、转录调控蛋白激酶(transcription-regulation protein kinase)。

图1 蛋白激酶参与的胁迫信号传导通路Figure 1 Protein kinases as important key spot in stress signaling pathway
3.1 MAPK
3.1.1 植物MAPK级联信号转导系统 植物MAPK激酶级联信号通路的研究在近几年发展很快(Menke et al.,2004),现已在植物中发现了大量MAPK家族成员,而且在植物中识别出的MAPK数量比在动物和酵母中还多,不少编码MAPK和一些编码MAPKK与MAPKKK的基因也已从植物中分离到。MAPK是一类丝/氨酸蛋白激酶。广泛存在于真核生物中。与一些其他的信号分子组成MAPK级联途经。MAPK级联途径由三类激酶组成并通过依次磷酸化将逆境信号传递下去。即MAPKKK-MAPKK-MAPK,当MAPK被磷酸化后有3种可能的去向:(1)停留在细胞质中,激活一系列其他蛋白激酶;(2)在细胞质中使细胞骨架成分磷酸化;(3)进入细胞核,通过磷酸化转录因子,调控基因的表达。目前,在拟南芥中已经分离鉴定出几条MAPK信号传导通路(Cargnello and Roux,2011)。另外水稻等植物中MAPKKK、MAPKK或MAPK基因也已经被分离并验证。这就为今后研究植物中的信号传导机制打下了有力基础。
3.1.2 植物MAPK的特点 植物MAPK与动物和酵母细胞中MAPK有相似的生化特点,多数是从胞质组分中分离到的,其分子量一般在44,000-48,000 Da之间,具有11个保守的蛋白激酶亚区。同动物和酵母一样,MBP(脊髓碱性蛋白)也是植物MAPK的最适底物,这是MAPK的共有特征之一(Mizoguchi et al.,1997)。在其Ⅶ和Ⅷ亚区之间也存在一个催化区域。其中保守的TxY基序在此起关键作用。TxY基序在三维结构上定义“T环结构(T 1oop)”,T环是一个接近活化位点的表面环状结构。它被认为是决定MAPK激酶活性的关键结构,在调节蛋白激酶活化状态中起着非常重要的作用。与动物和酵母的不同之处在于:植物TxY中的X常为E或D,而动物和酵母中常为E、P或G,因此TDY基序为植物所特有。除了X氨基酸不同之外,不同植物MAPK在T环长度上也不同。TxY基序中x氨基酸的和T环氨基酸长度可以影响植物MAPK的底物特异性。并且T环长度在控制自主磷酸化上起关键性的作用。
3.1.3 植物MAPK与渗透胁迫 植物中已发现的多种MAPK除参与激素等的信号传递外,在胁迫信号传递尤其是渗透胁迫信号传递过程中也起着极其重要的作用。例如,拟南芥受到冷、水分胁迫的刺激会诱导出MAPK活性(Bögre et al.,1996),苜蓿叶片对干旱和冷处理的反应也涉及MAPK的激活(Jonak et al.,1996)。目前已从拟南芥中分离到两个能被干旱、高盐和低温诱导的MAPK基因,一个是ATMPK3(编码MAPK激酶),另一个是ATMEKK1(编码MAPKKK激酶)。对它们的研究表明,MAPK级联系统不仅在蛋白质水平上受到磷酸化和去磷酸化的调控,在转录水平也受到环境胁迫信号的诱导调控。在干旱、高盐和低温胁迫条件下,5 min内ATMPK3和ATMEKK1就被诱导表达,1 h内显著增加,随后表达持续增加,24 h后达到峰值(Mizoguchi et al.,1997)。ATMPK3基因启动子克隆分析表明,TATA盒上游-10--6碱基处有一个与干旱、高盐和低温有关的DRE(dehydration responsive element)顺式作用元件的核心序列(CCGAC)(Liu et al.,1998)。除了传导渗透胁迫信号,一些MAPK也能感应渗透胁迫信号,正常情况下细胞壁和细胞质膜相接触,质壁之间存在着相互作用。由于质壁的物理性质不同,细胞失水质膜收缩时质壁必然相互“撕扯”,这种“撕扯”实际是一种机械作用,而机械作用能被“机械感应器”识别。Bögre等证实这种“机械感应器”是一种MAPK,它在机械刺激后1 min就能被激活(Bögre et al.,1996)。
3.2 CDPK
3.2.1 植物中CDPK的功能与特点 Ca2+是植物中广泛存在的第二信使,它在植物生长发育中都起到了重要作用。Ca2+所传递的信号可以被细胞内多种Ca2+感受器接受,并将之转变成多种生物学反应(Saijo et al.,2002)。其中很重要的就是CDPK。CDPK是在豌豆中首先被报道的,并在大豆中首次得到了纯化。
CDPK是一种在植物中广泛存在的单链肽,它们在结构上具有明显的特征,从N端到C端存在4个功能区:可变区、催化区、连接区和调控区。不同种类CDPK之间在可变区的差别较大,其他功能区则保守性较强。催化区由300多个氨基酸组成,具有典型的Ser/Thr蛋白激酶的催化保守序列。催化区的同源性较高,一般都在80%以上(Zhao et al.,2011)。连接区在各功能区中最为保守。是由20-30个氨基酸组成的,富含碱性氨基酸,它能以拟底物方式与催化区结合,在没有Ca2+存在的情况下抑制催化区活性,故该区域又被称为自抑制区(Hashimoto et al.,2012)。调控区即Ca2+结合区,为CDPK特有结构域,其保守性较差,其上有一段结构和功能类似于CaM的氨基酸序列,共有4个与Ca2+结合的EF手型结构,这是CDPK不依赖于CaM而对Ca2+高度亲和的原因。
细胞内第二信使Ca2+的分布是严格区隔化的,正常情况下胞质中Ca2+浓度较低。当细胞受到刺激信号时,胞质中的Ca2+浓度发生短暂而复杂的变化,当Ca2+浓度达到一定浓度时便能和CDPK的调控区结合,解除连接区的自抑制作用使CDPK产生激酶活性,从而将信号级联向下游传递。
3.2.2 CDPK与渗透胁迫 大量研究表明,很多植物中的CDPK与植物的胁迫反应有着密切关系。Sheen利用报告基因和效应基因共表达的方法,发现在玉米原生质体中CDPK1和CDPK1a能激活可被干旱和高盐胁迫诱导的启动子,去除CDPKl激酶区的突变体对胁迫和ABA刺激没有反应(Sheen,1996)。此后一些学者从玉米、水稻、拟南芥等植物中发现了很多与渗透胁迫反应相关的 CDPK 基因(Urao et al.,1994;Saijo et al.,2000,2002;Sharma and Komatsu,2002)。其中,Saijo等报道来源于水稻的一种CDPK能被低温、干旱和盐胁迫激活,同时干旱和盐胁迫能够增强CDPK基因的表达,低温则没有这种效果,这说明在胁迫信号传递途径中,干旱和盐胁迫可能共用同一个类型的CDPK,而低温胁迫信号传递用的是另一种类型(Saijo et al.,2000)。这些例子都说明,CDPK在渗透胁信号传导过程中起着正调节因子的作用,能促进植物相关胁迫应答基因的表达。
3.3 其他激酶
3.3.1 CBK 人们首先是在苹果中发现了CBK(Watillon et al.,1995),之后又在玉米、水稻、拟南芥中发现了多种 CBK(Wang et al.,2001;Zhang et al.,2002;Wang et al.,2004;Asano et al.,2011)。CBK的结构一般包括N端和C端可变区,中间还包括CaM结合区和催化区。CaM先与Ca2+结合再与CBK结合才能激活CBK的激酶活性,使信号向下传递。多种钙调素结合蛋白激酶参与了植物对胁迫的反应(Yang and Poovaiah,2003;Giammaria et al.,2011)。另外,人们还在拟南芥、苜蓿和大豆中发现了钙调素结合类受体胞质激酶(calmodulin-binding receptor-like cytoplasmic kinase,CRCK)(Yang et al.,2010),它的催化结构域类似于丝/苏氨酸受体类激酶,不同的是它没有跨膜和胞外结构域。CRCK与植物的抗胁迫反应有着密切联系。
3.3.2 RPK 受体蛋白激酶位于细胞膜上,能够感受外界刺激,并参与胞内信号转导过程。它由胞外配体结合区(extracellular ligand-binding domain)、跨膜区(transmembrane domain)和胞质激酶区(cytosolic kinase domain)3个结构域组成。胞外配体结合区的功能是识别并结合配体感受外界信号,跨膜区则将被胞外配体识别的信号传递给胞质激酶区,而胞质激酶区能够通过磷酸化作用将信号传递给下一级信号传递体。目前已在多种高等植物中分离出一系列受体蛋白激酶基因(Li and Chory,1997;Singla et al.,2008;Tanaka et al.,2012),并分析了它们的基因特征和表达特性。例如从拟南芥植株分离到一种类似受体的蛋白激酶基因RPK1,该基因编码的氨基酸序列包含蛋白激酶中的11个保守亚区,属丝氨酸/苏氨酸蛋白激酶类型,具备胞外受体结构域、跨膜区和胞质激酶区等全部受体蛋白激酶的特征区。此外RPKl激酶的胞外区含有富亮氨酸重复序列(leucine-rich repeat sequence,LRR),该序列参与蛋白质-蛋白质间的相互作用,与感受发育和环境胁迫信号有关。表达特性分析表明,RPK1在植物的根、茎、叶和花中都能够表达,干旱或高盐(250 mmol/L NaCl)胁迫下,l h内RPK1的表达显著增强,6 h后达到峰值,并至少在此后的18 h内保持稳定的高表达。Yang等从野生大豆中分离的受体类蛋白激酶GsAPK与ABA的信号通路相关,并且其激酶的酶活受ABA的特异诱导(Yang et al.,2012)。
3.3.3 转录调控蛋白激酶与核糖体蛋白激酶 Lee等(1999)在拟南芥的果实中分离出一个新的激酶类蛋白,其氨基酸序列与酵母的dbf 2基因产物不但有很高的同源性,而且通过酵母突变株的研究发现该基因能与酵母dbf2功能互补。故将之命名为At-DBF2,序列分析表明At-DBF2激酶属于丝氨酸/苏氨酸蛋白激酶类,包含有11个蛋白激酶的保守亚区。在酵母中,DBF2激酶是CCR4转录复合体的重要组分,它参与很多重要基因的转录,并且能影响许多转录因子的活性,所以推断在拟南芥中它也是一种转录调控功能的蛋白激酶,位于信号传递的下游。高盐、低温及脱水均能很快诱导At-dbf2基因的表达,将该基因转化酵母,At-dbf2超量表达的酵母DY株系抗高盐、低温及脱水能力均比对照有所提高。同时,分别将At-dbf2及其反义RNA序列转入烟草BY2细胞系,使它们在烟草细胞中过量表达,经高盐、干旱、低温或高温处理2周后发现,稳定表达At-dbf2基因的烟草细胞系抗胁迫能力明显强于转入反义RNA 的细胞系(Liu et al.,1997)。
Mizoguchi等(1995)在拟南芥中分离了2个基因ATPK6和ATPK19,这2个基因在序列上与动物的S6核糖体蛋白激酶有很高的同源性,在动物细胞中这类蛋白能够通过磷酸化40S核糖体蛋白S6而激活蛋白质的合成。研究表明,ATPK6和ATPK19均能被干旱、低温和高盐诱导,由于S6激酶参与蛋白质的合成,所以ATPK6和ATPK19可能通过增加某些特定蛋白的合成使植物对外界胁迫作出反应。
4 问题与展望
同动物中蛋白激酶的研究相比,植物蛋白激酶的研究起步较晚,很多蛋白激酶还没有被发现。大部分已克隆的蛋白激酶基因的功能也还没有得到深入细致的研究,因而许多问题还不清楚,有些功能注释只是参考动物中同源基因的功能注释,然而,植物细胞中可能既存在类似于动物细胞的一些信号转导因子及机制,同时又存在植物细胞特有的信号转导因子及调节机制。参与环境胁迫信号的传递是蛋白激酶的重要功能之一。目前有关植物调控逆境胁迫和生长发育的研究重点逐渐从功能基因转到蛋白激酶等调控基因的鉴定、功能分析及其调控机理等方面。但是植物的抗逆信号转导途径是一个相当复杂的过程,这一过程需要很多的受体蛋白、激酶、转录因子的协同作用,这就需要研究者们不仅仅克隆一些重要的蛋白激酶基因,更要从植物抗逆反应的整体全局来考虑,找到信号转导途径中每个关键的组分,为进一步阐明植物的生长发育和抗性机理奠定分子和生化基础。
巩学千,陈受宜.1996.蛋白激酶:一个飞速发展的领域.生物工程进展,16(1):11-15.
Asano T,Hakata M,Nakamura H,Aoki N,Komatsu S,Ichikawa H,Hirochika H,Ohsugi R.2011.Functional characterisation of OsCPK21,a calcium-dependent protein kinase that confers salt tolerance in rice.Plant Molecular Biology,75(1-2):179-191.
Bayer RG,Stael S,Rocha AG,Mair A,Vothknecht UC,Teige M.2012.Chloroplast-localized protein kinases:a step forward towards a complete inventory.Journal of Experimental Botany,63(4):1713-1723.
Bögre L,Ligterink W,Heberle-Bors E,Hirt H.1996.Mechanosensors in plants.Nature,383(6600):489-490.
Cargnello M,Roux PP.2011.Activation and function of the MAPKs and their substrates,the MAPK-activated protein kinases.Microbiology and Molecular Biology Reviews,75(1):50-83.
Ferreira PC,Hemerly AS,Villarroel R,Van MM,Inzé D.1991.The Arabidopsis functional homolog of the p34cdc2 protein kinase.Plant Cell,3(5):531-540.
Giammaria V,Grandellis C,Bachmann S,Gargantini PR,Feingold SE,Bryan G,Ulloa RM.2011.StCDPK2 expression and activity reveal a highly responsive potato calcium-dependent protein kinase involved in light signalling.Planta,233(3):593-609.
Hashimoto K,Eckert C,Anschütz U,Scholz M,Held K,Waadt R,Reyer A,Hippler M,Becker D,Kudla J.2012.Phosphorylation of calcineurin B-like(CBL)calcium sensor proteins by their CBL-interacting protein kinases(CIPKs)is required for full activity of CBL-CIPK complexes toward their target proteins.Journal of Biological Chemistry,287(11):7956-7968.
Jonak C,Kiegerl S,Ligterink W,Barker PJ,Huskisson NS,Hirt H.1996.Stress signaling in plants:a mitogen-activated protein kinase pathway is activated by cold and drought.Proceedings of the National Academy of Sciences of the United States of America,93(20):11274-11279.
Lee JH,Van Montagu M,Verbruggen N.1999.A highly conserved kinase is an essential component for stress tolerance in yeast and plant cells.Proceedings of the National Academy of Sciences of the United States of America,96(10):5873-5877.
Li J,Chory J.1997.A putative leucine-rich repeat receptor kinase involved in brassinosteroid signal transduction.Cell,90(5):929-938.
Liu HY,Toyn JH,Chiang YC,Draper MP,Johnston LH,Denis CL.1997.DBF2,a cell cycle-regulated protein kinase,is physically and functionally associated with the CCR4 transcriptional regulatory complex.EMBO Journal,16(17):5289-5298.
Liu Q,Kasuga M,Sakuma Y,Abe H,Miura S,Yamaguchi-Shinozaki K,Shinozaki K.1998.Two transcription factors,DREB1 and DREB2,with an EREBP/AP2 DNA binding domain separate two cellular signal transduction pathways in drought-and low-temperature-responsive gene expression,respectively,in Arabidopsis.Plant Cell,10(8):1391-1406.
Menke FL,van Pelt JA,Pieterse CM,Klessig DF.2004.Silencing of the mitogen-activated protein kinase MPK6 compromises disease resistance in Arabidopsis.Plant Cell,16(4):897-907.
Mizoguchi T,Hayashida N,Yamaguchi-Shinozaki K,Kamada H,Shinozaki K.1995.Two genes that encode ribosomalprotein S6 kinase homologs are induced by cold or salinity stress in Arabidopsis thaliana.FEBS Letters,358(2):199-204.
Mizoguchi T,Ichimura K,Shinozaki K.1997.Environmental stress response in plants:the role of mitogen-activated protein kinases.Trends in Biotechnology,15(1):15-19.
Saijo Y,Kinoshita N,Ishiyama K,Hata S,Kyozuka J,Hayakawa T,Nakamura T,Sanders D,Pelloux J,Brownlee C,Harper JF.2002.Calcium at the crossroads of signaling.Plant Cell,14Suppl:S401-S417.
Saijo Y,Hata S,Kyozuka J,Shimamoto K,Izui K.2000.Over-expression of a single Ca2+-dependent protein kinase confers both cold and salt/drought tolerance on rice plants.Plant Journal,23(3):319-327.
Sharma A,Komatsu S.2002.Involvement of a Ca2+-dependent protein kinase component downstream to the gibberellin-binding phosphoprotein,RuBisCO activase,in rice.Biochemistry Biophysics and Reserach Communications,290(2):690-695.
Sheen J.1996.Ca2+-dependent protein kinases and stress signal transduction in plants.Science,274(5294):1900-1902.
Singla B,Khurana JP,Khurana P.2008.Characterization of three somatic embryogenesis receptor kinase genes from wheat,Triticum aestivum.Plant Cell Report,27(5):833-843.
Tanaka H,Osakabe Y,Katsura S,Mizuno S,Maruyama K,Kusakabe K,Mizoi J,Shinozaki K,Yamaguchi-Shinozaki K.2012.Abiotic stress-inducible receptor-like kinases negatively control ABA signaling in Arabidopsis.Plant Journal,70(4):599-613.
Urao T,Katagiri T,Mizoguchi T,Yamaguchi-Shinozaki K,Hayashida N,Shinozaki K.1994.Two genes that encode Ca2+-dependent protein kinases are induced by drought and high-salt stresses in Arabidopsis thaliana.Molecular and General Genetics,244(4):331-340.
Wang L,Liang S,Lu YT.2001.Characterization,physical location and expression of the genes encoding calcium/calmodulin-dependent protein kinases in maize(Zea mays L.).Planta,213(4):556-564.
Wang Y,Liang S,Xie QG,Lu YT.2004.Characterization of a calmodulin-regulated Ca2+-dependent-protein-kinase-related protein kinase,AtCRK1,from Arabidopsis.Biochemical Journal,383(Pt1):73-81.
Watillon B,Kettmann R,Boxus P,Burny A.1995.Structure of a calmodulin-binding protein kinase gene from apple.Plant Physiology,108(2):847-848.
Xu F,Meng T,Li P,Yu Y,Cui Y,Wang Y,Gong Q,Wang NN.2011.A soybean dual-specificity kinase,GmSARK,and its Arabidopsis homolog,AtSARK,regulate leaf senescence through synergistic actions of auxin and ethylene.Plant Physiology,157(4):2131-2153.
Yang T,Poovaiah BW.2003.Calcium/calmodulin-mediated signal network in plants.Trends in Plant Science,8(10):505-512.
Yang L,Ji W,Zhu YM,Gao P,Li Y,Cai H,Bai X,Guo DJ.2010.GsCBRLK,a calcium/calmodulin-binding receptorlike kinase,is a positive regulator of plant tolerance to salt and ABA stress.Journal of Experimental Botany,61(9):2519-2533.
Yang L,Ji W,Gao P,Li Y,Cai H,Bai X,Chen Q,Zhu YM.2012.GsAPK an ABA-activated and calcium-independent SnRK2-type kinase from G.soja mediates the regulation of plant tolerance to salinity and ABA stress.PLoS ONE,7(3):e33838.doi:10.1371/journal.pone.0033838.
Zhang L,Liu BF,Liang S,Jones RL,Lu YT.2002.Molecular and biochemical characterization of a calcium/calmodulin-binding protein kinase from rice.Biochemical Journal,368(Pt1):145-157.
Zhao R,Wang XF,Zhang DP.2011.CPK12:A Ca2+-dependent protein kinase balancer in abscisic acid signaling.Plant Signal And Behavior,6(11):1687-1690.
