3种疾病肾阳虚证“同证异治”的信号通路调控研究*
2012-12-01严石林沈宏春王浩中鲁法庭于宏波
严石林,沈宏春,2,王浩中,鲁法庭,于宏波,陈 为,陶 怡
(1.成都中医药大学,四川成都 610075;2.泸州医学院,四川泸州 646000;3.云南中医学院,云南昆明 650500)
1 资料与方法
1.1 资料来源
病例资料来源于成都中医药大学附属医院、泸州医学院附属中医院。从2009年3月至2010年7月期间符合诊断标准及纳入标准者,共收集慢性肾炎、糖尿病肾病、阳痿病3个病种典型肾阳虚证患者9例,分别抽取血样标本。
1.2 实验方法
抽取实验者空腹静脉血10mL,裂解红细胞,分离获得白细胞,Trizol法提取总RNA。将总RNA进行IVT体外扩增,采用cy-3标记扩增后的cDNA,单标法与agilent4*44k人类全表达谱芯片进行杂交,洗脱、干燥、数据提取、归一化处理。
1.2.1 分组
共分为4组,分别为慢性肾炎、糖尿病肾病、阳痿病3个实验组共9例,健康对照组共3例。
2 数据统计分析方法
使用SAM软件进行统计分析。
3 实验结果
3.1 差异表达基因筛选
数据全部录入SAS系统,数据采用DiffGene方法,分别将慢性肾炎肾阳虚组与正常组比较得到1435条差异表达基因,将糖尿病肾病肾阳虚组与正常组比较得到2306条差异表达基因,将阳痿肾阳虚组与正常组比较得到2060条差异表达基因。为了找到3种不同疾病肾阳虚组在肾阳虚证方面的共同生物学特征,我们把3组数据录入EXCEL工作表,采用高级筛选功能进行两两筛选,最后找出332条共同差异表达基因,其中有注释的基因为181条。
采用Pathway分析,发现3组间差异表达显著的信号通路有37条。分别是肾细胞癌,氨酰-tRNA生物合成,Notch信号通路,缬氨酸、亮氨酸、异亮氨酸的生物合成,在癌细胞中协调促进启动转录的核染质重塑的复合物与共激动剂的活性,Pitx2基因转录的多步校正,MEF2D在T细胞凋亡的作用,胰岛素信号通路,神经营养蛋白信号通路,丙酮酸代谢,赖氨酸降解,阻止肉毒菌毒素引起的神经递质释放,非小细胞肺癌,前列腺癌,ps1簇淀粉样的b-缩氨酸,mTOR(哺乳动物雷帕霉素靶蛋白)信号通路,半胱氨酸和蛋氨酸代谢,丙酸代谢,肿瘤通路,基本转录因子,代谢途径,心血管系统中低氧可诱导因子,TGF-β信号通路,Wnt信号通路,g-分泌素介导的ErbB4信号通路,阿尔茨海默病,PPAR信号通路,黑色素细胞及色素沉着通路,Pelp1雌激素受体活性调节,精子生成的肌酸酐调控,新型冠状病毒的生命周期,磷脂酰肌醇信号系统,DREAM转录调控镇痛,PPAR-gamma复合激动剂在肥胖和产热过程中的作用,SODD/TNFR1信号通路,CARM1甲基转移酶基因转录调控,甘油磷酸酯代谢。
3.2 每组样本特有的差异表达基因结果
通过筛选功能,我们还得到每组样本所特有的差异表达基因。从这些差异表达基因中,找寻出同为肾阳虚证这一生物学意义下的不同点。数据处理示意图见图1。
图1 数据筛选示意图
3组病例都包含肾阳虚证,经统计处理后找出了肾阳虚证的共同差异表达基因。但是,3组样本来至不同疾病,所以存在不同的生物学意义。通过对各病所特有的基因进行分析后,除发现大部分基因与本身的疾病有关外,却又惊奇发现有一小部分基因参与了共同差异表达基因里面的3条信号通路,具体结果如下:
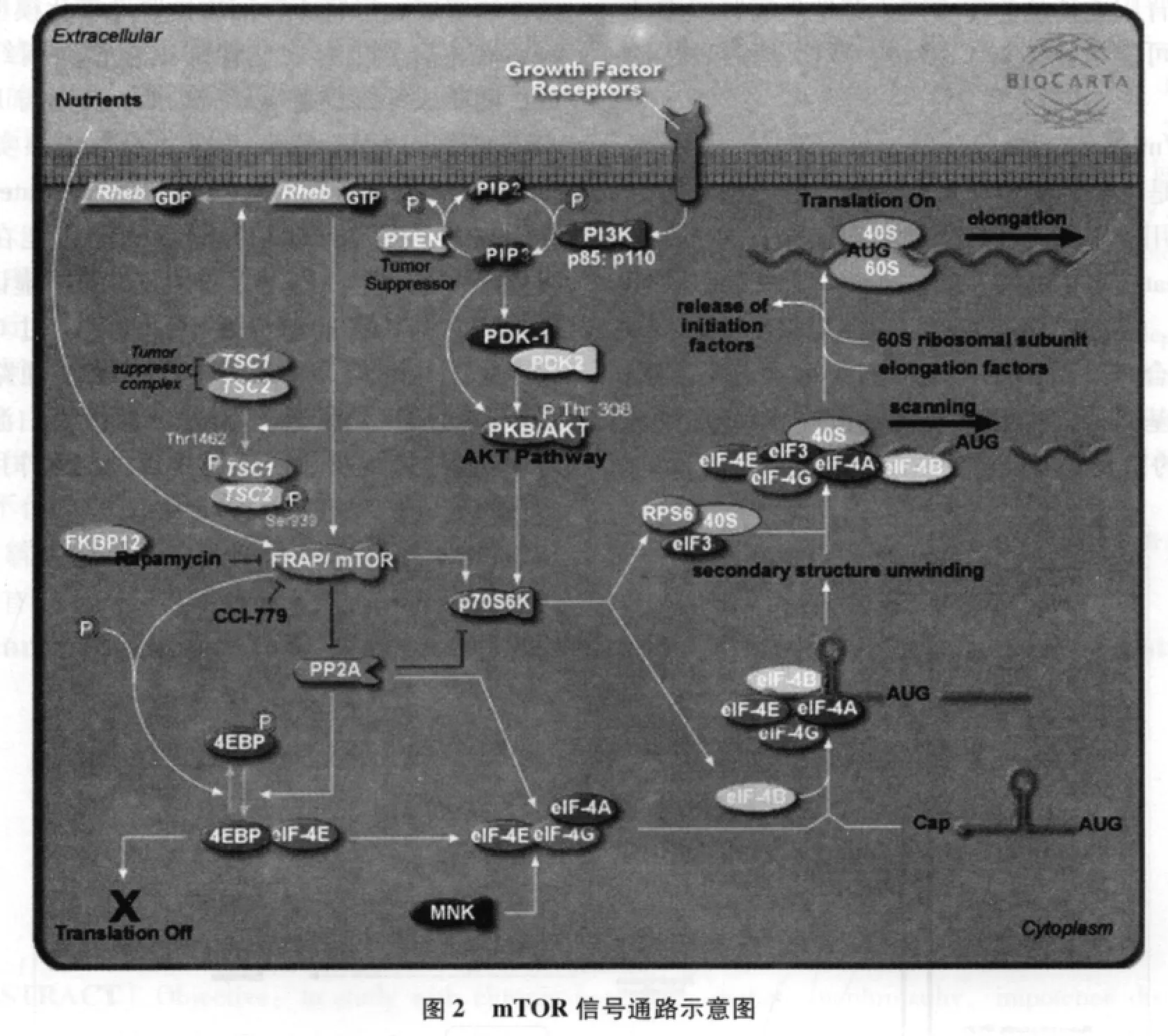
3.2.1 mTOR(哺乳动物雷帕霉素靶蛋白)信号通路
是一种非典型丝氨酸/苏氨酸蛋白激酶,可整合细胞外信号,磷酸化下游靶蛋白核糖体p70S6激酶,如S6K1及4E-BP1,影响基因转录与蛋白质翻译,从而参与调控细胞生长、增殖等过程。该通路与糖尿病肾病的发生密切相关,研究发现TSC-mTOR通路之一,即PI3K-Akt-TSCI/2-mTOR信号通路可能参与系膜肥大增殖。如PI3K-Akt-TSCI/2-mTOR在生长停滞特异性基因6(Growtharrest.specificgene6)诱导系膜和肾小球肥大过程中起重要作用,雷帕霉素可阻断PI3K-Akt-TSCI/2-mTOR通路活化和系膜肥大[1]。Komers等报告,PI3K-Akt-TSCI/2-mTOR路还可通过调节mTOR主要的下游分子p70S6K和elF-4E的表达,引起DN的肾脏肥大[2]。我们的实验结果表明,在3组肾阳虚的共同特征是PDK1调控PI3KAkt-TSCI/2-mTOR通路,通过PP2A调控磷酸化下游靶蛋白核糖体p70S6激酶,如S6K1及4EBP1。糖尿病肾病组在该通路中还存在差异基因FKBP12,直接通过雷帕霉素调控mTOR信号通路(见图2)。也就是说在糖尿病肾病肾阳虚证在mTOR信号通路上与健康组有3个位点存在差异表达,而在3组肾阳虚证共有的特征中仅有2个位点有差异,这就决定了在治疗上有所不同。
3.2.2 Notch信号通路
广泛存在于多种动物体内,在进化过程中高度保守,主要介导细胞的分化抑制信号,在胚胎发育、血细胞发育、肿瘤形成等生理病理过程中起重要作用。
3组病例在notch信号通路中共同的差异表达基因有:MAML1(mastermind-like1)、EP300(E1Abindingproteinp300),见图3。
MAML1:有证据表明人类在体外homolog形成一个复杂的人类细胞内的部分缺口受体和可以增加表达Notch-induced基因。此证据支持这个提议的功能相当于一个co-activator切口转录在信号传导途径。有证据表明它是该通路的一个催化剂。
EP300(E1Abindingproteinp300)它的功能是通过组蛋白乙酰转移酶调节转录核染质的再塑造和重要过程中细胞的增生和分化。可以调节cAMP-gene结合具体的调节蛋白磷酸化CREB。这个基因也被认定为缺氧因子1a的催化剂复合物,因此就在如血管内皮生长因子等缺氧诱导基因中扮演了一个重要角色。
上述表明,肾阳虚证在notch信号通路中通过在基因MAML1、EP300表达下调,降低了对细胞增殖和分化的催化作用,使与该通路相关的胚胎发育、血细胞发育降低,骨髓细胞生成减少。这种作用与中医描述的肾藏精、主骨生髓的生理功能非常相似。肾藏先天之精,靠后天滋养,人体的生长发育与之密切相关;肾主骨,骨生髓、髓能生血;当人体出现在肾阳虚的病理状态下时,就可能导致小儿生长发育迟缓,髓不能生血出现血液亏虚,肾的这一生物学机制可能与notch信号通路调控有关。

然而在阳痿肾阳虚组中我们发现在Notch通路中还存在CIR1(corepressor interacting with RBPJ1)和DVL3表达有差异,二者均是起负反馈作用。所以对阳痿肾阳虚证的治疗不同于其他疾病肾阳虚证的治疗,可能是在于对CIR1和DVL3基因表达的调节上。
3.2.3 Wnt信号通路
Wnt是一类分泌型糖蛋白,通过自分泌或旁分泌发挥作用。Wnt信号途径能引起胞内β-连锁蛋白 (β-catenin)积累。β-catenin是一种多功能的蛋白质,在细胞连接处它与钙黏素相互作用,参与形成黏合带。而游离的β-catenin可进入细胞核,调节基因表达。正常机体肾脏中Wnt信号是“沉默”的,胞质中仅有少量游离态的β-catenin,体内绝大多数β-catenin在胞膜处与E-cadherin形成复合体,对维持同型细胞的黏附、防止细胞的迁移发挥作用。Surendran等[3]利用单侧输尿管结扎方法造成大鼠肾小管间质性肾纤维化模型,发现wnt4在集合管中有表达伴随集合管周围纤维化形成,间质成纤维细胞wnt4高水平表达与I型胶原mRNA及a-sMA的高表达一致;体外实验表明Wnt4可以诱导培养的成纤维细胞β-catenin进入细胞核内。提示Wnt信号转导通路可能在肾脏纤维化中发挥着重要作用。慢性肾炎肾阳虚证组与肾阳虚证共同特征的差异在于,前者通过CAMK2G还参与了Wnt蛋白介导的Wnt5/Ca2+通路 (如图4)。CAMK2G是属于丝氨酸/苏氨酸蛋白激酶家族4种亚基之一,在Ca2+通路中发挥关键作用。
图4 Wnt信号通路示意图
4 讨论
本次研究通过基因筛选,发现慢性肾炎、糖尿病肾病、阳痿等3种疾病的肾阳虚证除各有不同的差异表达基因外,还有共同的差异表达基因332条,其中有注释的基因为181条。并通过转录组特征分析,发现与肾阳虚证相关的共同信号通路37个。说明不同疾病除具备各自特征的信号通路调控基因外,还具有共同的信号通路调控,为中医“异病同证”、“异病同治”的经典论述从分子生物学的角度找到理论依据。
本次研究从每组样本特有的差异表达基因中发现有mTOR、notch、Wnt等3条信号通路与肾阳虚证共有的信号通路一致,只是在通路的调控上有基因表达差异。
其中糖尿病肾病肾阳虚组在mTOR信号通路中存在差异基因FKBP12,直接通过雷帕霉素调控该信号通路;阳痿肾阳虚组中发现在Notch通路中存在CIR1(corepressor interacting with RBPJ1)和DVL3表达有差异;慢性肾炎肾阳虚组通过CAMK2G的差异表达调控Wnt信号通路。以上说明,3种不同疾病,同有肾阳虚证,虽然有共同的信号通路,即反应于外的大证相同,但因受不同疾病的影响,同一信号通路的调控基因有所差异,其细证的表现和病机也有所差异,这些表达差异基因有可能决定了治疗上的差异。这一研究结果,为我们提出“同证异治”的创新治法观点提供了分子生物学依据。由此可以认为,中医在辨证论治的时候,应高度重视疾病对证候的影响,必须“从病辨证”。不仅要严格遵循“异病同证”, “同证同治”的传统经典论述。还要重视疾病对证候的影响,参照“异病同证”,“同证异治”这一对传统治法的补充和完善的创新理念,才能提高辨证论治的水平。
[1] NagaiK,MatsubaraT,MimaA,eta1.Gas6 induces Akt/mTOR-mediated mesangial hypertrophy in diabetic nephropathy[J].KidneyInt,2005,68(2):552-561.
[2]HiroyukiM,InokiK,KohsukeM,eta1.The mTOR pathway is highly activated in diabetic nephropathy and rapamycin has a strong therapeutic potential[J].Bloc and Biop ResCom,2009,384(105):471-475.
[3] SurendranK,Schiavi,HruskaKA.Wnt- dependentbeta-catenin signaling is activated after unilateralureteral obstruction and recombinant secreted frizzledrelated protein4 alters the progression of renal fibrosis[J].JAmSocNephrol,2005,16(8):2373 -2384.
