锂离子电池正极材料xLi2MnO3·(1-x)Li[Ni1/3Mn1/3Co1/3]O2的制备及表征
2012-11-30苏岳锋包丽颖
王 昭 吴 锋 苏岳锋 包丽颖 陈 来 李 宁 陈 实
(北京理工大学化工与环境学院,国家高技术绿色材料发展中心,北京100081)
锂离子电池正极材料xLi2MnO3·(1-x)Li[Ni1/3Mn1/3Co1/3]O2的制备及表征
王 昭 吴 锋 苏岳锋*包丽颖 陈 来 李 宁 陈 实
(北京理工大学化工与环境学院,国家高技术绿色材料发展中心,北京100081)
以过渡金属乙酸盐和乙酸锂为原料,柠檬酸为螯合剂,通过溶胶-凝胶法结合高温煅烧法制备了锂离子电池富锂锰基正极材料xLi2MnO3·(1-x)Li[Ni1/3Mn1/3Co1/3]O2,采用X射线衍射(XRD),扫描电子显微镜(SEM)和电化学性能测试对所得样品的结构,形貌及电化学性能进行了表征.结果表明:x=0.5时,在900°C下煅烧12 h得到颗粒均匀细小的层状xLi2MnO3·(1-x)Li[Ni1/3Mn1/3Co1/3]O2材料,并具有良好的电化学性能,在室温下以20 mA·g-1的电流密度充放电,2.0-4.8 V电位范围内首次放电比容量高达260.0 mAh·g-1,循环40次后放电比容量为244.7 mAh·g-1,容量保持率为94.12%.
锂离子电池;溶胶-凝胶;固溶体;正极材料;电化学性能
1 引言
锂离子二次电池自商业化以来,已在便携式电子设备等许多领域得到广泛应用.当今社会汽车需求与环境保护的矛盾日益突出,汽车的电动化趋势日益明显,锂离子动力电池凭借其优异的电化学性能,将大量应用于电动汽车领域.现有的传统电极材料,1-5已经越来越不能满足市场对二次电池日益增长的高比能量和高比功率需求.目前,人们对新型锂离子电池正极材料的研究空前重视,其中,具有层状结构的镍钴锰三元材料(LiNi1-x-yMnxCoyO2),由于具有比容量高、循环性能好、合成制备工艺简单、安全稳定性能较好等特点,近几年得到快速发展.研究发现,在这类材料中添过量锂得到的富锂锰基正极材料,该材料可视为Li2MnO3和LiMO2(M= Ni,Co,Fe,Ni1/2Mn1/2,Ni1/3Mn1/3Co1/3,…)的固溶体,6-9具有更高的比容量(大于200 mAh·g-1),优秀的循环能力,良好的热稳定性,较宽的充放电电压范围以及价格低廉,对环境友好等优点,10-16其全新的充放电机制亦受到广泛关注,这类材料被认为是当前商业化LiCoO2很有前景的替代品.
Lu等17采用共沉淀法和固相法合成了Li[NixLi1/3-2x/3Mn2/3-x/3]O2材料,其放电容量稳定在230 mAh·g-1左右.Kim等12采用溶胶-凝胶法,制得富锂正极材料Li[Li0.1Ni0.35-x/2CoxMn0.55-x/2]O2.在倍率为0.2C, 2.5-4.6 V时放电容量维持在184-195 mAh·g-1间. Lee等15在200°C下水热合成Li0.88[Li0.18Co0.33Mn0.49]O2纳米线.在1C倍率下,经过50次循环之后的放电容量高达217 mAh·g-1,显示了良好的倍率性能.Kim等16也通过水热法得到了直径为30 nm的纳米线状Li[Ni0.25Li0.15Mn0.6]O2材料,在4C的高倍率,2.0-4.8 V充放电条件下,首次放电容量达到311 mAh·g-1.研究发现,12溶胶-凝胶法制备富锂锰基正极材料具有纯度高、合成温度低、合成时间短、粒径小、粒度分布窄、均一性好、比表面积大等诸多优点,但合成过程中的不同工艺条件和富锂锰基正极材料中不同组分构成对材料的物理化学性能有着极大的影响.
本文采用溶胶-凝胶法,以柠檬酸为螯合剂,通过控制不同的煅烧温度合成了三种不同组分构成的富锂三元正极材料xLi2MnO3·(1-x)Li[Ni1/3Mn1/3Co1/3]O2(x=0.4,0.5,0.6),并对其进行了物理和电化学性能表征.研究结果表明,本文制备的xLi2MnO3· (1-x)Li[Ni1/3Mn1/3Co1/3]O2(x=0.4,0.5,0.6)富锂正极材料的结构类似于LiCoO2,归属为R3m型空间群的α-NaFeO2型层状结构.当x=0.5时,900°C煅烧12 h的样品具有最高的比容量,高达260 mAh·g-1,同时具有良好的循环性能.
2 实验部分
2.1 样品的制备
采 用 CH3COOLi·2H2O(分 析 纯,99%), (CH3COO)2Ni·4H2O(分析纯,98%),(CH3COO)2Co· 4H2O(分析纯,99.5%),(CH3COO)2Mn·4H2O(分析纯,99%)(均为国药集团化学试剂有限公司产品)为初始原料,取计量比nLi:nNi:nCo:nMn=(1+x):(1-x)/3:(1+ 2x)/3:(1-x)/3混合溶于20 mL的去离子水中(锂盐过量5%,以弥补煅烧时锂的损失),再称取一定量的C6H8O7·H2O(分析纯,99.5%,北京化工厂)(C6H8O7· H2O与金属离子的摩尔比为1:1)溶于20 mL去离子水中.两者逐滴混合并不断搅拌,采用氨水调节pH值稳定在8-9之间,90-100°C下在磁力加热搅拌器上搅拌数小时,蒸发至溶液呈黑色凝胶状,将所得胶状物质置于烘箱中,真空120°C干燥12 h,得到前驱体.在450°C下煅烧5 h后,将粉末在研钵中研磨成细粉状后压片,压力大小为10 MPa,将获得的圆片置于马弗炉中,以5°C·min-1的升温速率在温度为700-1100°C下煅烧12 h,炉内自然冷却至室温,取出磨细得到最终产物xLi2MnO3·(1-x)Li[Ni1/3Mn1/3Co1/3]O2(x=0.4,0.5,0.6)(以下记为x/(1-x),即0.4/0.6,0.5/0.5,0.6/0.4).
2.2 结构和形貌的表征
材料的微观结构采用日本Rigaku公司生产的IV-185型旋转阳极衍射仪进行XRD分析,测试条件:Cu Kα辐射,40 kV管电压,40 mA管电流,扫描范围为10°-90°,扫描速率为8(°)·min-1.材料形貌采用荷兰FEI公司生产的QUANTA 6000扫描电镜放大5000和10000倍对合成目标产物的颗粒大小和表面形貌进行SEM分析.
2.3 电化学性能测试
将制备的材料与乙炔黑按一定比例混合均匀,加入5.0%(w)聚偏氟乙烯溶液(三者的物质的量比为80:10:10),以N-甲基-2-吡咯烷酮(NMP)为溶剂,再次混合均匀,涂在预处理过的光滑平整的铝箔上,80°C下真空干燥12 h,以8 MPa的压力压片,然后用裁片机将极片裁剪成直径为11 mm的电极极片,采用分析天平准确称重待用.纯金属锂片作对电极,Celgard 2300多孔复合聚合物膜为隔膜,1 mol·L-1LiPF6的EC、DMC(体积比1:1)的混合溶液作为电解液,在氩气手套箱内将材料组装成CR2025型扣式电池.电池组装完毕后,静置12 h,然后在室温下,采用武汉金诺公司生产的LAND电池测试系统进行恒电流充放电循环测试,充放电区间为2.0-4.8 V,充放电电流以1C=200 mA·g-1计算.
3 结果与讨论
3.1 煅烧温度对材料结构与电化学性能的影响
3.1.1 煅烧温度对材料结构的影响
电极材料的电化学性能与材料的结晶程度和粒径大小密切相关,合成温度对材料的结晶程度以及晶粒的团聚有很大的影响,从而影响材料的电化学性能.18因此,本文对不同温度下合成的0.5/0.5材料做了表征.
图1所示为不同煅烧温度下合成的0.5/0.5样品材料的XRD图.从图中可以看出,随着温度的升高,材料样品的衍射峰逐渐变窄变尖锐,当温度低于1000°C时,合成的样品具有典型的α-NaFeO2结构,属R3m空间群;温度为900°C时,具有最明显的
(006)/(012)和(018)/(110)分裂峰,表明该温度下合成的材料具有最好的晶体层状结构;19当温度升高至1000°C时,材料在2θ=42°,62°附近产生了杂质峰,温度继续升高到1100°C,出现更多的杂峰,杂质峰强度变大更明显,通过与标准谱比对,发现杂质峰与Li2MnO3(JCPDS Card No.27-1252)相吻合,这说明,组分Li2MnO3与组分Li[Ni1/3Mn1/3Co1/3]O2没有均匀分散溶合在一起,没有形成良好的固溶体,对材料的电化学性能将产生直接影响.综上所述,过高的温度不利于晶体结构的形成.
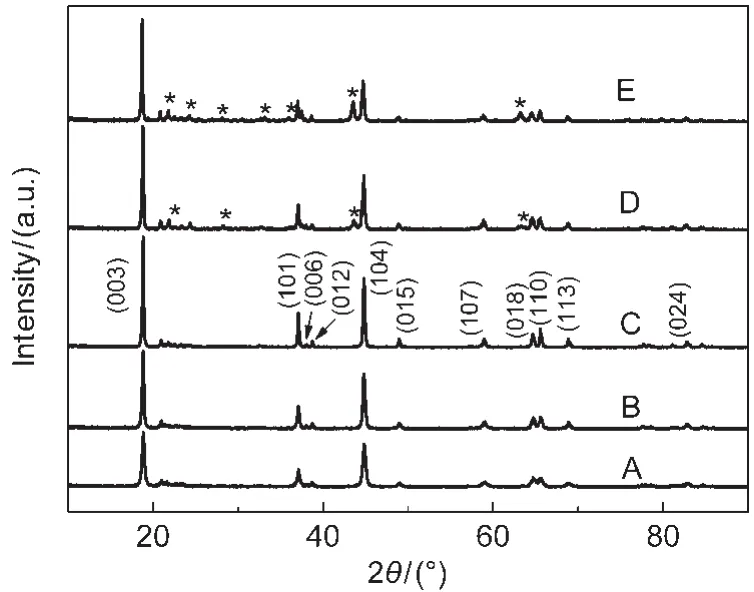
图1 不同煅烧温度下得到0.5/0.5样品的XRD图谱Fig.1 XRD patterns of 0.5/0.5 samples synthesized at different temperaturesT/°C:(A)700;(B)800;(C)900;(D)1000;(E)1100;x/(1-x)=0.5/0.5, that represents xLi2MnO3·(1-x)Li[Ni1/3Mn1/3Co1.3]O2(x=0.5).
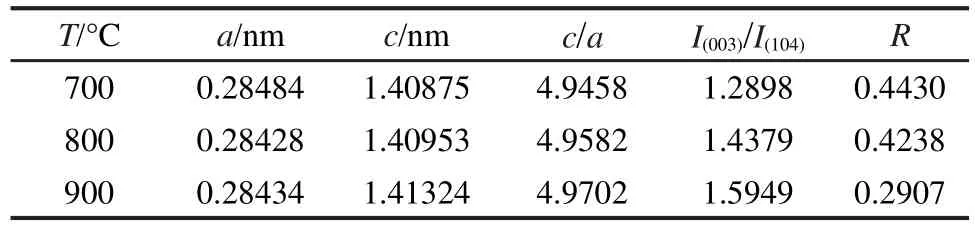
表1 不同煅烧温度下得到0.5/0.5样品的晶格参数及特征峰强度比Table 1 Lattice parameters and ratio of characteristic peak intensities of 0.5/0.5 samples synthesized at different temperatures
表1所示为不同煅烧温度下合成的0.5/0.5样品材料的的晶胞参数及特征峰强度比.随着温度的升高,样品c/a值和I(003)/I(104)值逐渐升高(当温度高于900°C时,材料产生了明显的杂质峰,没能形成良好的固溶体,没有对其晶胞参数和特征峰强度比进行计算),在700、800和900°C下煅烧合成的样品的c/ a值均大于4.899,I(003)/I(104)的值均大于1.2,说明材料的层状结构较好,阳离子混排程度较低.20-22当煅烧温度为900°C时,样品的c/a值和I(003)/I(104)值最大,表明其阳离子混排程度最低,Li+在迁移过程中可能受到过渡金属阳离子的静电斥力和张力的阻碍将最小,Li+的扩散速度可能最快.23
3.1.2 煅烧温度对材料形貌的影响
图2所示为在不同煅烧温度下合成的0.5/0.5样品材料的SEM图像.从图中可以看出,随着温度的升高,最终产物的颗粒粒径逐渐增大.700°C时,产物呈絮状物,表明颗粒还没有完全成型,晶体还没有生长完全;800°C时,产物由絮状物逐渐变为散开的小颗粒,晶体生长趋于完全;900°C时,产物中絮状物几乎全部消失,材料变成分散均匀的颗粒,其中颗粒有部分团聚现象;1000°C时,材料大量团聚,颗粒粒径增大;当温度升高至1100°C时,产物几乎完全团聚,材料的分散性很差,从而比表面积急剧下降.随着颗粒粒径的增大,锂离子嵌入脱出所要迁移距离变长,大颗粒中心区的活性物质不能得到充分的利用,这将影响材料的电化学性能,使其比容量下降.
3.1.3 煅烧温度对材料电化学性能的影响

图2 不同煅烧温度下得到0.5/0.5样品的SEM图Fig.2 SEM images of 0.5/0.5 samples synthesized at different temperatures T/°C:(A)700;(B)800;(C)900;(D)1000;(E)1100
图3为在不同煅烧温度下合成的0.5/0.5样品在电流密度为20 mA·g-1,电压范围为2.0-4.8 V循环时首次充放电曲线.从图中可以看出,尽管在700、1000和1100°C时煅烧合成的样品的充电平台要高于在900°C下煅烧合成的样品,但900°C时充放电平台都比前三者的长,初始充放电比容量要比前三者高50 mAh·g-1以上,只有在800°C时的材料样品首次充放电曲线和900°C时相差不大,说明800°C下,结构良好,晶体生长已经趋于完全,这与上述XRD和SEM图所示一致.在900°C下煅烧合成的0.5/0.5材料,在首次充电过程中,出现了两个主要充电区域:3.9-4.5 V的平台和4.5 V附近的平台,这与文献报道的固溶体材料x/(1-x)充放电机制相吻合,在低电位时,主要是LiMO2组分的充电平台,在高电位时,Li2MnO3组分活化,主要是Li2MnO3的充电平台.8,10,24由于在富锂材料中Mn是以+4价的形式存在,其容量主要来自于Ni2+/Ni4+和Co3+/Co4+等氧化还原反应,故根据活性物质的质量按照法拉第定律计算,25富锂正极材料0.5/0.5的理论比容量为125.7 mAh·g-1,但合成的材料其最高实际放电比容量为267.7 mAh·g-1,这可能与富锂材料在首次充放电过程中的Li2MnO3电化学活化和Mn4+在循环过程中的还原反应有关,若容量来自过渡金属Ni2+/Ni4+、Co3+/ Co4+和Mn3+/Mn4+的氧化还原反应,则0.5/0.5材料的理论容量为293.3 mAh·g-1,依此计算,就可以比较好地解释材料高比容量的原因.
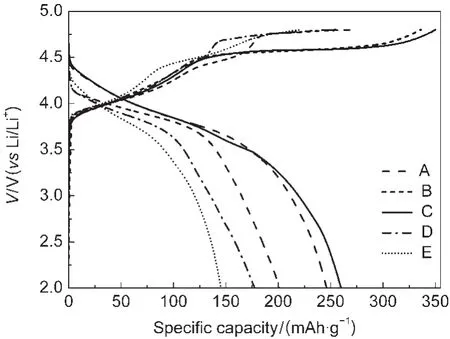
图3 不同煅烧温度下得到的0.5/0.5样品在20 mA·g-1下的首次充放电曲线Fig.3 The initial charge-discharge curves of 0.5/0.5 samples at 20 mA·g-1synthesized at different temperaturesT/°C:(A)700;(B)800;(C)900;(D 1000;(E)1100
图4为在不同煅烧温度下合成的0.5/0.5样品首次充放电的容量微分曲线图.从图中可以看到,每个氧化还原峰都对应一个充放电平台,与材料的首次充电曲线相吻合.当温度为800和900°C时,从其放电容量微分曲线中可以发现,在放电过程中小于3.5 V电压范围下出现了较为明显的还原峰,这可能是Mn4+被还原为Mn3+引起的.17,26虽然这样可以较好地解释其高比容量的原因,但至于其具体充放电机制,仍需通过进一步的实验来验证.
图5是在不同煅烧温度下合成的0.5/0.5样品材料在电流密度为20 mA·g-1,电压范围为2.0-4.8 V时前40周放电容量的变化图.如图所见,在900°C下煅烧合成的样品,其首次放电比容量为260.0 mAh·g-1,第二周放电比容量达到267.7 mAh·g-1,循环40周后放电比容量仍能达到244.7 mAh·g-1,对应首次放电而言,容量损失仅为5.89%,即放电比容量及循环稳定性均远远好于其它温度下煅烧合成的样品.由此可见,煅烧温度对0.5/0.5材料的充放电特性影响确实很大,这和锂离子在该材料嵌入和脱出的可逆性有关.诚如上面XRD、SEM等测试所述,过高或过低的煅烧温度都会引起材料结构和颗粒粒径的变化,不利于提高材料的电化学性能.
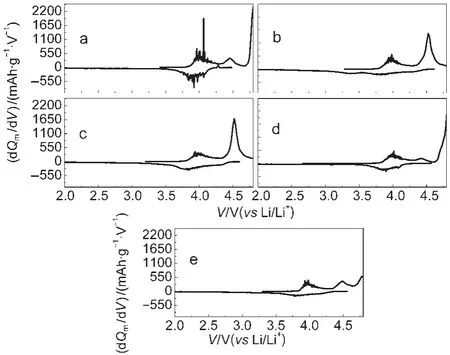
图4 不同煅烧温度下得到0.5/0.5样品的首次循环的容量微分曲线Fig.4 The initial differential capacity vs voltage of 0.5/0.5 samples synthesized at different temperaturesT/°C:(a)700;(b)800;(c)900;(d)1000;(e)1100
图6是在900°C下煅烧合成的0.5/0.5样品在电流密度为20 mA·g-1,电压范围为2.0-4.8 V时循环放电时各周容量微分的变化图.如图所见,样品在其首次充电过程中,出现4.0 V附近和4.5 V附近两个明显的氧化峰,对应着组分Li[Ni1/3Mn1/3Co1/3]O2的充电和组分Li2MnO3的活化,在随后的充电过程中,第二个氧化峰逐渐消失;在材料的放电容量微分曲线中,在3.5 V以下,出现了一个较大的还原峰,这可能是材料中Mn4+还原为Mn3+引起的.26随着循环的继续,各个氧化还原峰的强度逐渐减弱,氧化还原峰逐渐靠近,这意味着材料的结构随循环的进行,逐渐有所变化,放电比容量逐渐减小,其可逆程度逐渐增强.
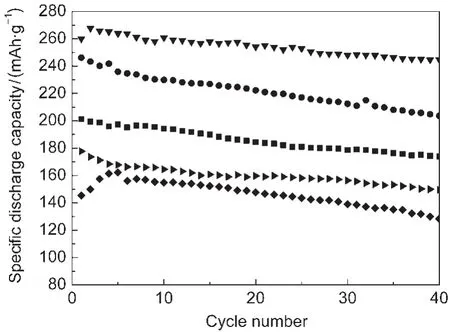
图5 不同煅烧温度下得到的0.5/0.5样品的放电容量-循环次数曲线Fig.5 Discharge specific capacity-cycle number curves of 0.5/0.5 samples synthesized at different temperaturesT/°C:(■)700;(●)800;(▼)900;(▶)1000;(◆)1100
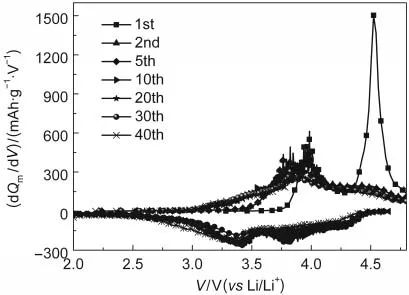
图6 900°C煅烧12 h合成的0.5/0.5样品循环放电时各周容量微分变化图Fig.6 Differential capacity vs voltage of the 0.5/0.5 sample synthesized at 900°C for 12 h
图7是在900°C下煅烧12 h合成的0.5/0.5样品在2.0-4.8 V间,不同倍率下的放电容量图.可以看出,即使合成材料中颗粒尺寸较小,粒度分布均匀,小电流下循环性能最好的0.5/0.5样品,其倍率性能也不理想.随着放电电流的增大,放电容量迅速下降.在0.5C下的放电容量已不足200.0 mAh·g-1,在5C下的放电容量仅有55.9 mAh·g-1.其原因可能有以下两点:首先,合成的材料粒径虽然在微米-亚微米级分布,但仍然较大,Li+在脱嵌过程中的扩散路径较长,从而导致倍率性能较差;第二,随着循环的继续,Li+不断地在正极材料中进行嵌脱,致使材料的层状结构发生变化,使得锂离子可进行脱嵌的位点减少,导致容量的衰减,电流越大,对材料的冲击越强,对材料结构的破坏越大,导致材料的倍率性能较差.
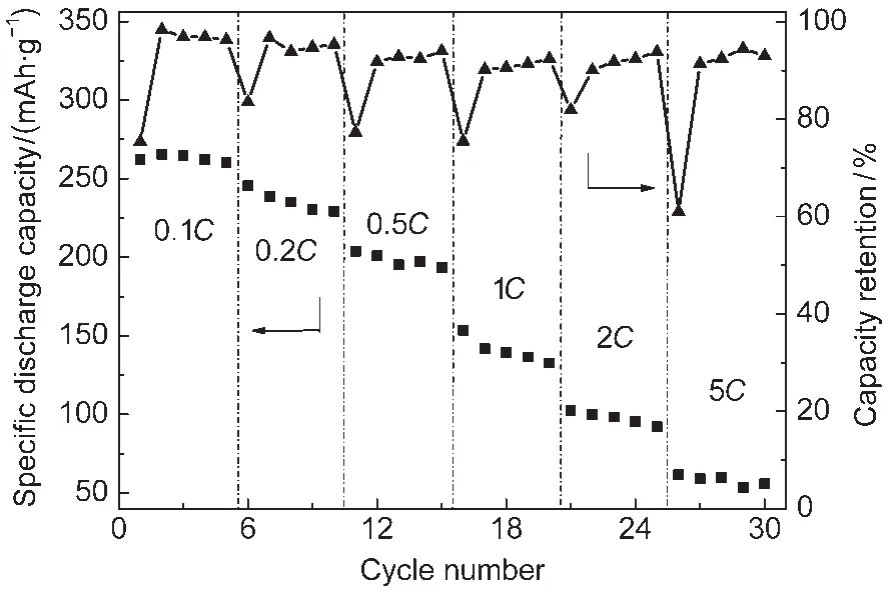
图7 900°C煅烧12 h合成的0.5/0.5样品的倍率性能Fig.7 Rate capability of the 0.5/0.5 sample synthesized at 900°C for 12 h
综上可知,不论从首次放电比容量,还是从循环稳定性等方面看,900°C下煅烧合成的0.5/0.5材料具有最佳的电化学性能.
3.2 不同的组分对材料结构与电化学性能的影响
3.2.1 不同的组分对材料结构的影响
固溶体富锂正极材料x/(1-x)中具有Li2MnO3和Li[Ni1/3Mn1/3Co1/3]O2两种组分.在材料Li[Li1/3Mn2/3]O2组分中的过渡金属层中,拥有Li:Mn原子比为1:2的层状结构,27可以稳定组分LiMO2的层状结构,从而提高材料的锂离子插层脱嵌性能;7当对该富锂材料充电时,较低电位下材料表现为Li[Ni1/3Mn1/3Co1/3]O2的充电特性,在高电位下,材料中Li2MnO3组分得到活化,锂离子继续脱出并伴随氧的释放,相当于Li2O的脱出,使得该材料在放电过程中表现出很高的比容量(可以达到260.0 mAh·g-1),同时材料中的Li2MnO3组分为Li[Ni1/3Mn1/3Co1/3]O2组分结构中的锂空位提供了充足的锂离子,可以稳定电极材料的结构.7,8
因此我们对不同的组分对固溶体富锂正极材料x/(1-x)(x=0.4,0.5,0.6)电化学性能的影响进行了研究.采用溶胶-凝胶法,在相同的合成条件下, 900°C高温煅烧12 h合成不同组分的材料.
图8是按不同组分比例合成的x/(1-x)(x=0.4, 0.5,0.6)材料的XRD图.由图8可以看出,所合成的三种组分比例的材料均可以归属为R3m型空间群的α-NaFeO2型层状结构.材料的(006)/(012)和(018)/
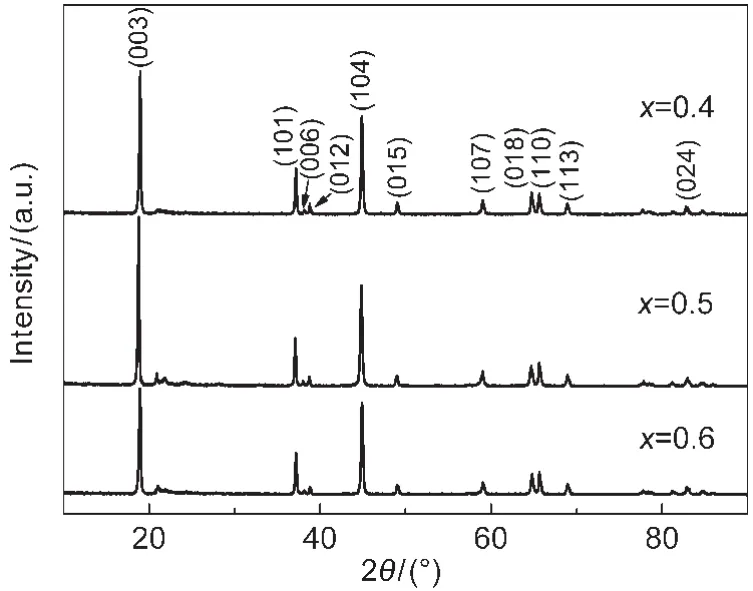
图8 x/(1-x)(x=0.4,0.5,0.6)样品的XRD图谱Fig.8 XRD patterns of x/(1-x)(x=0.4,0.5,0.6)samples
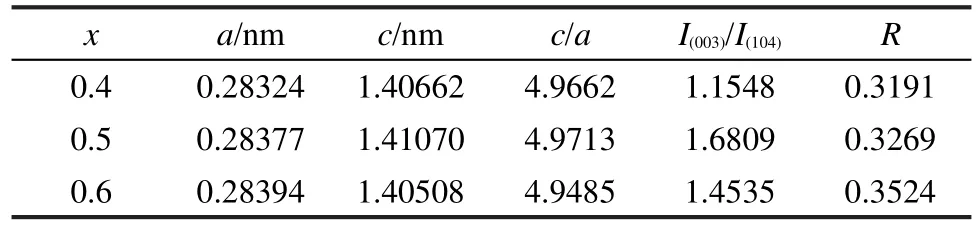
表2 x/(1-x)(x=0.4,0.5,0.6)样品的晶格参数及特征峰强度比Table 2 Lattice parameters and ratio of characteristic peak intensities of x/(1-x)(x=0.4,0.5,0.6)samples
(110)这两对衍射峰均明显分裂,说明层状结构良好.19其中,2θ=21°左右处均具有由过渡离子层中Li+和过渡金属离子Mn4+的超晶格排列引起的衍射峰,28并且没有其他的杂质峰,说明合成了晶型结构良好、分布均匀的固溶体富锂材料.
表2列出了不同比例组分x/(1-x)(x=0.4,0.5, 0.6)材料的晶胞参数及特征峰强度比,其中c/a值可以表明材料层状结构是否良好,理想的立方密堆积结构的c/a值为4.899,其值越大,说明其层状结构越好;I(003)/I(104)的比值是材料中阳离子混排程度的一个重要指标:当I(003)/I(104)<1.2时,说明材料的阳离子混排程度较高,I(003)/I(104)比值越大,说明阳离子混排程度就越低;20-22R因子(R=(I(006)+I(012))/I(101))的值可以用来衡量材料结构的有序性:R值越低,材料的有序性也越高,材料具有更好的电化学性能.29
可以看出,三种比例样品的c/a值均超过了4.899,I(003)/I(104)的值均大于1.2,进一步说明合成的材料的层状结构良好,阳离子混排程度较低.当x=0.5时,其c/a值和I(003)/I(104)值最大,表明材料的层状结构最好,阳离子混排程度最低.
3.2.2 不同的组分对材料形貌的影响
图9所示为合成的不同的组分固溶体富锂材料x/(1-x)(x=0.4,0.5,0.6)的SEM图像.从图中可以看出,不同比例组分的富锂正极材料的形貌类似,由亚微米一次粒子团聚组成粒径分布在1-3 μm的无规则颗粒.
3.2.3 不同的组分对材料电化学性能的影响

图9 x/(1-x)样品的SEM图Fig.9 SEM images of x/(1-x)samplesx:(A)0.4,(B)0.5,(C)0.6
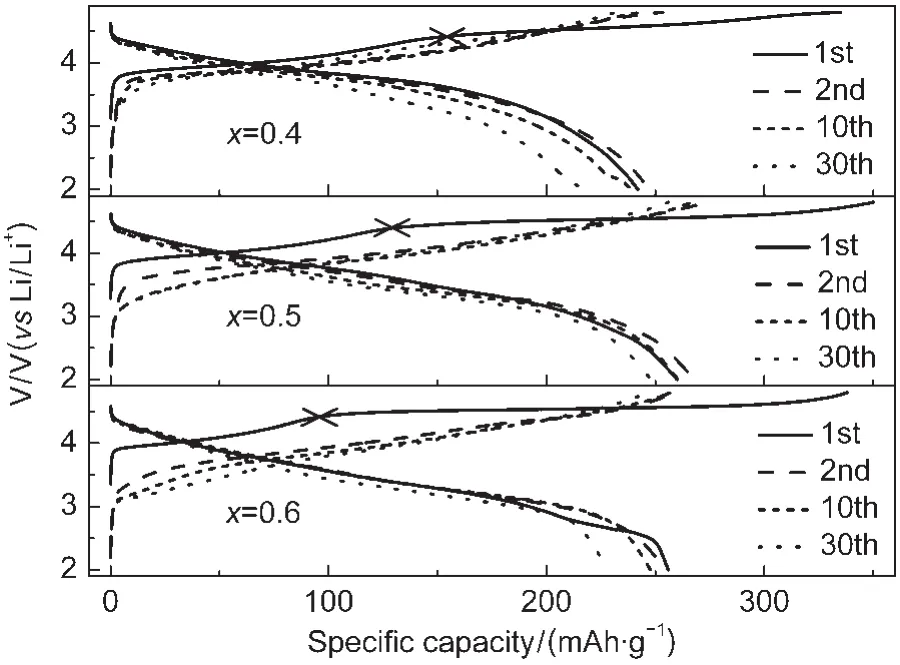
图10 x/(1-x)(x=0.4,0.5,0.6)样品的充放电曲线Fig.10 Charge-discharge curves of x/(1-x) (x=0.4,0.5,0.6)samples
图10所示为不同比例组分的x/(1-x)(x=0.4, 0.5,0.6)材料样品在电流密度为20 mA·g-1,电压范围为2.0-4.8 V循环时各周的充放电曲线.从图中可以看出,三种比例的材料的首次充电曲线均出现两个明显的平台:第一个平台在3.9-4.5 V处,这是由于材料中Li[Ni1/3Mn1/3Co1/3]O2组分在充电过程中Li+脱出的同时,Ni2+、Co3+分别被氧化成Ni4+、Co4+所致,12第二个平台在4.5 V附近,这是由于材料中Li2MnO3组分在电压高于4.5 V时,Li2MnO3活化,同时脱出Li+与O2-所致,相当于Li2O的脱出,17使得材料具有较高的首次放电容量,均在240.0 mAh·g-1以上,经过首次充放电以后,由于氧脱出以后无法再回到材料内部,这个平台消失.随着x值的增大,材料中Li2MnO3组分含量逐渐增多,Li[Ni1/3Mn1/3Co1/3]O2组分的含量逐渐减少,材料的首次充电曲线中,第二个平台逐渐增长,第一个平台逐渐变短,这与前面所说的充放电机理一致.但是因为在电压高于4.5 V时,晶格O2-伴随着Li+以“Li2O”的形式从电极材料中脱出,同时为了电荷平衡,表面的过渡金属离子从表面迁移到体相中占据锂离子脱出留下的空位,从而导致脱出的Li+不能全部回嵌至富锂材料的体相晶格中而导致首次不可逆容量损失较大,首次循环效率较低,24Manthiram等13,14采用缺锂氧化物、金属铝等对材料进行包覆,有效地改善了材料的首次循环效率,大大降低了材料的首次不可逆容量.
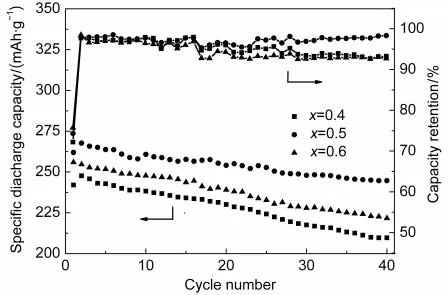
图11 x/(1-x)(x=0.4,0.5,0.6)样品的放电循环曲线Fig.11 Cyclic performances of x/(1-x)(x=0.4,0.5,0.6) samples
图11是不同的组分的固溶体富锂正极材料x/ (1-x)(x=0.4,0.5,0.6)样品在电流密度为20 mA· g-1,电压范围为2.0-4.8 V时的放电循环曲线.从图中可以看出,三种材料首次放电容量为242.0 mAh· g-1(x=0.4),260.0 mAh·g-1(x=0.5),256.0 mAh·g-1(x=0.6),随着充放电循环次数的增加,材料的放电容量递减,经40次充放电循环后的比容量分别为209.7 mAh·g-1(x=0.4),244.7 mAh·g-1(x=0.5),239.2 mAh·g-1(x=0.6),容量保持率分别为86.65%, 94.12%,86.60%.相比较而言,当x=0.5时,材料的首次放电容量、循环效率和容量保持率最高.
4 结论
采用以柠檬酸为螯合剂的溶胶-凝胶法,以金属醋酸盐为原料,高温煅烧辅助合成固溶体富锂正极材料xLi2MnO3·(1-x)Li[Ni1/3Mn1/3Co1/3]O2.材料组分和高温煅烧时间对材料的晶体结构,形貌,电化学性能都有着一定的影响.在高温900°C煅烧12 h合成的0.5Li2MnO3·0.5Li[Ni1/3Mn1/3Co1/3]O2产物晶体结构完整,电化学性能最优.在20 mA·g-1电流下首次放电比容量可达到260.0 mAh·g-1,第二次循环放电比容量可达到267.7 mAh·g-1,循环40次后放电比容量为244.7 mAh·g-1,容量保持率为94.12%,具有良好的循环稳定性.高温煅烧辅助溶胶-凝胶法,工艺简单,可以制备出性能优异的固溶体富锂正极材料0.5Li2MnO3·0.5Li[Ni1/3Mn1/3Co1/3]O2,在制备高性能的电极材料中不失为一种值得关注的合成方法.
(1) Ohzuku,T.;Ueda,A.J.Electrochem.Soc.1994,141,2972.
(2)Wu,Y.P.;Zhang,H.P.;Wu,F.;Zhang,P.;Guan,S.Y.Green Power Material;Chemical Industry Press:Beijing,2008;pp 23-30.[吴宇平,张汉平,吴 锋,张 鹏,关士友.绿色电源材料.北京:化学工业出版社,2008:23-30.]
(3) Lu,J.B.;Tang,Z.L.;Le,B.;Zhang,Z.T.;Shen,W.C.Chem. J.Chin.Univ.2005,26,2093.[卢俊彪,唐子龙,乐 斌,张中太,沈万慈.高等学校化学学报,2005,26,2093.]
(4) He,H.;Cheng,X.;Zhang,Y.J.Funct.Mater.2004,35,667. [贺 慧,程 璇,张 颖.功能材料,2004,35,667.]
(5) Gummow,R.J.;Kock,A.;Thackery,M.M.Solid State Ionics 1994,69,59.
(6)Chang,Z.R.;Chen,Z.J.;Wu,F.;Tang,H.W.;Zhu,Z.H.Acta Chim.Sin.2008,66,890.[常照荣,陈中军,吴 锋,汤宏伟,朱志红.化学学报,2008,66,890.]
(7)Thackeray,M.M.;Kang,S.H.;Johnson,C.S.J.Mater.Chem. 2007,17,3112.
(8) Johnson,C.S.;Li,N.C.;Lefief,C.;Thackeray,M.M. Electrochem.Commun.2007,9,787.
(9) Wu,Y.;Manthiram,A.Electrochem.Solid-State Lett.2006,9, A221.
(10) Wu,Y.;Manthiram,A.Solid State Ionics 2009,180,50.
(11)Gao,J.;Kim,J.;Manthiram,A.Electrochem.Commun.2009, 11,84.
(12) Kim,J.H.;Park,C.W.;Sun,Y.K.Solid State Ionics 2003,164, 43.
(13)Wang,Q.Y.;Liu,J.;Murugan,A.V.;Manthiram,A.J.Mater. Chem.2009,19,4965.
(14) Liu,J.;Reeja-Jayan,B.;Manthiram,A.J.Phys.Chem.C 2010, 114,9528.
(15) Lee,Y.J.;Kim,M.G.;Cho,J.Nano Lett.2008,8,957.
(16)Kim,M.G.;Jo,M.;Hong,Y.S.;Cho,J.Chem.Commun.2009, 218.
(17) Lu,Z.H.;Dahn,J.R.J.Electrochem.Soc.2002,149,A815.
(18)Wei,Y.;Wang,L.J.;Yan,J.;Sha,O.;Tang,Z.Y.;Ma,L.Acta Phys.-Chim Sin.2011,27,2587. [魏 怡,王利娟,闫 继,沙 鸥,唐致远,马 莉.物理化学学报,2011,27,2587.]
(19)Ohzuku,T.;Ueda,A.;Nagayama,M.J.Electrochem.Soc.1993, 140,1862.
(20)Myung,S.T.;Kumagai,N.;Komaba,S.;Chungb,H.T.Solid State Ionics 2001,139,47.
(21) Jiao,L.F.;Zhang,M.;Yuan,H.T.;Zhao,M.;Guo,J.;Wang, W.;Zhou,X.D.;Wang,Y.M.Journal of Power Sources 2007, 167,178.
(22) Kim,Y.;Kim,H.S.;Martin,S.W.Electrochim.Acta 2006,52, 1316.
(23) Kang,K.;Meng,Y.S.;Breger,J.;Grey,C.P.;Ceder,G.Science 2006,311,977.
(24)Armstrong,A.R.;Holzapfel,M.;Novak,P.;Johnson,C.S.; Kang,A.H.;Thackeray,M.M.;Bruce,P.G.J.Am.Chem.Soc. 2006,128,8694.
(25) Miao,J.H.;Chai,Z.Q.;Sun,L.Chinese Battery Industry 2000, 5,175. [缪建红,柴志强,孙 丽.电池工业,2000,5,175.]
(26)Yu,L.Y.;Qiu,W.H.;Lian,F.;Liu,W.;Kang,X.L.;Huang,J. Y.Materials Letters 2008,62,3010.
(27) Julien,C.M.;Massot,M.Mater.Sci.Eng.B 2003,100,69.
(28) Lu,Z.H.;Beaulieu,L.Y.;Donaberger,R.A.;Thomas,C.L.; Dahn,J.R.J.Electrochem.Soc.2002,149,A778.
(29) Dahn,J.R.;Sacken,U.;Michal,C.A.Solid State Ionics 1990, 44,87.
November 17,2011;Revised:January 9,2012;Published on Web:February 10,2012.
Preparation and Characterization of xLi2MnO3·(1-x)Li[Ni1/3Mn1/3Co1/3]O2Cathode Materials for Lithium-Ion Batteries
WANG Zhao WU Feng SU Yue-Feng*BAO Li-Ying CHEN Lai LI Ning CHEN Shi
(National Development Center of Hi-Tech Green Materials,School of Chemical Engineering&Environment, Beijing Institute of Technology,Beijing 100081,P.R.China)
The lithium rich cathode materials xLi2MnO3·(1-x)Li[Ni1/3Mn1/3Co1/3]O2(x=0.4,0.5,0.6)were successfully synthesized via sol-gel method with calcination in air.The transition metal acetate,lithium acetate,and citric acid were used as raw materials.The as-prepared materials were characterized by X-ray diffraction(XRD),scaning electron microscopy(SEM),and electrochemical tests.The material 0.5Li2MnO3· 0.5LiNi1/3Mn1/3Co1/3]O2,which was obtained after calcination at 900°C for 12 h,exhibited fine microstructures and good electrochemical performance.When cycled at 2.0-4.8 V with a current density of 20 mA·g-1at room temperature,0.5Li2MnO3·0.5LiNi1/3Mn1/3Co1/3]O2delivered a initial discharge specific capacity of 260.0 mAh·g-1,and maintained a capacity of 244.7 mAh·g-1after 40 cycles(capacity retention 94.12%).
Lithium-ion battery;Sol-gel;Solid solution;Cathode material;Electrochemical performance
10.3866/PKU.WHXB201202102
O646
∗Corresponding author.Email:suyuefeng@bit.edu.cn;Tel:+86-10-68918099.
The project was supported by the National Key Basic Research Program of China(973)(2009CB220100),National Natural Science Foundation of China(51102018),and National High-Tech Research and Development Program of China(863)(SQ2010AA1123116001).
国家重点基础研究发展规划(973)(2009CB220100),国家自然科学基金(51102018)和国家高技术研究发展计划(863)(SQ2010AA1123116001)资助项目
