丹皮酚脂质体的制备与质量评价
2012-11-30王海龙于珊珊赵美玲刘善奎
王海龙,于珊珊,赵美玲,刘善奎
(济南大学医学与生命科学学院,济南250022)
丹皮酚脂质体的制备与质量评价
王海龙*,于珊珊,赵美玲,刘善奎#
(济南大学医学与生命科学学院,济南250022)
目的:制备丹皮酚脂质体,并评价其质量。方法:采用薄膜分散-水化法制备丹皮酚脂质体。以丹皮酚与大豆卵磷脂重量比、胆固醇与大豆卵磷脂重量比、水化介质磷酸盐缓冲液(PBS)的pH值为考察因素,以包封率为评价指标,采用正交试验优选工艺,并考察丹皮酚脂质体的质量。结果:优选的制备工艺为丹皮酚与大豆卵磷脂的重量比为1∶20,胆固醇与大豆卵磷脂的重量比为1∶4,水化介质PBS的pH值为6.5。制得的丹皮酚脂质体颗粒圆整,平均粒径为95 nm,包封率达到91.3%,在4℃下稳定性良好。结论:所选工艺稳定、可行,制得的制剂质量合格。
丹皮酚;脂质体;薄膜分散-水化法;质量评价
丹皮酚(Paeonol)系从毛茛科植物牡丹(Paeonia suffruticosa)的根皮、萝藦科植物徐长卿(Cynanchum paniculatum)的全草等植物中提取的主要活性成分,除了具有抑菌抗炎、镇痛、抗氧化、降压等作用外,还具有较强的抗癌活性。它能通过影响肿瘤细胞基因表达等机制抑制肿瘤细胞增殖,诱导肿瘤细胞分化和凋亡,对肿瘤细胞产生杀伤作用[1]。目前临床应用的丹皮酚剂型有注射剂、软膏剂、微乳、凝胶等[2,3]。本试验将丹皮酚制成丹皮酚脂质体(Paeonol liposomes),可增强其对肿瘤细胞的靶向性,并降低毒副作用。
1 仪器与试药
RE-52AA旋转蒸发器(上海亚荣生化仪器厂);RQ2200B超声波清洗器(昆山市超声仪器有限公司);XSB-101B光学显微镜(济南强胜光电仪器有限公司);FA1104B电子分析天平(上海越平科技仪器有限公司);SH2-(D)Ⅲ循环水式真空泵(上海一展实验设备有限公司);800电动离心机(常州博远实验分析仪器厂);TU-1818紫外-可见分光光度计(北京普析通用仪器有限公司);H-800透射电子显微镜(日本日立公司);Winner801光子相关纳米粒度仪(济南微纳颗粒仪器股份有限公司);9800 Zeta电位仪(贝克曼库尔特商贸有限公司)
丹皮酚对照品(上海锐谷生物科技有限公司,纯度≥99%);丹皮酚(四川博兴实业有限公司,批号:20100910);大豆卵磷脂(德国Lipoid公司,批号:790641-09,含量≥94.7%);胆固醇(厦门星隆达化学试剂有限公司,批号:20061212);Sephadex-G50葡聚糖(100~300μm,美国Pharmacia公司);甲醇(分析纯,天津市广成化学试剂有限公司);无水乙醇(分析纯,天津市登科化学试剂有限公司);其他试剂均为分析纯。
2 方法与结果
2.1 丹皮酚脂质体的制备
2.1.1 正交试验设计 根据文献和预试验结果,选取丹皮酚与大豆卵磷脂重量比(A)、胆固醇与大豆卵磷脂重量比(B)、水化介质磷酸盐缓冲液(PBS)的pH值(C)为考察因素,每个因素选取3个水平,按正交试验L9(34)表进行试验。因素水平见表1。

表1 因素水平Tab 1 Factors and levels
2.1.2 丹皮酚脂质体的制备 按表1设计方案称取适当重量的丹皮酚、胆固醇、大豆卵磷脂于小烧杯中,加入适量无水乙醇溶解,然后将混合溶液转移入500 mL圆底烧瓶中,加入玻璃珠少许,于45℃水浴缓慢旋转减压蒸发,直至完全除去有机溶剂,形成均匀透明的薄膜。加入适量PBS进行水化至溶液透明无不溶物,超声(功率:100 W,频率:40 kHz)处理20 min,得到丹皮酚脂质体混悬液。将此混悬液分别通过0.80、0.54、0.22μm的微孔滤膜,即得丹皮酚脂质体,置于4℃冰箱冷藏,备用。
2.2 丹皮酚脂质体包封率的测定
2.2.1 测定波长的选择 取丹皮酚的甲醇溶液、空白脂质体和丹皮酚脂质体各适量,分别用甲醇破乳完全,直至溶解制成澄清溶液。上述3种溶液分别在200~400 nm波长范围内进行紫外光谱扫描。结果,丹皮酚在274 nm波长处有最大吸收,而空白脂质体在220 nm波长左右有强吸收,在274 nm波长处基本无吸收,对丹皮酚的测定不造成干扰。因此,选择测定波长为274 nm,并以空白脂质体同法处理作为空白对照溶液。紫外吸收图谱见图1。

图1 紫外吸收图谱1.丹皮酚脂质体;2.丹皮酚;3.空白脂质体Fig 1 UV absorption spectrum1.paeonol liposome;2.paeonol;3.blank liposome
2.2.2 标准曲线的制备 精密称取丹皮酚对照品适量,加甲醇适量制成15μg·mL-1的贮备液。取6支10 mL量瓶,分别精密加入0.5、1.0、2.0、4.0、6.0、8.0 mL上述贮备液,加甲醇稀释至刻度,摇匀,于274 nm波长处测定吸光度。以吸光度(A)为纵坐标,丹皮酚检测浓度(c,mg·mL-1)为横坐标,进行线性回归,得回归方程为A=93.76c-0.002 3(r=0.999 9,n=6)。结果表明,丹皮酚检测浓度在0.75~12.00μg·mL-1范围内与吸光度呈良好线性关系。
2.2.3 测定方法 制备充填Sephadex-G50葡聚糖的凝胶柱(直径:8 mm,高:12 mm),用PBS以0.2 mL·min-1的流速冲洗平衡2 h,备用。取稀释后的丹皮酚脂质体0.2 mL,加至Sephadex-G50凝胶柱上,以PBS为洗脱液,流速为0.2 mL·min-1,进行洗脱,共收集第1~5 mL乳白色丹皮酚脂质体流出组分5 mL,另收集第7~12 mL游离丹皮酚流出组分6 mL。分别精密量取上述丹皮酚脂质体和游离丹皮酚流出组分各1 mL,置于10 mL量瓶中,加甲醇充分破乳,再加PBS至刻度,摇匀,于274 nm波长处测定吸光度,按下式计算包封率:包封率=A脂/(A脂+A游)×100%(式中,A脂为丹皮酚脂质体流出组分的吸光度;A游为游离丹皮酚流出组分的吸光度)。
2.2.4 洗脱曲线测定 取丹皮酚脂质体0.2 mL,充填于Sephadex-G50凝胶柱上,按“2.2.3”项下方法进行洗脱,自上样开始,分别收集每1 mL洗脱液,加甲醇破乳,于274 nm波长处测定吸光度,根据回归方程计算丹皮酚的浓度。以洗脱体积对丹皮酚浓度作洗脱曲线。结果,丹皮酚脂质体的出峰体积在第1~4 mL之间,游离丹皮酚的出峰体积在第7~12 mL之间。另取0.2 mL蓝色葡聚糖2000水溶液加于Sephadex-G50凝胶柱上,以PBS洗脱,根据颜色标志,洗脱出葡聚糖2000前接收到PBS 5 mL。采用蓝色葡聚糖2000试验的结果与采用丹皮酚脂质体的试验结果一致,表明回收率测定时以收集第1~4 mL的丹皮酚脂质体溶液进行破乳为宜。Sephadex-G50凝胶柱洗脱曲线见图2。

图2 Sephadex-G50凝胶柱洗脱曲线1.原始曲线;2.拟合曲线Fig 2 Sephadex-G50 gel column elution curve1.original curves;2.fitted curves
2.2.5 精密度试验 取同一份丹皮酚脂质体,照“2.2.3”项下方法测定包封率,共测5次。结果,包封率分别为90.3%、91.5%、90.8%、89.9%、89.6%,平均包封率为90.4%,RSD=0.8%(n=5)。另取一份丹皮酚脂质体,在同一日的早、中、晚不同时间测定包封率,考察日内精密度;连续5 d,每天在同一时间测定包封率,考察日间精密度。结果,日内平均包封率为90.6%,RSD=1.3%(n=3);日间平均包封率为92.1%,RSD=1.7%(n=5),表明本方法精密度良好。
2.2.6 回收率试验 取3份丹皮酚脂质体,按“2.2.3”项下方法分别测得丹皮酚脂质体和游离丹皮酚流出组分的吸光度,根据回归方程计算包含的丹皮酚脂质体和游离丹皮酚的含量;另取等量丹皮酚脂质体,不过Sephadex-G50葡聚糖柱,加PBS稀释后直接加甲醇破乳,于274 nm波长处测定吸光度,同法计算体系中总的丹皮酚含量。按下式计算回收率:回收率=(m脂+m游)/m总×100%(式中,m脂为丹皮酚脂质体中丹皮酚量;m游为游离的丹皮酚含量;m总为体系中总的丹皮酚含量)。结果,3批丹皮酚脂质体中丹皮酚的平均回收率为98.1%,RSD=1.9%(n=3)。
2.3 正交试验结果
将“2.1.2”项下制备的丹皮酚脂质体分别按“2.2.3”项下方法测定包封率,并以此为评价指标优选工艺。正交试验结果见表2;方差分析结果见表3。

表2 正交试验结果Tab 2 Resultsof orthogonal test
由表2、表3可知,各因素对包封率的影响大小顺序为A>C>B,且都具有显著性影响(P<0.05或P<0.01),最佳处方工艺组合为A1B3C3,即丹皮酚与大豆卵磷脂的重量比为1∶20,胆固醇与大豆卵磷脂的重量比为1∶4,水化介质PBS的pH值为6.5。此条件下,可制备得到包封率较高的丹皮酚脂质体。
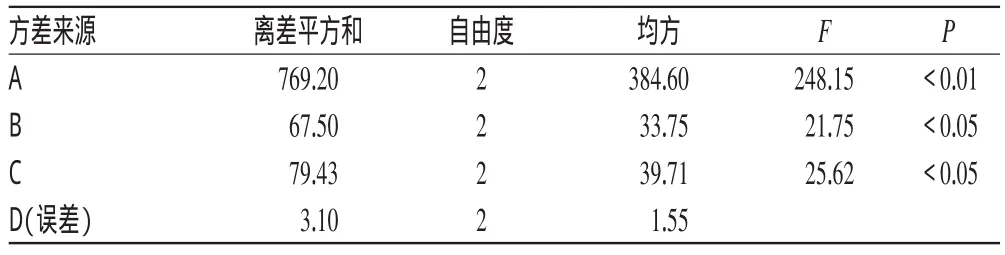
表3 方差分析结果Tab 3 Analysis of variance
2.4 丹皮酚脂质体的质量评价
2.4.1 微观形态和粒径 采用负染法对样品进行前处理。将样品用去离子水稀释后置于附有薄膜的铜网上,样品用醋酸双氧铀饱和溶液负染30 s后,抽真空条件下,透射电镜观察其形态。同时,采用微粒粒度测定仪对其进行粒度测定:将样品用已通过0.22μm微孔滤膜的注射用水稀释约5 000倍,立即放入样品池内,光源为HeNe激光(λ0=633 nm),温度为室温(25℃),测定其光强度径,至Time history曲线趋于直线时停止测定,保存数据。结果,电镜下可见新制备的丹皮酚脂质体外观呈近球形,说明形成了包裹有丹皮酚的脂质体;粒径分布图显示得到的脂质体粒径分布均匀,为48~175 nm,平均粒径为95 nm。丹皮酚脂质体电镜照片见图3;丹皮酚脂质体粒径及其分布见图4。
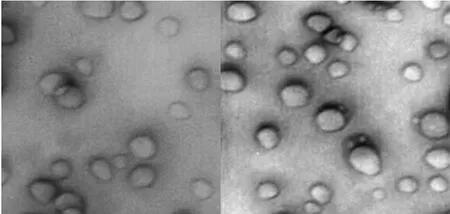
图3 丹皮酚脂质体电镜照片(36 000×)Fig 3 SEM photos of paeonol liposomes(36 000×)

图4 丹皮酚脂质体粒径及其分布Fig 4 Particle size distribution of paeonol liposomes
2.4.2 包封率的测定 按“2.3”项下最优工艺制备5批丹皮酚脂质体,照“2.2.3”项下方法测定包封率。结果,平均包封率为91.3%,RSD=1.2%(n=5)。
2.4.3 初步稳定性试验 将制备的丹皮酚脂质体(批号:20110105)在冰箱冷藏室(4℃)放置2个月后,外观没有发生明显改变;0、10、20、30、60 d的平均包封率分别为 91.6%、89.4%、90.2%、88.3%、88.7%;脂质体的pH值和过氧化值均没有变化,大豆卵磷脂没有发生明显自身氧化,未产生过氧化物、丙二醛、脂肪酸和溶血磷脂等有害物质。这表明4℃冷藏条件下,制备的丹皮酚脂质体较稳定。
3 讨论
脂质体的制备方法有很多,常用的有薄膜分散法、逆相蒸发法、溶剂注入法、超声分散法、冷冻干燥法等[4,5]。脂质体的制备工艺对其粒径、包封率等理化特性影响较大,如脂质体粒径<50 nm时会较多地分布于骨髓,而粒径在100~300 nm时会更多地分布于淋巴,7~30μm粒子则由于机械作用分布于肺部,更大的粒子则被用来局部栓塞,所以稳定并经过优化的工艺对保证脂质体质量极为重要。在采用薄膜分散-水化法制备脂质体的工艺时,笔者发现影响因素很多,除文中已涉及的以外,还有蒸发烧瓶的大小、倾斜角度、蒸发过程中的真空度等也对脂质体理化特性有一定影响,但影响较轻微,所以本试验在正交试验中未考虑这些因素。笔者经过较少的试验得到比较理想的结果,所制脂质体十分稳定,为后续疗效评价打下了较好的基础。
丹皮酚在274 nm波长处有强烈的紫外吸收[6],因而利用这一性质进行脂质体包封率的测定。在包封率测定方法的研究中,脂质体和不溶性药物的结晶如何完全分离一直是比较难以解决的问题。在本试验中,丹皮酚在水中的表观溶解度为0.386 mg·mL-1,溶解度较大[7],不容易形成结晶,因而可以采用凝胶层析法将脂质体和游离药物完全分离。测定包封率时采用甲醇进行破乳应使体系中甲醇的量足够,才能破乳完全,否则丹皮酚的吸收曲线会发生较大变化导致无法测定。
[1] 孙言才,沈玉先,孙国平.丹皮酚的主要药理活性研究进展[J].中成药,2004,26(7):579.
[2] 邓步华,杨宗发.丹皮酚-β-环糊精包合物处方工艺研究[J].中国药房,2009,20(25):1 965.
[3] 邢国胜,房德敏,周咏梅,等.丹皮酚的制备及药理作用研究进展[J].中草药,2006,37(11):附2.
[4] Nii T,Ishii F.Encapsulation efficiency of water-soluble and insoluble drugs in liposomes prepared by the microencapsulation vesicle method[J].Int JPharm,2005,298(1):198.
[5] 王健松,朱家壁.阿奇霉素脂质体的制备及其包封率测定[J].中国药科大学学报,2004,35(6):499.
[6] 简 晖,高丽丽,孙婷婷,等.正交设计试验优化丹皮酚HP-β-CD包含物制备工艺[J].中国实验方剂学杂志,2008,14(12):37.
[7] 王 森,朱卫丰,欧水平,等.丹皮酚理化性质及体外经皮渗透性的研究[J].中药新药与临床药理,2011,21(2):215.
Preparation and Quality Evaluation of Paeonol Lipsomes
WANG Hai-long,YU Shan-shan,ZHAO Mei-ling,LIU Shan-kui
(College of Medical and Life Science,University of Jinan,Jinan 250022,China)
OBJECTIVE:To prepare Paeonol liposomes,and to evaluate its quality.METHODS:Paeonol lipsomes were prepared by film dispersion-evaporation method.The preparation technology was optimized by orthogonal experiment with ratio of paeonol to soybean lecithin,ratio of cholesterol to soybean lecithin and pH value of PBS as factors using entrapment efficiency as index.The quality of Paeonol lipsomes was evaluated.RESULTS:Optimized technology was as follows:ratio of paeonol to soybeanl ecithin 1∶20,ratio of cholesterol to soybean lecithin 1∶4,pH value of PBS 6.5.Paeonol liposomes were round and regular in appearance with means particle size of 95 nm,and the entrapment efficiency of then was up to 91.3%.The preparation was stable at 4℃.CONCLUSION:The technology is stable and practicable,and the quality of preparation is well.
Paeonol;Liposomes;Film dispersion-evaporation method;Quality evaluation
R283.69;R918
A
1001-0408(2012)43-4065-03
DOI 10.6039/j.issn.1001-0408.2012.43.13
*讲师,硕士。研究方向。药物制剂分析。电话:0531-89736825。E-mail:chm_wanghl@ujn.edu.cn
#通讯作者:副教授,博士。研究方向:药物制剂。电话:0531-89736825。E-mail:chm_liusk@ujn.edu.cn
2011-11-19
2012-02-08)
