循环microRNA的研究进展
2012-11-26张昌明综述刘志红审校
张昌明 综述 刘志红 审校
微小核糖核酸(microRNA,简称miRNA),是一类非编码的由19~23个核苷酸组成的小分子单链RNA,它们能够与靶 mRNA的3’-UTR及5’-UTR区的碱基互补配对而起作用,使mRNA降解或抑制mRNA翻译,从而参与各种重要的生理和病理过程[1-3]。miRNA参与调控众多的信号转导途径、胚胎干细胞和多种成体干细胞的发育、胚胎后期发育、细胞增生、分化、凋亡、胰岛素分泌、大脑形成、血管生成、心脏发生、肿瘤形成及免疫应答等。近年研究表明miRNA可稳定存在于血清、血浆等体液中,有可能作为一种新的生物标志物用于临床,有助诊断疾病或者判断疾病的预后和复发情况,指导用药和选择治疗方式[4]。微囊泡(microvesicles,MVs)可以携带miRNAs到达受体细胞,并在其中发挥作用,影响受体细胞的功能[5]。以下就循环miRNA的研究进展做一综述。
循环miRNA的发现
大量研究表明MVs可以介导细胞间功能性蛋白的传播。众多学者逐渐认识到功能性RNA,尤其是miRNA也可能通过这种方式水平传播。早在1988 年Benner[6]就曾提出“细胞外通讯 RNA”假说,并认为细胞外RNA在细胞增生和分化中起重要作用。2006年,Ratajczak等[7]首先证实细胞间mRNA的水平传播。该作者发现来自胚胎干细胞的MVs不仅通过结合表面受体,而且通过传递mRNA诱导造血祖细胞的改变。Valadi等[8]研究认为分泌性mRNA、miRNA是外来体穿梭 RNA(exosomal shuttle RNA,esRNA),他们发现小鼠和人肥大细胞系及原始骨髓来源的肥大细胞的exosome中含有mRNA、miRNA。芯片结果显示这些exosome中含有大约1 300种 mRNA,120种 miRNA,其中有些是exosome特异性的,因为在供体细胞中并未检出。不仅细胞培养上清exosome中含有miRNA,人血浆MVs 中 也 可 检 出 miRNA。2008 年,Mitchell[9]、Chen[10]、Gilad[11]等学者几乎同时报道了人血清、血浆中可检出miRNA,而且血清、血浆miRNA水平与多种病理、生理状态密切相关,可能作为疾病诊断的生物标志物。Mitchell等[9]分离了健康人血浆中的18~24 nt的RNA,构建了小RNA文库,对得到的125个DNA克隆进行测序分析,在所采用的血浆样本中克隆到了37种miRNA分子,其中包括let-7a,miRNA-16和 miRNA-15b等。Chen等[10]通 过Solexa测序分析,在正常男性和女性血清中分别发现100种和91种miRNA。Gilad等[11]发现血清、尿液、唾液、羊水等多种体液中可以检测到miRNA,而且胎盘相关的miRNA在妊娠女性血清中明显升高。
循环miRNA的生物学特征
循环miRNA的存在形式及稳定性 尽管血浆中存在核糖核酸酶(ribonuclease,RNase),但是内源性的miRNA仍可稳定存在于血浆中,即使在多种恶劣条件(如极端pH、反复冻融等)下仍然高度稳定。目前认为循环miRNA之所以如此稳定,是因为细胞外的miRNA包含在MVs中从而免于RNase的降解。根据其来源的不同,MVs分为两种[12]:一种直接从细胞膜以出芽的形式释放到细胞周围空隙,称为Shedding vesicle(SV)。另一种来源于细胞内的多泡体(multivesicular bodies,MVB),细胞膜向内出芽,形成早期内体,进而形成MVB。MVB与胞膜融合,释放其内的 MVs,即 exosome。Zhang等[5]发现培养的人单核细胞白血病(THP-1)细胞释放的MVs主要以exosome的形式存在,直径较均一(30~60 nm)。而人血浆中的MVs是SV、exosome及其他囊泡结构的混合物,直径40~200 nm,在上述几种形式的MVs中均可检出miRNA。Skog等[13]直接证实将MVs暴露于RNase A条件下其内RNA量仅下降7%,表明大部分RNA都包含在MVs中从而免于RNase的降解。而用去污剂破坏脂质囊泡结构后细胞外 miRNA立即降解,如 Zhang等[5]研究表明MVs经RNase处理后,miRNA表达水平无变化,而用Trion X-100处理后则明显下降。但也有研究认为,循环miRNA主要不是存在于MVs中,而是与Ago2蛋白结合形成Ago2蛋白miRNA复合物而稳定存在[14],其来源可能是死亡或濒死的细胞。
循环miRNA产生的分子机制 miRNA是随机分配到MVs中还是选择性的包裹在MVs中目前尚不清楚。尽管已有一些研究提示MVs可以选择性的包裹小 RNA[8,13],但是这种选择机制尚缺乏有力证据。MVB分为两种,一种称为降解MVB,与溶酶体融合而降解;另一种称为胞外MVB,与胞膜融合,释放产生的囊泡,即exosome。在MVB向溶酶体聚集过程中转运必需内涵体分选复合物(endosomal sorting complex required for transport,ESCRT)发挥重要作用,但是循环miRNA分泌的具体分子机制仍不清楚。Trajkovic等[15]研究发现exosome相关组分被包裹进入MVB并不依赖ESCRT机制,而是需要神经酰胺(Ceramide,Cer)的参与,因为该作者研究发现exosome中含有大量的鞘磷脂(sphingomyelin,SM)及神经酰胺。而神经酰胺的合成受到中性鞘磷脂酶2(nSMase2)的控制。用nSMase2抑制剂GW4869处理Oli-neu细胞后exosome释放明显降低。Kosaka等[16]最近的研究则表明含miRNA的exosome的释放也是由神经酰胺触发的。过表达nSMase2可以提高细胞外miRNA的水平,相反,使用特异性小干扰RNA或化学物质抑制nSMase2的酶活性则明显降低miRNA的分泌。在miRNA的释放过程中ESCRT系统是非必须的。Mittelbrunn等[17]发现通过化学抑制剂或小干扰RNA抑制nSMase2进而抑制exosome的产生会降低miRNA向抗原递呈细胞的转移。这一结果也支持miRNA的分泌是由神经酰胺触发、而非依赖于 ESCRT系统。Gibbing等[18]研究发现miRNA包裹入exosome可能不是一个随机事件,而是由特异性蛋白控制的;RNA诱导的沉默复合体(RNA-induced silencing complex,RISC)中的一个组分GW182在exosome中表达极其丰富。而GW182是miRNA与Ago2相互作用发挥功能所必须的。同时Zhang等[5]发现培养的THP-1细胞释放的exosome中也有Ago2蛋白,这些结果表明exosome不仅携带miRNA,而且携带RISC的组分来增强miRNA的功能。
miRNA进入受体细胞的机制 MVs将其内的miRNA成分传递入受体细胞的机制仍不清楚。目前认为MVs可能通过内吞、吞噬或者与胞膜直接融合等方式内化入受体细胞,而在这一过程中miRNA也被同时传递入受体细胞[12]。但是仍然需要更多的研究来阐明细胞外miRNA的摄取机制。循环miRNA产生、分选及释放机制见图1。
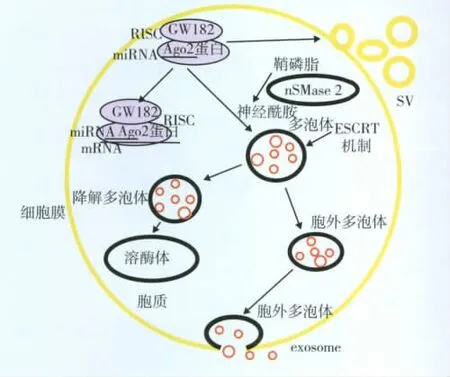
图1 循环microRNA产生、分选及释放机制
循环miRNA的生理及病理功能
循环miRNA介导细胞间相互作用 Zhang等[5]首次发现 MVs到达受体细胞(recipient cell)后,不仅可以传递蛋白、mRNA、脂质,而且可以传递miRNA给受体细胞,以触发下游的信号事件。即miRNA首先包裹在分泌性MVs中,随着MVs分泌到循环中,进入靶细胞作为内源性miRNA调节多种靶基因或者信号事件,该作者选用人微血管内皮细胞系(human microvascular cell line,HMEC-1)作为受体细胞发现,含有来源于THP-1细胞FITC标记的miRNA-150的MVs能够进入HMEC-1细胞,使后者miRNA-150表达水平明显升高。这一结果表明miRNA是可以被分泌并且通过MVs传递到远隔部位的靶细胞。如果在293T细胞中过表达miRNA-150然后收集培养上清中分离出的MVs,结果发现富含miRNA-150的MVs能使HMEC-1细胞中c-Myb蛋白的表达明显降低,增强HMEC-1细胞的迁移能力。如果沉默THP-1细胞内miRNA-150的表达,收集这些细胞的培养上清分离MVs,则缺乏miRNA-150的 MVs并不影响 HMEC-1细胞中的c-Myb蛋白表达及HMEC-1细胞的迁移能力,另外该作者动物实验结果则显示THP-1细胞来源的经Dil-C16标记的MVs经尾静脉注射给C57BL/6小鼠,小鼠血管内皮可以被荧光标记,血管内皮层中miRNA-150表达水平明显升高。进一步,作者发现动脉粥样硬化患者血浆中分离出的MVs中miRNA-150水平较正常人升高,而这种患者的MVs可以使HMEC-1细胞中c-Myb蛋白的表达明显降低,促进HMEC-1细胞的迁移。这些结果表明病理状态下MV中携带的分泌性miRNA可以到达受体细胞和组织发挥功能。Pegtel等[19]通过体外共培养实验证实人类疱疹病毒(EB病毒)感染的B细胞能分泌病毒miRNA,后者可以被非感染的受体细胞摄取,这一过程是剂量依赖的。进一步作者观察到EB病毒负荷增加的人群外周血单个核细胞中,尽管EB病毒DNA仅存在于循环 B细胞中,但是 EB病毒miRNA,如BART miRNA却同时出现在B细胞及非B细胞中,这也提示了循环miRNA在细胞间的转移。Mittelbrunn等[17]研究显示J77 T细胞系、Raji B细胞系及原代的树突状细胞分泌的exosome中包含有miRNA,而且这些miRNA有别于其母体细胞,抗原刺激可以诱导免疫突触的形成,促进miRNA,如miRNA-335从T细胞向抗原递呈细胞的单向转移,而这一过程是由exosome介导的。而且作者通过进一步实验证实了转移到抗原递呈细胞中的miRNA在受体细胞中是有功能的,如miRNA-335可以抑制APC中SOX4 mRNA的翻译。这一结果阐释了一种细胞间抗原依赖的、exosome介导的单向的miRNA的转移机制,而miRNA在免疫细胞之间的转移则可加强免疫细胞之间信号传递,在免疫反应中精细调节基因表达。
外源性miRNA介导植物-动物界交流 Zhang等[20]最新研究发现外源性摄入的植物miRNA168a可以被小鼠消化道吸收,进入血循环及胃、小肠、肝脏等多种脏器,与靶基因低密度脂蛋白受体衔接蛋白1(low-density lipoprotein receptor adapter protein 1,LDLRAP1)结合,从而抑制其在肝脏中的表达,减缓低密度脂蛋白从血浆中的清除。这一发现证明食物中的外源性植物miRNA可以通过调控哺乳动物体内靶基因表达的方式而影响摄食者的生理功能。
循环miRNA可能作为理想的生物标志物
循环miRNA作为生物标志物具有取样损伤小、具有组织或疾病特异度、稳定性好等优点,可能作为理想的新型生物标志物。
循环miRNA作为肿瘤标志物 肿瘤是目前对人类威胁最大的疾病之一。研究结果证实,约50%miRNA基因存在于那些与癌症密切相关的人类基因组脆性位点[21]。此外,miRNA基因还被证实扮演着原癌基因和抑癌基因的角色,说明miRNA在肿瘤发生过程中起至关重要作用。最早由Lawrie等[22]报道循环miRNA有作为肿瘤标志物的潜能,他们发现,弥漫性大B细胞淋巴瘤患者血清中肿瘤相关 miRNA,如 miRNA-155,miRNA-210,miRNA-21表达水平较正常对照明显升高,而且高表达的miRNA-21与这类患者的复发-缓解相关。之后关于循环miRNA作为肿瘤标志物的研究屡屡报道。如Hu等[23]通过solexa测序及 qRT-PCR技术发现,血清中四种 miRNA(miRNA-486、miRNA-30d、miRNA-1、miRNA-499)和肺癌患者的总体生存率密切相关。血清中高表达 miRNA-486、miRNA-30d而低表达miRNA-1、miRNA-499与低生存率独立相关。携带这四种“高危miRNA”的患者生存期较无携带者缩短。显示这四种miRNA单独或者作为“指纹”可能作为预测肺癌患者生存率的生物标志物。Heneghan等[24]研究发现miRNA-195在乳腺癌患者血液中表达明显高于正常对照,在前列腺癌、结肠癌、肾癌、黑色素瘤四种肿瘤中则不升高。说明miRNA-195是乳腺癌特异的miRNA,可以区分乳腺癌和其他肿瘤及正常人,敏感度为87.7%,特异度为91%。而且血miRNA-195水平可以反映肿瘤miRNA-195水平,与肿瘤体积和分期相关,在肿瘤组织切除后两周该miRNA水平即可降至正常。
循环miRNA作为组织损伤标志物 药物诱导的肝损伤是很多药物的常见不良反应。Wang等[25]发现在对乙酰氨基酚导致的肝损伤小鼠,血浆中miRNA-192、miRNA-122的表达水平明显高于对照组,并且呈现出剂量依赖性和暴露时间依赖性。两者的升高与血清转氨酶升高及肝组织病理改变相平行,但是可以被更早地检出。Laterza等[26]采用PCR技术检测接受肝脏或者肌肉毒性药物大鼠或外科卒中模型大鼠血浆中特异性 miRNA(miRNA-122、miRNA-133a及miRNA-124)浓度,结果显示,肝、肌肉、脑损伤会相应地引起血浆中 miRNA-122、miRNA-133a及 miRNA-124浓度升高;肝损伤时miRNA-122的特异性较谷丙转氨酶(ALT)要高,因为在其他器官损伤中并未发现血miRNA-122升高,而以往检测方法中ALT及谷氨酸氨基转移酶的升高也会出现在其他损伤组织中。而且miRNA-122反映肝脏损伤的敏感度也较ALT高,因为在肝损伤药物处理后,一些ALT不升高或无明显肝脏组织病理改变的大鼠血浆中其miRNA-122也是升高的。在大鼠外科卒中模型所致脑损伤的8h内血miRNA-124浓度即开始升高,并于24h达到高峰。这些结果表明miRNA可作为组织损伤新的诊断标志物。
循环miR作为肾脏疾病生物标志物 系统性红斑狼疮(systemic lupus erythematosus,SLE)是常见而严重的自身免疫性疾病,临床表现多样,肾脏是常见的受累器官之一。Wang等[27]分析40例SLE患者及30例正常人血清及尿液miRNA,结果显示,与正常组相比,SLE患者血清 miRNA-200a、miRNA-200b、miRNA-200c、miRNA-429、miRNA-205 和miRNA-192,尿液miRNA-200a、 miRNA-200c、miRNA-141、miRNA-429及miR-192表达水平降低。而肾小球滤过率与血清miRNA-200b、miRNA-200c、miRNA-429、miRNA-205和miRNA-192相关;尿蛋白与血清miRNA-200a、miRNA-200c负相关;SLE疾病活动性指数与血清miRNA-200a负相关。这些结果显示血清miRNA水平可能作为SLE的诊断及活动性判断的生物标志物。
急性肾损伤(acute kidney injury,AKI)是危重患者预后差的独立危险因素。近期一项包括29 000例危重患者的多国、多中心的研究显示AKI患者的在院死亡率超过60%[28]。寻找AKI的早期标志物是进行治疗干预的先决条件,因此寻找AKI新的标志物至关重要。Lorenzen等[29]学者检测并分析了AKI患者肾脏替代治疗前血浆中miRNA表达水平,以期评估循环miRNA对合并AKI的危重患者的死亡率及肾脏恢复的预测价值,该作者首先通过miRNA芯片检测了AKI患者血浆miRNA表达谱,并通过实时定量PCR在77例AKI患者,30例年龄匹配的正常对照和18例急性心肌梗死(acute myocardial infarction,AMI)患者中对该结果进行了验证结果显示,与正常对照及疾病对照相比,AKI患者血浆miRNA-16、miRNA-320明显下调,而miRNA-210则明显上调。基线 miRNA-16、miRNA-210和miRNA-320水平和乳酸水平相关,基线miRNA-210水平和心率相关,miRNA-320水平和心率及去甲肾上腺素剂量相关。但是循环miRNA水平与急性生理和慢性健康评分Ⅱ或序贯器官衰竭评分之间未发现相关性。开始肾脏替代治疗28d内死亡的患者循环miRNA-210和miRNA-320水平明显高于幸存者。COX回归分析及K-M生存曲线分析显示miRNA-210是AKI患者28d幸存的独立、有力的预测因子,其阳性预测值为0.412,阴性预测值为1.0。miRNA-210可以预测AKI人群的死亡率,可能作为AKI新的生物标志物,并在细胞水平反映AKI的病理生理变化。
小结:循环miRNA的研究及其临床应用仍面临巨大挑战。首先,仅仅采用一种循环miRNA作为生物标志物往往特异性不足,不同患者的多样性可能导致只用一种循环miRNA来判断疾病显得极不可靠。其次,由于循环中miRNA的表达量较低,寻找一种灵敏度高、操作简便且成本低廉的检测方法是目前循环miRNA应用于肿瘤等疾病临床检测亟待解决的问题。再者前文提到的测定循环miRNA的实验样本都来源于有限数量的患者,因此,还需进一步的大样本实验。目前循环miRNA介导基因沉默的研究仍处于体外细胞实验阶段,尚无体内实验等直接证据证实这一机制。但是,循环miRNA概念的提出将改变和补充对疾病发生发展的传统认识,为发病机制研究,疾病诊断、治疗和预后判断以及新治疗靶点的发现提供了新的途径。循环miRNA所介导的新的细胞间交流的机制以及miRNA介导的植物-动物界之间生物信息交流的阐明也为更好的理解生物学过程及疾病病理生理过程提供了新的视角。
1 Moss EG,Poethig RS.MicroRNAs:something new under the sun.Curr Biol,2002,12(20):R688-690.
2 He L,Hannon GJ.MicroRNAs:small RNAs with a big role in gene regulation.Nat Rev Genet,2004,5(7):522-531.
3 Bartel DP.MicroRNAs:genomics,biogenesis,mechanism,and function.Cell,2004,116(2):281-297.
4 Esquela-Kerscher A,Slack FJ.Oncomirs-microRNAs with a role in cancer.Nat Rev Cancer,2006,6(4):259-269.
5 Zhang Y,Liu D,Chen X,et al.Secreted monocytic miR-150 enhances targeted endothelial cell migration.Mol Cell,2010,39(1):133-144.
6 Benner SA.Extracellular‘communicator RNA’.FEBS Lett,1988,233(2):225-228.
7 Ratajczak J,Miekus K,Kucia M,et al.Embryonic stem cell-derived microvesicles reprogram hematopoietic progenitors:evidence for horizontal transfer of mRNA and protein delivery.Leukemia,2006,20(5):847-856.
8 Valadi H,Ekström K,Bossios A,et al.Exosome-mediated transfer of mRNAs and microRNAs is a novel mechanism of genetic exchange between cells.Nat Cell Biol,2007,9(6):654-659.
9 Mitchell PS,Parkin RK,Kroh EM,et al.Circulating microRNAs as stable blood-based markers for cancer detection.Proc Natl Acad Sci U SA,2008,105(30):10513-10518.
10 Chen X,Ba Y,Ma L,et al.Characterization of microRNAs in serum:a novel class of biomarkers for diagnosis of cancer and other diseases.Cell Res,2008,18(10):997-1006.
11 Gilad S,Meiri E,Yogev Y,et al.Serum microRNAs are promising novel biomarkers.PLoSOne,2008,3(9):e3148.
12 Cocucci E,Racchetti G,Meldolesi J.Shedding microvesicles:artefacts no more.Trends Cell Biol,2009,19(2):43-51.
13 Skog J,Würdinger T,van Rijn S,et al.Glioblastoma microvesicles transport RNA and proteins that promote tumour growth and provide diagnostic biomarkers.Nat Cell Biol,2008,10(12):1470-1476.
14 Turchinovich A,Weiz L,Langheinz A,et al.Characterization of extracellular circulating microRNA.Nucleic Acids Res,2011,39(16):7223-7233.
15 Trajkovic K,Hsu C,Chiantia S,et al.Ceramide triggers budding of exosome vesicles into multivesicular endosomes.Science,2008,319(5867):1244-1427.
16 Kosaka N,Iguchi H,Yoshioka Y,et al.Secretory mechanisms and intercellular transfer of microRNAs in living cells.JBiol Chem,2010,285(23):17442-17452.
17 Mittelbrunn M,Gutiérrez-Vázquez C,Villarroya-Beltri C,et al.Unidirectional transfer of microRNA-loaded exosomes from T cells to antigen-presenting cells.Nat Commun,2011,2:282.
18 Gibbings DJ,Ciaudo C,Erhardt M,et al.Multivesicular bodies associate with components of miRNA effector complexes and modulate miRNA activity.Nat Cell Biol,2009,11(9):1143-1149.
19 Pegtel DM,Cosmopoulos K,Thorley-Lawson DA,et al.Functional delivery of viral miRNAs via exosomes.Proc Natl Acad Sci U S A,2010,107(14):6328-6333.
20 Zhang L,Hou D,Chen X,et al.Exogenous plant MIR168a specifically targets mammalian LDLRAP1:evidence of cross-kingdom regulation by microRNA.Cell Res,2012,22(1):107-126.
21 Calin GA,Sevignani C,Dumitru CD,et al.Human microRNA genes are frequently located at fragile sites and genomic regions involved in cancers.Proc Natl Acad Sci U SA,2004,101(9):2999-3004.
22 Lawrie CH,Gal S,Dunlop HM,et al.Detection of elevated levels of tumour-associated microRNAs in serum of patients with diffuse large B-cell lymphoma.Br J Haematol,2008,141(5):672-675.
23 Hu Z,Chen X,Zhao Y,et al.Serum microRNA signatures identified in a genome-wide serum microRNA expression profiling predict survival of non-small-cell lung cancer.J Clin Oncol,2010,28(10):1721-1726.
24 Heneghan HM,Miller N,Kelly R,et al.Systemic miRNA-195 differentiates breast cancer from other malignancies and is a potential biomarker for detecting noninvasive and early stage disease.Oncologist,2010,15(7):673-682.
25 Wang K,Zhang S,Marzolf B,et al.Circulating microRNAs,potential biomarkers for drug-induced liver injury.Proc Natl Acad Sci U SA,2009,106(11):4402-4407.
26 Laterza OF,Lim L,Garrett-Engele PW,et al.Plasma MicroRNAs as sensitive and specific biomarkers of tissue injury.Clin Chem,2009,55(11):1977-1983.
27 Wang G,Tam L,Li EK,et al.Serum and urinary free microRNA level in patients with systemic lupus erythematosus.Lupus,2011,20(5):493-500.
28 Uchino S,Kellum JA,Bellomo R,et al.Acute renal failure in critically ill patients:a multinational,multicenter study.JAMA,2005,294(7):813-818.
29 Lorenzen JM,Kielstein JT,Hafer C,et al.Circulating miR-210 Predicts Survival in Critically Ill Patients with Acute Kidney Injury.Clin JAm Soc Nephrol,2011,6(7):1540-1546.
