激素联合环磷酰胺治疗特发性膜性肾病前瞻性对照性临床观察
2012-11-26李世军刘志红
吴 燕 左 科 王 波 李世军 刘志红
特发性膜性肾病(IMN)是成人肾病综合征最常见原因之一[1]。该病病程长、病情易于反复,影响因素多,预后差别大。约20~40%IMN患者肾功能逐渐减退并可进入终末期肾病,但也有近三分之一患者在病程中可出现自发缓解[2,3]。因此近30年来,IMN是否需要免疫抑制剂治疗及选用何种方案一直存在争议,临床随机对照试验(RCT)证实有效果的只有Ponticelli的激素联合细胞毒[氮芥或环磷酰胺(CTX)]交替治疗 6 月的治疗方案[4-8],并以糖皮质激素联合CTX方案应用最为广泛,也是KDIGO指南推荐的膜性肾病首选治疗方案。具体方案为:第1,3,5月初予甲泼尼龙(MP)1g连续冲击3d,后予泼尼松0.5mg/(kg·d)口服治疗27d,每2,4,6 月停用激素,予 CTX 2mg/(kg·d)口服[8]。该疗法在短期内使用大剂量糖皮质激素(>9g),CTX(>10g),在欧、美等国的RCT中发现感染等不良反应发生率高,该方案是否合适亚洲人群,目前尚无相关文献报道。那么对于中国IMN患者,减少药物使用剂量是否可以减少治疗不良反应同时也有好的治疗效果呢?本研究为减少本治疗方案应用于中国IMN患者可能出现的不良反应,将MP冲击治疗减至0.5 g/d连续冲击3d,泼尼松口服剂量不变,CTX改为静脉冲击治疗,具体剂量为每2,4,6月予0.75 g/m2体表面积(BSA)冲击治疗1次,停用泼尼松,前瞻性对照观察改良后的治疗方案治疗中国IMN患者的短期疗效,不良反应。
对象和方法
病例选择 选择59例南京军区南京总医院全军肾脏病研究所住院患者,均符合以下条件:(1)年龄18~65岁,汉族,性别不限;(2)肾活检病理符合IMN,无明显系膜增生,无细胞浸润,免疫荧光以IgG及C3沉积为主,镜下无内皮下及系膜区免疫复合物沉积。(3)临床表现:尿蛋白定量>3.5 g/d,血清白蛋白<30 g/L,血清肌酐(SCr)<132.6μmol/L(1.5mg/dl)。如伴有以下情况则排除在外:(1)系统性红斑狼疮、乙型或丙型肝炎病毒感染、甲状腺及其他部位肿瘤、有机溶剂、重金属中毒者等明确继发原因导致的膜性病变。(2)有严重并发症,如感染、心功能不全、肝功能异常及糖代谢异常者;(3)近3月曾接受大剂量泼尼松(>30mg/d),环磷酰胺(CTX),CsA,霉酚酸酯,FK506等治疗者。本研究经我院伦理委员会同意,所有患者在入组前签署知情同意书。
肾脏病理 所有患者均在B超引导下行肾活检术,标本均行常规光学显微镜及免疫荧光及电镜检查。免疫荧光检查行 IgG、IgM、IgA、C3、C4、C1q及纤维蛋白相关抗原(FRA)染色。重点观察包括肾小球硬化率,肾小管间质病变程度,免疫荧光观察免疫球蛋白和补体沉积的种类、强度及部位,电镜观察免疫复合物沉积位置。肾小管间质病变程度根据间质纤维化病变程度分为轻度(<25%)、中度(25%~50%)、重度(>50%)。
研究设计和治疗方案
随机分组 采用随机数将入组患者随机分为两个治疗组:改良Ponticelli方案治疗组(MP+CTX,29例)和对照组(缬沙坦,30例)。短期疗效观察时间为6月。
治疗方案 治疗组为第1,3,5月前三天予MP 0.5g连续冲击,后予泼尼松0.5mg/(kg·d)口服治疗27d,第 2,4,6 月停用激素,予 CTX 0.75 g/m2BSA冲击治疗1次[BSA=0.006 1×身高(m)+0.012 8×体重(kg)-0.152 9]。治疗期间并发严重感染者或出现肝功能异常(谷丙或谷草转氨酶超过正常值上限2倍者),暂停MP或CTX冲击,待感染控制或肝酶恢复2周后继续使用;如出现外周血白细胞降低<3×109/L,暂缓行CTX冲击治疗,待白细胞恢复>4×109/L再行冲击治疗。治疗过程中因各种因素停药超过两周者,退出观察。
对照组为服用缬沙坦160mg/d,如出现低血压或SCr升高>50%,则减少至80mg/d,如仍有低血压,SCr不恢复,则退出观察。
其他治疗 如有高血压,治疗组首选钙离子拮抗剂控制血压于120/80 mmHg,禁用血管紧张素抑制剂/血管紧张素受体拮抗剂(ACEI/ARB),对照组如血压控制不佳可加用钙离子拮抗剂等,禁用ACEI;水肿明显者,可加用利尿剂;严重高脂血症者,可加用他汀类药物。
随访及观测指标
随访观察 治疗6月期间每月随访1次,观察病情变化、记录不良反应,并进行实验室检查。
实验室检查 24h尿蛋白定量,基线及每个随访点均连续测定2次,取其平均值,在留取24h尿前3日内正常饮食,禁用利尿剂及输注白蛋白。
疗效观察 基线和6月治疗期间每月尿蛋白定量水平、血浆蛋白、肝功能、SCr、血糖、血脂、尿沉渣红细胞计数。
不良事件 详细记录治疗过程中的各种不良反应,如感染、胃肠道反应、肾功能损害、肝功能损害、血液系统损害等,谷丙转氨酶或谷草转氨酶超过正常值上限2倍者定义为转氨酶升高。
疗效评价 完全缓解(CR):尿蛋白定量<0.4 g/d,血清白蛋白>35 g/L,肾功能稳定(血清肌酐升高小于基础值15%)。部分缓解(PR):24h尿蛋白定量下降超过基础值50%,且≤3.5 g/d,肾功能稳定。无效(NR):尿蛋白下降小于基础值50%,或24h尿蛋白定量>3.5 g/d,或SCr上升超过50%。
有效率=完全缓解率+部分缓解率
统计学方法 检测数据采用SPSS 13.0统计软件处理,定量数据以均数±标准差表示。组间比较采用t检验。计数资料以例数(百分率)表示,组间比较采用χ2检验,治疗随访结果以PR为观察终点,以Kaplan-Meier生存曲线表示,组间比较采用log-rank检验。P<0.05为差异有统计学意义,P<0.01为统计学差异显著。
结 果
一般情况 共有59例IMN患者入选,其中男47例,女12例。随机进入改良Ponticelli方案治疗组29例,对照组30例。治疗过程中治疗组有3例退出:1例治疗1月已达PR时因并发肺部感染退出,其余2例,分别在治疗第3和第4月因未缓解,自行停药退出,共26例患者完成6月随访;对照组有3例患者退出,1例因血压低退出,另2例分别在第2,3月因无效自行退出,共27例患者完成6月随访观察,两组退出病例均视为无效纳入统计(图1)。
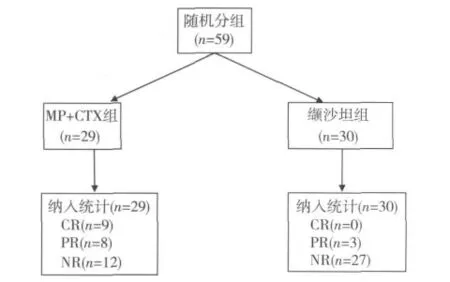
图1 膜性肾病临床分组及随访结果
两组患者在男女比例、平均年龄、中位病程、尿蛋白定量、SCr、胆固醇均无显著差异,而MP+CTX组血清白蛋白则明显低于对照组(表1)。病理上,两组在肾小球硬化,肾小管间质病变比例及程度均无明显差别。

表1 两组膜性肾病患者临床资料比较
疗效 治疗3月,治疗组4例(13.8%)CR,12例(41.4%)PR,有效率55.2%;对照组3例(10%)PR,无一例患者达到 CR,有效率10%(55.2%vs 10%,P<0.05)。治疗6月,治疗组9例(31.0%)CR,8例(27.6%)PR,有效率58.6%;对照组仍是3例(10%)PR,无一例患者达到 CR,有效率10%(56.8%vs 10%,P<0.05)(图2)。两组平均 PR时间为MP+CTX组3.50月,对照组5.59月,具有统计学差异(95%置信区间MP+CTX组vs对照组2.49~4.21 vs 5.15~6.03月,P<0.01)。治疗组患者治疗后尿蛋白水平、血清胆固醇水平明显下降,血白蛋白水平明显上升,SCr空腹血糖水平无明显变化,而对照组治疗后尿蛋白、血清胆固醇,空腹血糖水平无明显变化,而SCR及白蛋白水平均明显上升(表2,图3)。
不良反应 治疗组有3例患者静脉冲击CTX时出现恶心、呕吐等胃肠不适症状,经对症治疗后症状均可缓解,4例患者出现血清谷丙转氨酶(ALT)升高,予暂停MP、CTX冲击及保肝治疗,肝酶均在2周内恢复正常,1例出现空腹血糖轻度升高,予饮食控制血糖降至正常,1例患者在治疗1月后并发肺部感染退出治疗,1例在治疗3月后出现SCr升高>50%;对照组有2例出现低血压,其中1例退出,另1例缬沙坦减量后血压正常,4例出现SCr升高>50%,其中2例出现SCr倍增,缬沙坦减量后SCr均可恢复(表3)。
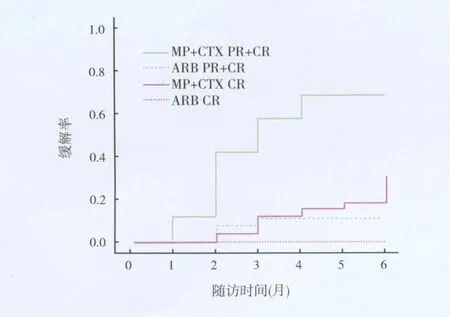
图2 MP+CTX组及对照组治疗6月缓解率对比

图3 两组患者治疗过程中尿蛋白和血清白蛋白变化

表2 两组患者治疗前后主要实验室检查指标变化
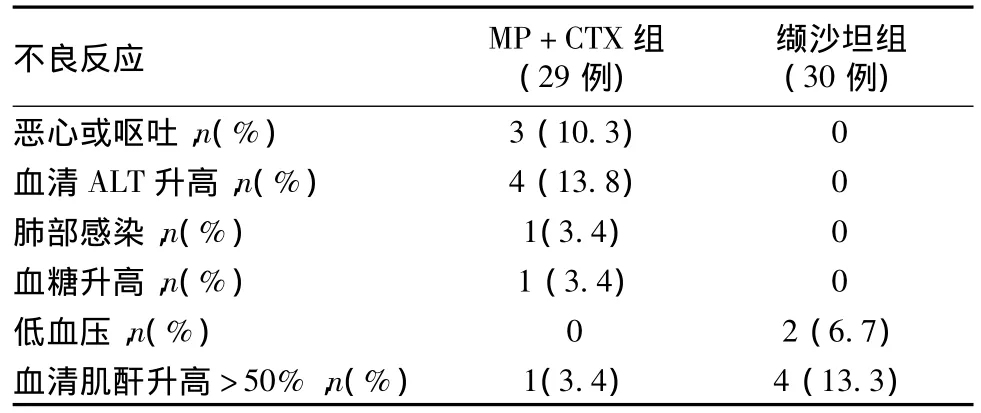
表3 两组患者治疗过程中不良反应比较
讨 论
上世纪八十年代,意大利学者Ponticelli首次将激素联合氮介交替6月方案用于IMN的治疗,该疗法疗效随后得到许多 RCT研究证实[4-6],并且10年长期随访结果表明激素联合氮介交替治疗方案可明显改善IMN患者预后[7],接受该治疗患者10年后仍有61%缓解率(其中40%CR),92%患者肾功能正常,而对照组患者仅33%缓解率(其中5%CR),60%患者肾功能维持正常。由于氮介治疗不良反应较大,1998年Ponticelli等[8]将 CTX替代氮介用于IMN治疗发现,CTX组患者缓解率不比氮介低,且不良反应明显低于氮介,长期随访激素联合CTX交替治疗方案也可明显改善IMN预后。由于该治疗方案是目前IMN的所有治疗拥有最多RCT证据的方案,因此在2011年KDIGO制定特发性膜性肾病治疗指南推荐为临床表现为肾病综合征IMN患者首选治疗方案。
虽然该治疗方案已被证实具有良好治疗效果,但由于在短期内(6月)使用大剂量MP冲击,总量达9g,CTX口服剂量累积>10g,并且在既往欧美RCT研究中发现其不良反应仍很常见,包括感染,白细胞减少,生殖腺毒性作用,脱发,出血性膀胱炎,诱发肿瘤等,此外,Ponticelli的激素和CTX交替使用6月方案疗法是否合适亚洲人群尚无相关文献报道。Eriguchi等[9]曾提出Ponticelli疗法使用大剂量激素冲击及口服CTX剂量过大,不适合日本患者应用。目前国内包括亚洲及欧美大部分国家使用的激素联合CTX疗法均为长期口服治疗,剂量疗程无统一标准,且均非为RCT研究,因此很难对这些治疗方案疗效,安全性作出准确评价[10-13]。
Ponticelli疗法虽为目前获 RCT证据最多的IMN治疗方案,但考虑到本疗法只基于对欧美白种人群的研究,为减少Ponticelli疗法可能对汉族患者的不良反应,本研究将治疗方案中单月甲泼尼龙冲击治疗剂量减少至0.5 g/d连续冲击3d,泼尼松口服剂量不变,双月CTX改为0.75 g/m2BSA静脉冲击治疗,相比原治疗方案,MP冲击剂量减少一半,而CTX累积使用剂量不及原来三分之一。治疗6月后发现,与缬沙坦对照组相比,减少剂量后的激素和CTX交替使用6月疗法完全缓解率和有效率分别达到31.0%和58.6%,明显高于对照组(完全缓解率0,有效率10%),并且治疗组患者尿蛋白水平呈逐月下降,血白蛋白水平呈逐月上升趋势,SCr水平无明显变化,而对照组治疗后尿蛋白、血清胆固醇及SCr水平均无明显变化。与Ponticelli原方案相比,其研究中所有患者平均随访至少1年,6月及12月完全缓解率均<20%,但有效率达50%和70%。本研究改良后激素联合CTX冲击交替治疗方案6月完全缓解率达31.0%,有效率为58.6%,均不低于Ponticelli报道的缓解率。
本研究患者治疗期间治疗组有少数有消化道反应,一过性肝酶升高,空腹血糖升高,通过对症处理,或暂停MP或CTX冲击治疗均可纠正,仅1例并发肺部感染退出,无其他患者因不良反应退出治疗。因此改良后的激素联合CTX冲击交替方案治疗中国IMN患者,虽然MP冲击及CTX使用积累剂量较Ponticelli疗法减少一半,但短期疗效与其接近,不良反应少。亚洲人群基因背景,身高及体重均与欧美人存在差异,减少剂量后激素联合CTX交替治疗同样在本研究患者中取得较好治疗效果,如一味参照Ponticelli方案的剂量治疗,可能会导致更多、更为严重的不良反应。
本研究由于对照组治疗效果不佳,大部分患者在治疗6月后均要求终止继续使用缬沙坦而改用其他免疫抑制剂治疗,因此不能对两组患者长期随访结果进行对比观察,这也是本研究的不足之处。Ponticelli等[8]报道激素联合CTX组患者随访最长时间为72月,平均随访42月,除去治疗退出及失随访患者(未纳入统计),最终随访结果 CR率达50%,有效率达92%,随访过程中有25%患者出现复发,复发时间均在治疗后6月至30月间。2007年Jha等[14]报道Ponticelli疗法治疗IMN患者的10年长期预后,最终随访结果治疗组有效率达72.3%,而对照组(非特异性治疗)仅32.6%,肾脏存活率治疗组为89%,而对照组为65%,随访过程中23.5%患者出现复发,复发时间在第一次缓解后(25.4±6.2)月,提示Ponticelli方案长期疗效良好,但有一定的复发率。改良后Ponticelli方案治疗汉族IMN患者长期疗效及复发情况有待进一步研究观察。
Ponticelli方案是目前在欧美人群获RCT证据最多的IMN治疗方案,本研究为减少原方案可能导致汉族IMN患者的不良反应,将原方案单月MP冲击剂量减少一半,双月CTX改为0.75 g/m2BSA静脉冲击治疗,CTX累积使用剂量不及原方案三分之一。改良后的Ponticelli方案同样获得良好治疗效果,不良反应少,适合汉族IMN患者的诱导期治疗,但需进一步观察该方案长期疗效及复发情况。
1 Ponticelli C,Passerini P.Membranous glomerulonephritis//Massry SG,Glassock RJ,et al.Massry & Glassock's Textbook of Nephrology.4th ed.Philadelphia:Lippineott Williams Wilkins,2001,707 -713.
2 Donadio JV Jr,Torres VE,Velosa JA,et al.Idiopathic membranous nephropathy:the natural history of untreated patients.Kidney Int,1988,33(3):708 -715.
3 Li LS,Liu ZH.Epidemiologic data of renal diseases from a single unit in China:Analysis based on 13,519 renal biopsies.Kidney Int,2004,66(3):920-923.
4 Ponticelli C,Zucchelli P,Imbasciati E,et al.Controlled trial of methylprednisolone and chlorambucil in idiopathic membranous nephropathy.N Engl JMed,1984,310(15):945 -950.
5 Ponticelli C,Zucchelli P,Passerini P,et al.A randomized trial of methylprednisolone and chlorambucil in idiopathic membranous nephrophthy.N Engl JMed,1989,320(10):8 -13.
6 Ponticelli C,Zucchelli P,Passerini P,et al.Methylprednisolone plus chlorambucil as compared with methylprednisolone alone for the treatment of idiopathic membranous nephropathy.N Engl J Med,1992,327(9):599 -603.
7 Ponticelli C,Zucchelli P,Passerini P,et al.A 10-year follow-up of a randomized study with methylpredisolone and chlorambucil in membranous nephropathy.Kidney Int,1995,48(5):1600 -1604.
8 Ponticelli C,Altieri P,Scolari F,et al.A randomized study comparing methylprednisolone plus chorambucil versus methylprednisolone plus cyclophosphamide in idiopathic methylprednisolone plus cyclophosphamide in idiopathic membranous nephropathy.J Am Soc Nephrol,1998,9(3):444 -450.
9 Eriguchi M,Oka H,Mizobuchi T,et al.Long-term outcomes of idiopathic membranous nephropathy in Japanese patients treated with low-dose cyclophosphamide and prednisolone.Nephrol Dial Transplant,2009,24(10):3082 -3088.
10 Yuan J,Fang W,Zhang W,et al.Treatment of nephrotic idiopathic membranous nephropathy with monthly i.v.pulse cyclophosphamide and oral steroids:a single centre's retrospective study.Nephrology(Carlton),2011,16(4):440 -445.
11 Chen M,Li H,Li XY,et al.Tacrolimus combined with corticosteroids in treatment of nephrotic idiopathic membranous nephropathy:a multicenter randomized controlled trial.Am JMed Sci,2010 Mar;339(3):233-238.
12 du Buf-Vereijken PW,Feith GW,Hollander D,et al.Restrictive use of immunosuppressive treatment in patients with idiopathic membranous nephropathy:high renal survival in a large patient cohort.QJM,2004,97(6):353-360.
13 Wetzels JF,Reichert LJ.Efficacy of immunosuppressive treatment in patients with membranous nephropathy and renal insufficiency.Kidney Int Suppl,1997,61:s63 -66.
14 Jha V,GanguliA,Saha TK,et al.A randomized,controlled trial of steroids and cyclophosphamide in adults with nephrotic syndrome caused by idiopathic membranous nephropathy.J Am Soc nephrol,2007,18(6):1899 -1904.
