小鼠mdm2的表达及活性鉴定
2012-11-24王晓杜赵阿勇邓绪芳马志永
王晓杜,赵阿勇,邓绪芳,马志永
(1.浙江农林大学 林业与生物技术学院,浙江 临安311300;2.中国农业科学院 上海兽医研究所,上海200241)
p53(肿瘤抑制因子)是细胞内信号转导网络中最重要的分子,它在细胞周期调控、DNA损伤修复、细胞衰老、细胞凋亡等方面具有重要功能,是最重要的肿瘤抑制因子[1]。p53作为转录激活因子,其活性受到自身修饰的影响,包括磷酸化、泛素化、乙酰化、甲酰化等[2]。mdm2(murine double minute 2,鼠双微体基因-2)作为其主要的泛素化分子,主要功能是调节p53的泛素化和抑制p53转录活性。mdm2分子是一个调节p53泛素化的E3泛素化连接酶[3]。它是由1 476 bp编码的,由491个氨基酸残基组成的蛋白质,其结构包括p53绑定域、锌指结构域、RING结构域、核定位和核输出序列等不同功能域,在调节p53活性方面发挥重要作用[4]。mdm2调节p53活性表现在2个方面:一是增加p53蛋白泛素化以减少其稳定性;二是通过与p53绑定抑制转录活性[5]。细胞内恒量水平的p53发挥维持细胞稳态的作用,而当发生应激时,p53水平明显升高,细胞为了防止其过分升高,建立起了一套调节p53活性的精巧机制,从而使细胞生存下去,mdm2就是这个过程中的主要负性调节因子之一[4]。因此,研究在应激条件下p53的功能,了解p53活性变化机制,建立一个mdm2抑制p53活性的细胞模型是十分重要的手段之一。本研究拟克隆小鼠Mus musculus的mdm2 cDNA,构建重组真核表达载体,并在哺乳动物细胞中表达,验证该蛋白的E3连接酶活性和抑制p53活性的能力,建立mdm2抑制p53活性的细胞模型,为研究mdm2活性、mdm2与p53之间的相互作用和mdm2对p53活性调节等相关研究提供技术手段。
1 材料和方法
1.1 材料
小鼠3T3,H1299细胞株购于中国科学院上海细胞保藏中心。
质粒:p3xFLAG-CMV-7.1,pEGFP-N1-p53由浙江农林大学林业与生物技术学院实验室保存。
常用的酶和试剂:AMV(avian myelobastosis virus,禽骨髓母细胞瘤病毒)反转录酶、PCR(polymerase chain reaction,聚合酶链式反应)扩增用Taq酶购自宝生物公司;lipofectamine 2 000转染试剂购于Invitrogen公司;DMEM (Dulbecco’s modified eagle edium)和胎牛血清购于Gibco公司;ECL(ekectrochemiluminescens)发光试剂盒和BCA (bicinchoninic acid)试剂盒购于Pierce公司;质粒DNA中提试剂盒购于Nucleobond AX公司;Promega’s Steady-GloR萤光素酶检测试剂盒购于Promega公司。
各种抗体:小鼠抗p53单克隆抗体(Do-1),小鼠抗mdm2(SMP-14),小鼠抗FLAG,小鼠抗GFP(green fluorescent protein,绿色荧光蛋白融合单链抗体),小鼠抗β-actin抗体,HRP(horseradish peroxidase,辣根过氧化物酶)标记的羊抗小鼠IgG,HRP标记的羊抗兔IgG,TFITC(fluorescein isothiocyanate,异硫氰酸荧光素)标记的羊抗小鼠IgG等抗体购于Santa Cruz公司。
其他试剂采用国产分析纯试剂。
1.2 方法
1.2.1 基因克隆及重组质粒的构建 刮取单层培养的小鼠3T3细胞样品后,采用Trizol试剂盒提取细胞总核糖核酸(RNA),利用olig(d)T作为反转录引物合成cDNA。以此cDNA为模板,利用引物(Forward:5′-TCTGAATTCGATGTGCAATACCAAC-3′,Reverse: 5′-GCGGTCGACCTAGTTGAAGTAAGTT-3′) 进 行PCR扩增mdm2基因的全长编码区。PCR程序为:94℃5 min;94℃40 s,56℃40 s,72℃ 2min,运行35个循环;72℃10 min;10℃5 min。PCR产物分别用EcoRⅠ和SalⅠ双酶切后,与相应的双酶切p3xFLAG-CMV-7.1载体相连接,转化大肠埃希菌Escherichia coli DH5α。挑取单菌落扩大培养,然后分别用菌落PCR和质粒酶切鉴定阳性克隆,并将阳性克隆送去上海英骏生物公司进行DNA测序。结果表明:获得mdm2的重组真核表达载体p3xFLAG-CMV-7.1-mdm2。
1.2.2 细胞转染与蛋白免疫印迹(Western blotting) 真核表达质粒(p3xFLAG-CMV-7.1-mdm2和pEGFPN1-p53等)转染细胞:取质粒2.0 g和2.0 L脂质体在200.0 L无血清培养基中混匀,室温作用20 min;在六孔板中单层培养的H1299细胞长满后,去掉培养液,PBS(phosphate buffer solution,磷酸盐缓冲溶液)洗涤2次,然后,加入真核表达质粒和脂质体混合液,在37℃培养4~6 h后更换完全培养基,继续培养24 h,然后按照下面方法收集各种细胞样品。
培养细胞样品的制备:去掉培养液,PBS洗涤2次,然后加1.0 mL PBS,用细胞刮铲刮下细胞,收集细胞放入1.5 mL EP(epoxy epoxide,环氧树脂)管中,4℃3 000 r°min-1离心5 min,小心去掉上清,-70℃保存或进行下一步操作。收集的细胞加入适量的裂解液,冰上裂解5 min,超声裂解1~2 s,煮沸5 min,4℃离心10 min,转移上清至新的EP管中。取2.0 L用BCA试剂盒测定总蛋白浓度,加5×上样缓冲溶液煮沸5 min,4℃高速离心10 min,取上清-20℃储存。SDS-PAGE(SDS-polyacrylamide gel electrophoresis,十二烷基硫酸钠-聚丙烯酰胺凝胶)电泳和转印:按照分子克隆实验指南上的方法进行SDSPAGE,上样30.0 μg°样品-1,同时采用彩色预染蛋白质标记(marker)作为指示。电泳完成后,卸下凝胶浸泡在转印缓冲液中,剪下与胶同样大小的NC(nitrocellulose filter membrance,硝酸纤维素膜)膜和滤纸,在转印缓冲液浸泡15~20 min。按照从负极到正极先滤纸—胶—NC膜—滤纸安装好三明治夹心后,放在全湿转印槽中,65 V恒压转印2~3 h。封闭、一抗及二抗处理:转印完毕后,取下NC膜,放在50.0 g°L-1脱脂乳的 TBST(tris-buffered saline Tween-20)溶液(封闭液)中封闭 2 h,用含有 2.0 g°L-1Tween-20 的Tris(三羟甲基氨基甲烷)缓冲液(TBST洗涤缓冲液)洗涤2次(5 min°次-1)。加入1∶4 000稀释的一抗(小鼠抗p53,小鼠抗FLAG,小鼠抗GFP,小鼠抗mdm2等),4℃过夜轻摇振荡。回收一抗后,NC膜用TBST洗涤3次,加入带有HRP标记的羊抗小鼠二抗 (1:10 000稀释),室温反应1 h,TBST洗涤5次。显色:显色利用ECL发光试剂盒在暗室中进行。试剂盒中A液和B液等体积混合后,滴在上述NC膜上,轻微摇动混匀5 min,放入暗盒中,然后压上X光胶片,根据亮度确定曝光时间。曝光完成后,在显影液中显影待条带出现后,放入定影液中定影2~3 min。胶片洗涤晾干后标记蛋白质标记,扫描胶片并进行剪辑。转印(reblotting):上述显完色的膜,加入5.0 mL脱膜缓冲液(reblotting buffer)或Stripping 缓冲液(100 mmol β-mercapto-ethanol,20.0 g°kg-1SDS,62.5 mmol Tris-Cl pH 6.8),55 ℃反应 30 min,TBST洗涤2次后,加入封闭液,然后按照上述过程,更换一抗和二抗,可以进行第2次显色。
1.2.3 间接免疫荧光染色 在盖玻片上培养H1299细胞,转染2.0 g的质粒24 h后,体积分数为4%甲醛 ∶体积分数为10%甲醇(1∶1)混合液固定30 min,PBS洗涤3次,37℃下用体积分数为1%NP40(乙基苯基聚乙二醇)处理30 min,PBS洗涤3次,100.0 g°L-1山羊血清37℃封闭30 min,PBS洗涤3次,1∶100比例稀释的一抗(小鼠抗FLAG抗体)37℃孵育30 min,PBS洗涤3次,羊抗小鼠FITC标记的二抗(1∶500)37℃孵育30 min,TBS洗涤3次,DAPI室温染色10 min,封片剂封片,荧光显微镜下观察目的蛋白表达和亚细胞定位情况。
1.2.4 荧光素酶活性测定 各种试验质粒(pEGFP-N1-p53,p3xFLAG-CMV7.1-mdm2)和p53荧光素酶报告基因质粒(p53-Luc),Rinna质粒(pRL-TK),采用脂质体方法在H1299细胞上进行共转染,24 h后收集细胞样品,然后按照Promega公司双荧光素酶报告系统检测试剂盒的方法,在Modulus多功能检测仪上检测p53的相对荧光素酶活性,对获得数据进行t检验等统计分析。
2 结果与分析
2.1 小鼠mdm2基因的克隆
由于在小鼠3T3细胞中,mdm2的mRNA表达很多,所以本试验以该细胞为材料,提取其总RNA,反转录为cDNA,再以cDNA为模板,以1.1.1中的引物,PCR扩增获得大约1 500 bp的片段(图1),以BamHⅠ和SalⅠ双酶切,把片段亚克隆到p3xFLAG-CMV-7.1真核表达载体上,酶切和测序结果表明:重组真核表达质粒p3xFLAG-CMV-7.1-mdm2构建成功(图1)。所得序列经过NCBI(美国国家生物技术信息中心)上的Blast软件比对,结果表明:本实验所得到mdm2核苷酸序列与NCBI公布的小鼠 mdm2序列(NM_010786)100%同源。

图1 重组表达质粒p3xFLAG-CMV7.1-mdm2的构建Figure 1 Construction of recombinant plasmid p3xFLAG-CMV7.1-mdm2
2.2 小鼠mdm2蛋白真核表达
重组真核表达质粒p3xFLAG-CMV7.1-mdm2和pEGFP-N1-p53转染H1299细胞,采用蛋白免疫印迹(Western blotting)和间接免疫荧光方法检测mdm2的表达和亚细胞定位,分别采用FLAG-vector(p3x-FLAG-CMV-7.1),GFP-vector(pEGFP-N1)作为阴性对照,空载体FLAG-vector表达的FLAG片段太小无法检测到,而GEP-vector能表达大约27 kDa蛋白。实验结果表明:在Western-blotting试验中,用抗FLAG抗体检测FLAG-mdm2,在发现大约60 kDa有一条特异条带(图2),抗p53(Do-1)抗体检测GFP-p53,发现一条大约80 kDa处的特异性条带 (GFP+p53大小为79 kDa)。本试验以GFP-p53蛋白表达作为对照,mdm2蛋白大小与文献报道基本一致[3]。间接免疫荧光检测中,利用小鼠抗FLAG抗体为一抗检测FLAG-mdm2表达和定位,DAPI染细胞核。结果表明:mdm2主要在细胞核中表达(图3)。mdm2蛋白具有核定位序列,这种细胞核定位可能与其绑定和调节p53活性的生理功能密切相关。
2.3 小鼠mdm2蛋白提高p53泛素化水平
mdm2作为E3连接酶,其主要功能体现在促进p53蛋白的泛素化,从而促进p53的降解,所以p53泛素化水平变化是衡量mdm2活性的重要手段。本试验把p3xFLAG-CMV-7.1-mdm2和pEGFPN1-p53质粒按照一定量的比例转染H1299细胞,转染 8 h后添加泛素化酶抑制剂 MG132(10.0 g°mL-1),18 h 后收集细胞样品,以小鼠抗 p53(Do-1)抗体为一抗,Western blotting检测p53泛素化水平。结果表明:在阴性对照中,p53泛素化水平几乎没有变化,这可能与mdm2在正常细胞中表达量低有关,而转染表达mdm2细胞中,不但mdm2表达量较大,p53的泛素化水平也得到提高(图4)。并且随着mdm2表达量的增加,p53泛素化水平逐步增加,表明p53的泛素化对mdm2的表达水平表现出一定的依赖性。

图2 Western blotting检测FLAG-mdm2的表达Figure 2 Expression of recombinant protein FLAG-mdm2 detected by Western blotting
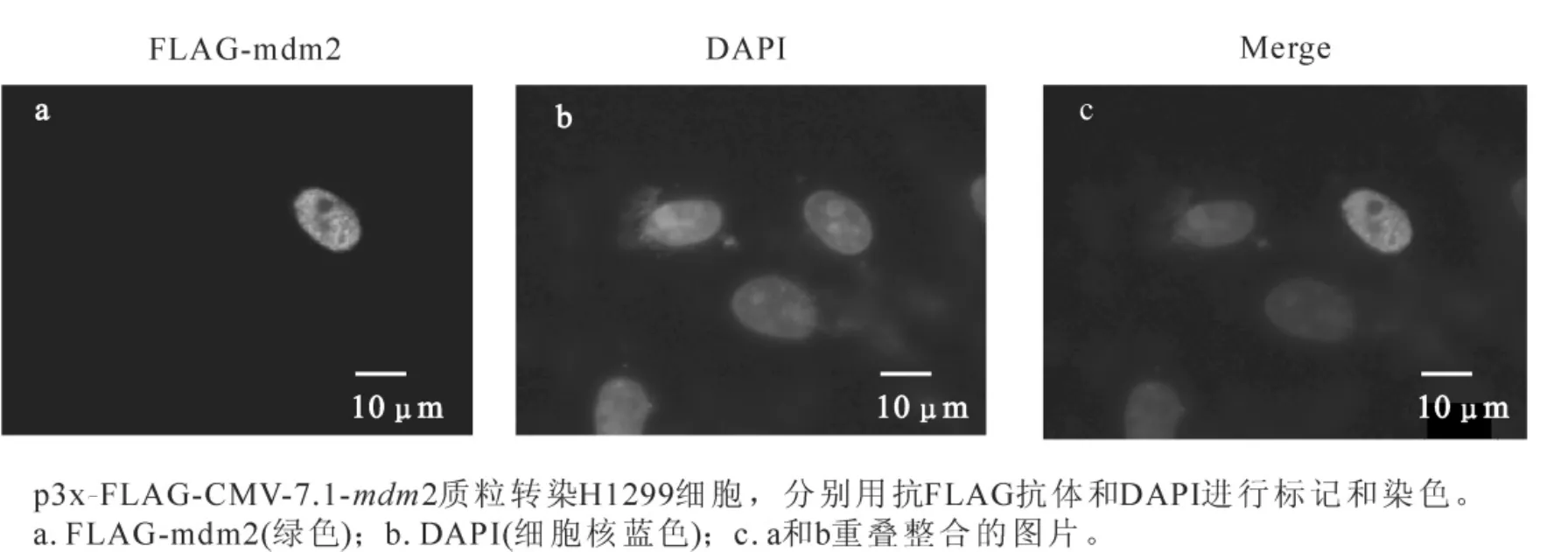
图3 间接免疫荧光检测FLAG-mdm2的表达和亚细胞定位Figure 3 Subcellular localization and expression of FLAG-mdm2 indicated by indirect immunofluorescence
2.4 小鼠mdm2蛋白抑制p53转录活性
mdm2的另一功能是抑制p53蛋白的转录活性,那么采用p53报告基因系统可以检测mdm2调节p53活性的变化,从而判断mdm2是否具有活性。本试验把FLAG-vector(p3xFLAG-CMV-7.1),GFP-vector(pEGFP-N1),pEGFP-N1-p53,p3xFLAG-CMV7.1-mdm2,p53-Luc和内参质粒pRL-TK按照一定比例转染H1299细胞,收集细胞样品后,利用Promega公司的试剂盒检测p53的相对转录活性,结果表明在无mdm2表达时,p53蛋白的转录活性较高,在有mdm2蛋白表达时,p53的转录活性较低(图5),验证了mdm2对p53转录活性的抑制作用。因此,也证明我们克隆表达的鼠mdm2具有完整的生物学功能,建立了mdm2蛋白抑制p53活性的细胞模型。
3 讨论
mdm2在细胞稳态调节中发挥重要作用,正是它的负向调节作用,控制了p53活性过高而损伤细胞。在人类肿瘤疾病中,7%是由于mdm2的过表达造成的,而且在mdm2启动子的309位SNP(single-nucleotide polymorphism)能导致mdm2转录水平增加,从而导致该人群患肿瘤的几率增加[6]。p53蛋白作为转录因子又能促进mdm2的转录和表达,形成一个负反馈调节环[7]。外界因素刺激机体或细胞可以改变它们之间的这种调节机制,打破该平衡之后果就是导致肿瘤的发生或疾病的蔓延与恶化[8]。因此,mdm2可以作为肿瘤治疗的靶标,Nutlin 3a[9],HLI98[10]是与 mdm2 结合的小分子,能够干扰p53和mdm2之间的相互作用,具有治疗肿瘤疾病潜在药物的可能。病原微生物也能打破这种平衡,从而使其能够逃逸机体的先天性免疫机能。如呼吸道合胞病毒[11]、人巨细胞病毒[12]、 流感病毒[13]等病毒能通过干扰 mdm2 和 p53 之间的相互作用调节p53活性,使p53的活性增加,进而使病毒复制免受机体先天性免疫机制的影响。
本研究从小鼠的3T3细胞中克隆了小鼠mdm2 cDNA,并把该基因编码区亚克隆到真核表达质粒上,使重组FLAG-mdm2蛋白在哺乳动物细胞中得以表达,利用间接免疫荧光的方法观测了重组蛋白的亚定位,发现mdm2主要定位在细胞核内,这可能与其参与p53活性调节的功能密切相关。mdm2的活性主要体现在提高p53泛素化水平和抑制p53转录活性[5]。本研究使mdm2和p53共表达,通过检测p53的泛素化水平,发现mdm2能明显提高p53泛素化水平,两者之间具有一定的剂量依赖性。本文还利用报告基因系统验证了mdm2抑制p53相对荧光素酶活性,从而证明本实验成功构建了mdm2抑制p53活性的细胞模型。此模型,将为进一步研究mdm2活性和功能、mdm2与p53相互作用、p53活性位点突变等与p53活性调节的研究提供了工具,同时也为今后研究微生物因子干扰mdm2和p53相互作用,逃逸p53的抗病毒作用[14]和机体先天性免疫[15]相关研究提供了技术手段,为今后开展抗肿瘤药物筛选、病毒致病机理等研究提供基础。

图4 FLAG-mdm2调节p53多泛素化Figure 4 Polyubiquitination of p53 in p3xFLAG-CMV-7.1-mdm2 transfected cells

图5 mdm2抑制p53的转录活性Figure 5 Inhibitory effect of mdm2 on p53-mediated transcriptional activity by luciferase assay
[1]GREEN D R,KROEMER G.Cytoplasmic functions of the tumour suppressor p53 [J].Nature,2009,458: 1127-1130.
[2]BROOKS C L,GU Wei.Ubiquitination,phosphorylation and acetylation: the molecular basis for p53 regulation [J].Curr Opin Cell Biol,2003,15: 164-171.
[3]HAUPT Y,MAYA R,KAZAZ A,et al.Mdm2 promotes the rapid degradation of p53 [J].Nature,1997,387: 296-299.
[4]COUTTS A S,ADAMS C J,LA THANGUE N B.p53 ubiquitination by mdm2: a never ending tail? [J].DNA Repair,2009,8 (4): 483-490.
[5]MOMAND J,ZAMBETTI G P,OLSON D C,et al.The mdm-2 oncogene product forms a complex with the p53 protein and inhibits p53-mediated trans-activation [J].Cell,1992,69: 1237-1245.
[6]BOND G L,HU Wenwei,BOND E E,et al.A single nucleotide polymorphism in the mdm2 promoter attenuates the p53 tumor suppressor pathway and accelerates tumor formation in humans [J].Cell,2004,119: 591-602.
[7]PICKSLEY S M,LANE D P.The p53-mdm2 autoregulatory feedback loop: a paradigm for the regulation of growth control by p53? [J].BioEssays,1993,15: 689-690.
[8]LUKASHCHUK N,VOUSDEN K H.Ubiquitination and degradation of mutant p53 [J].Mol Cell Biol,2007,27: 8284-8295.
[9]VASSILEV L T,VU B T,GRAVES B,et al.In vivo activation of the p53 pathway by small-molecule antagonists of mdm2 [J].Science,2004,303: 844-848.
[10]YANG Yiyi,LUDWIG R L,JENSEN J P,et al.Small molecule inhibitors of hdm2 ubiquitin ligase activity stabilize and activate p53 in cells [J].Cancer Cell,2005,7: 547-559.
[11]ECKARDT-MICHEL J,LOREK M,BAXMANN D.The fusion protein of respiratory syncytial virus triggers p53-dependent apoptosis [J].J Virol,2008,82 (7): 3236-3249.
[12]CHEN Zhenping,KNUTSON E,WANG Shuo,et al.Stabilization of p53 in human cytomegalovirus-initiated cells is associated with sequestration of hdm2 and decreased p53 ubiquitination [J].J Biol Chem,2007,282: 29284-29295.
[13]TURPIN E,LUKE K,JONES J,et al.Influenza virus infection increases p53 activity: role of p53 in cell death and viral replication [J].J Virol,2005,79 (14): 8802-8811.
[14]MUNOZ-FONTELA C,GARCIA M A,GARCIA-CAO I,et al.Resistance to viral infection of super p53 mice [J].Oncogene,2005,24: 3059-3062.
[15]TAKAOKA A,HAYAKAWA S,YANAI H,et al.Integration of interferon-α/β signaling to p53 responses in tumour suppression and antiviral defence [J].Nature,2003,424: 516-523.
