牛新孢子虫内标多重PCR检测方法的试验
2012-11-23唐慧芬季新成于学辉
唐慧芬,季新成,于学辉
(1.石河子大学生命科学学院,新疆 石河子832000;2.新疆出入境检验检疫局,新疆 乌鲁木齐830063)
新孢子虫病(Neosporasis)是犬新孢子虫(Neosporacaninum,N.caninum)寄生于宿主体内引起的一种机会性原虫病,牛、羊、马、鹿等均可作为中间宿主,终末宿主是犬,虽然该病可引起多种家畜共患,但对牛的危害更大,主要造成怀孕母牛流产、产死胎以及新生儿的运动神经系统疾病。该病呈世界性分布,给畜牧业造成了严重的危害[1-2],我国也有该病发生的报道[3]。迄今为止,还没有防治新孢子虫病的有效药物和疫苗,高效快速的检测方法对于该病的防控至关重要。PCR方法具有快速、灵敏、高效等优点,已有很多采用该方法检测此病的报道[2,4],但都是针对单个基因的检测,且没有对反应体系进行质量监控。多重PCR是在常规PCR基础上改进并发展起来的一种技术,在一个反应管中使用多对引物,实现对多个基因的同步检测[5],克服了单基因检测可能造成漏检的弊端。本试验以牛新孢子虫基因组中保守的NcSAG1基因、Nc-5基因和NcSRS2基因同时作为检测的目的基因,并以牛性腺基因(prolactin)作为内标,在实现多基因检测的同时,通过内标引物对反应体系进行监测,为牛新孢子虫病的快速检测提供更为准确的方法。
1 材料与方法
1.1 阳性核酸、样品及相关对照 犬新孢子虫阳性核酸,由中国农业大学动物医学院刘群教授惠赠;牛抗凝全血和流产胎儿组织等样品,采自新疆不同牛场;牛疱疹病毒I型等病原阳性核酸,由新疆出入境检验检疫局技术中心实验室保存。
1.2 主要试剂TaqDNA 聚合酶(5U/μL)、DL-2 000DNA Marker、限制性内切酶EcoRⅠ等,购自宝生物工程(大连)有限公司;琼脂糖凝胶DNA回收试剂盒、高纯质粒小量制备试剂盒、全血基因组DNA提取试剂盒和DNA zol,购自百泰克生物技术(北京)有限公司;PGM-T载体,购自天根生化科技(北京)有限公司;引物由上海生工生物有限公司合成。
1.3 引物的设计与合成 根据NcSAG1基因、NC-5基因和NcSRS2基因以及prolactin基因,各设计一对特异性引物,扩增的目的片段长度分别为201 bp、231bp、256bp和156bp。基因名称及引物序列见表1。
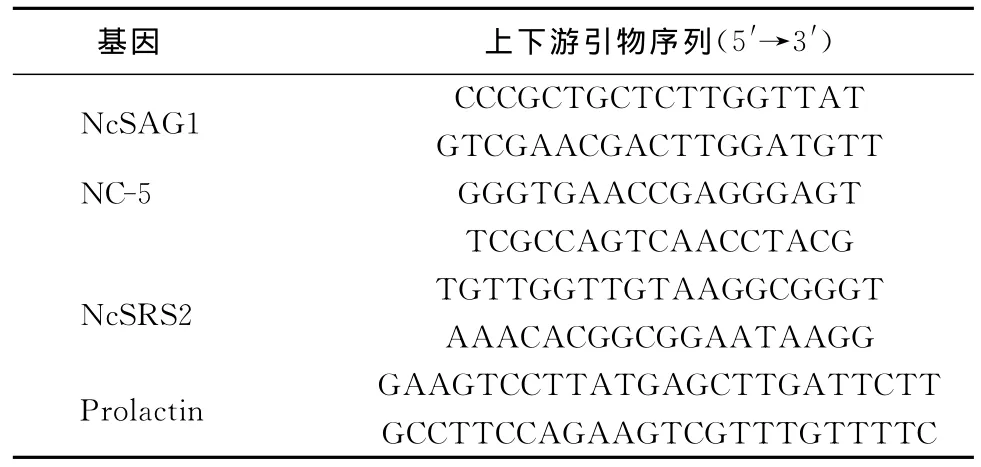
表1 基因名称及引物序列
1.4 模板DNA的制备 抗凝全血按照全血基因组DNA提取试剂盒说明书进行操作;流产胎儿组织先经液氮研磨,然后按照DNA zol基因组DNA快速提取试剂盒说明书进行操作。DNA溶于50 μL TE溶液中,于-20℃保存备用。
1.5 单重PCR反应的优化 采用25μL反应体系:dNTP 终浓度分别为 1.0,1.5,2.0 和 2.5 mmol/L,引物终浓度分别为0.2,0.4,0.6和0.8 μmol/L,Mg2+终浓度分别为1.0,1.5,2.0和2.5 mmol/L,TaqDNA 聚合酶终浓度分别为 0.75,1.0,1.25和1.5U,退火温度分别为56℃,58℃和61℃,循环参数分别为30,35和40,优化一项时其他参数不变。收集PCR产物用1.0%琼脂糖凝胶电泳观察结果。
1.6 单重PCR扩增产物的克隆和鉴定 将目的基因用琼脂糖凝胶DNA回收试剂盒纯化,与PGM-T载体连接,转化至E.coliDH5α感受态细胞中,制备阳性重组质粒。
1.7 单重PCR灵敏度试验 将阳性重组质粒的浓度进行10倍梯度稀释,以1010、109、108、107、106、105、104、103、102、101copies/μL 作为标准品模板。取109~101copies/μL按1.5优化出的最佳条件进行扩增,以验证本方法的灵敏度。
1.8 多重PCR反应的优化 在单重PCR最佳反应条件的前提下,于一个反应管中用4对引物同时进行PCR扩增,同1.5进行反应条件的优化,收集PCR产物用2.0%琼脂糖凝胶电泳观察结果。
1.9 多重PCR反应的特异性 分别对牛疱疹病毒I型等核酸进行多重PCR扩增。每次扩增反应同时,设双蒸水作阴性对照和牛新孢子虫与牛基因组混合物作阳性对照,以检测方法的特异性。
1.10 多重PCR共扩增反应的灵敏度检测 将等量的内标基因与目的基因同步10倍梯度稀释后作为模板加入反应体系,检测共扩增对反应灵敏度。
1.11 内标模板对多重PCR反应灵敏度的影响固定Prolactin重组质粒浓度为109copies/反应不变,与各系列梯度稀释的目的基因进行共扩增,验证高浓度内标基因的存在是否会影响目的基因扩增的灵敏度。
1.12 重复性试验 以新孢子虫全基因组为模板,用优化好的多重PCR方法进行3次重复检测,以验证其稳定性。
1.13 临床样品的检测 应用所建立的多重PCR方法对采自新疆不同牛场的样品进行检测。
2 结果
2.1 单重PCR反应及优化结果 优化后的单重PCR反应体系为:dNTP终浓度1.5mmol/L,引物终浓度0.4μmol/L,Mg2+终浓度1.5mmol/L,TaqDNA聚合酶终浓度1.0IU,反应体积为25μL;扩增条件为:95℃,5min;95℃,30s,58℃,20s,72℃30s,30个循环;最后经72℃延伸10min。扩增出大小为156bp、201bp、231bp和256bp的电泳条带,与目的片段相符,见图1。
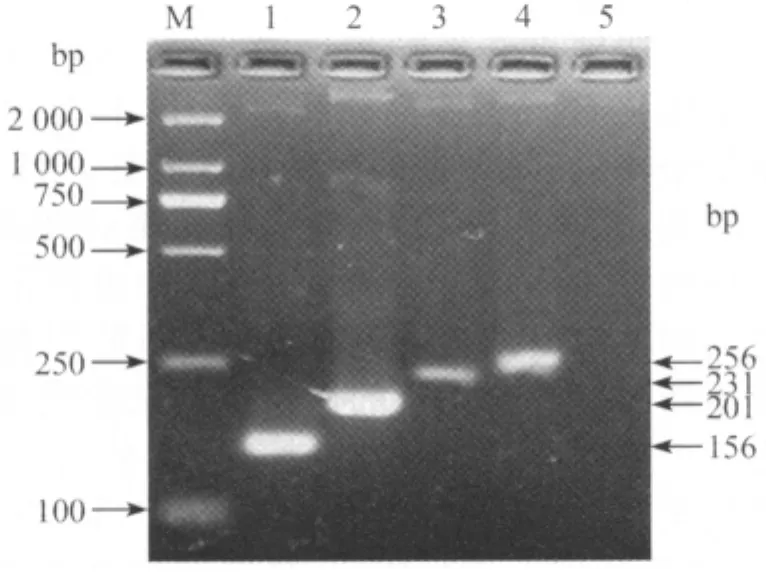
图1 各引物PCR扩增结果
2.2 单重PCR灵敏度试验 用优化后的反应条件分别对10倍梯度稀释的4种重组质粒(109~101copies/μL)进行扩增,最低检测限均为102copies/反应,以NcSRS2重组质粒的灵敏度为例,见图2。

图2 NcSRS2灵敏度试验结果
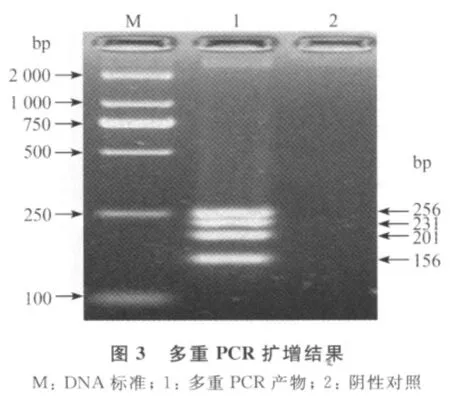
2.3 多重PCR反应及优化结果 优化后的多重PCR反应体系为:dNTP终浓度2.0mmol/L,引物的终浓度为0.6μmol/L,Mg2+终浓度2.0mmol/L,TaqDNA聚合酶终浓度1.25U,反应体积为25μL;扩增条件为:95,5min;95℃,30s,58℃,30s,72℃1min,35个循环;最后经72℃延伸10min。在同一反应管中分别扩增出大小为156bp、201bp、231bp和256 bp的电泳条带,与目的片段相符,见图3。
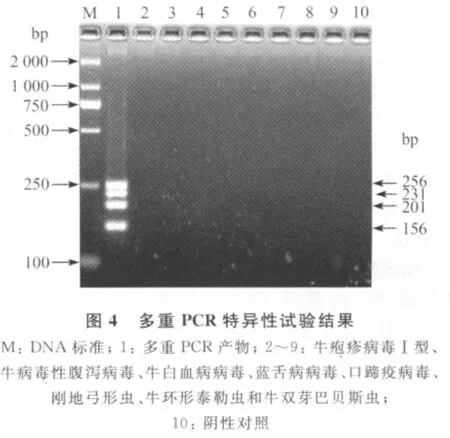
2.4 多重PCR特异性试验 应用多重PCR方法对各核酸进行扩增,结果只在prolactin与犬新孢子虫核酸混合物中扩增出大小为156bp、201bp、231 bp和256bp的特异性条带,而其他样品均未出现扩增条带,说明该方法具有较强的特异性,见图4。
2.5 多重PCR共扩增灵敏度试验 将等量的4种重组质粒按10倍梯度稀释混合后作为模板,采用多重PCR方法进行共扩增,结果显示当质粒浓度均为103copies/反应时,各基因均可扩增出目的条带,说明各基因间没有产生明显的抑制,见图5。

2.6 内标对多重PCR反应灵敏度的影响 固定Prolactin重组质粒的浓度为109copies/反应,分别与10倍梯度稀释的3种目的基因的重组质粒(109~101copies/反应)的混合物共同作为模板,采用多重PCR方法进行扩增,对各目的基因的检测灵敏度仍为103copies/反应,说明内标基因存在对目的基因的扩增影响较小,见图6。
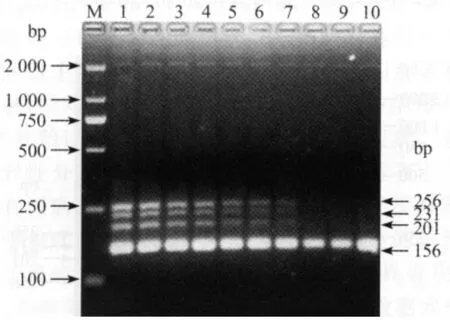
图6 多重PCR检测灵敏度
2.7 重复性试验 用所建立的多重PCR方法,以牛新孢子虫全基因组为模板进行3次重复检测,均可扩增出特异片段,图略。
2.8 临床样品检测 利用所建立的多重PCR方法对来自新疆不同牛场的50份流产牛全血和8份流产胎儿样品进行检测。结果显示,3份流产牛全血和1份流产胎儿样品呈阳性。
3 讨论
NcSAG1基因是编码新孢子虫主要表面抗原蛋白NcSAG1的基因,存在于速殖子中,与弓形虫上的同位基因同源性很低[6];NcSRS2基因是犬新孢子虫一种重要功能基因,在刚地弓形虫基因组中不存在[7],其编码的NcSRS2蛋白存在于致密颗粒棒状体内以及速殖子表面;而重复序列Nc-5基因仅存在于犬新孢子虫基因组中[8]。将3个不同基因作为目的片段,只要出现其中任1个至3个目的条带即可判断为阳性,避免了因某一种基因发生变异导致的单重PCR检测出现假阴性的结果,增加了检测结果的准确性。
研究表明,临床样品中含有的大量复杂未知成分和核酸抽提过程中残留的试剂可能抑制PCR扩增,包括提取过程中核酸的丢失,这些情况都会导致假阴性结果。本试验以牛病为研究对象,故将牛性腺基因引入作为内标,同步参与核酸提取和反应扩增,可对整个检测过程进行质量监控。为了避免检测过程中基因组DNA片段的降解,内标基因常选择较短的目的序列。只有在内标基因正常扩增的前提下,出现3个目的基因中的任何1种到3种,结果均真实可靠。若没有任何扩增条带,说明核酸可能丢失或含有PCR抑制物质。
多重PCR的影响因子比较复杂[9],当在同一反应体系中存在多对引物时,PCR的灵敏度会降低[10],这可能与多对引物间更容易形成二聚体有关,故引物的设计是关键。本试验设计的每条引物之间几乎不存在交叉反应,且退火温度比较相近,保证了在相同条件下目的片段都能得到有效扩增,4种目的片段之间至少相差20bp,能够在2.0%的琼脂糖凝胶电泳检测中明显区分。多重PCR各引物间的相对浓度也会影响扩增效果,很多研究都对此进行了优化[11]。但实际检测过程中,样品里各模板含量是未知的,即如果某种模板含量高,则扩增条带相对较亮,反之则较弱,调整引物间相对终浓度对于临床检测意义不大。更重要的是,如果固定了每对引物间的相对终浓度,那么每当有新的引物加入时都要重新对其进行大量的优化。本试验把所有引物看成一个整体,通过将退火时间延长至30s、延伸时间延长至1min,并对 Mg2+浓度、dNTP浓度等在单重PCR基础上进行优化,最终在每对引物按等浓度加入时,各目的基因均能达到一致的扩增效果,且操作更为简便,这可能与延长退火时间可以增加引物与模板结合的机会有关。考虑到临床应用中,牛性腺基因存在的稳定性和被检目的基因的不确定性,本试验将较高浓度的内标基因与系列稀释的目的基因进行共扩增,未见对灵敏度产生明显影响。
本试验所建立的牛新孢子虫病多重PCR检测方法的灵敏度与单重PCR相比,只低了10倍,且具有较好的特异性和可重复性,既能对反应过程进行质量控制,又能达到快速、准确检测的目的。
[1]徐晓芳,邢沈阳,李建华,等.新孢子虫病检测方法研究进展[J].中国病原生物学杂志,2011,6(4):311-314.
[2]岳韬,秦建华.奶牛新孢子虫病PCR检测方法的建立[J].中国兽医学报,2008,28(4):386-389.
[3]王常汉,季新成,杨帆,等.新疆地区流产奶牛新孢子虫病和布氏杆菌病的流行学调查[J].新疆农业科学,2009,3:657-660.
[4]蔡锦顺,鲁承,王彦方,等.牛新孢子虫病PCR检测方法的建立和应用[J].中国预防兽医学报,2007,29(4):312-315.
[5]陶生策,张治平,张先恩.PCR技术研究进展[J].生物工程进展,2001,21(4):26-29.
[6]金超,贾立军,曹世诺,等.牛新孢子虫病LAMP检测方法的建立[J].中国兽医科学,2009,39(12):1084-1088.
[7]翟延庆,李利,王春仁.新孢子虫NcSRS2基因的克隆和亚克隆[J].黑龙江畜牧兽医,2008,4:68-69.
[8]Andreas L,Chryssafidis,Rodrigo M,etal.Evidence of congenital transmission of Neospora caninum in naturally infected water buffalo(Bubalus bubalis)fetus from Brazil[J].Parasitology Research,2011,108(3):741-743.
[9]刘志杰,李儒举,曾智勇,等.多重PCR反应的影响因素及其优化[J].黑龙江畜牧兽医,2011,7:26-28.
[10]Jeyasekaran G,Raj K T,Shakila R J,etal.Multiplex polymerase chain reaction-based assay for the specific detection of toxin-producing Vibrio cholerae in fish and fishery products[J].Applied Microbiology and Biotechnology,2011,90(3):1111-1118.
[11]孙黎,郭抗抗,王静,等.猪细小病毒、伪狂犬病病毒和猪圆环病毒2型多重PCR检测方法的建立及应用[J].动物医学进展,2011,32(8):25-31.
