重庆地区雏鹅暴发鸭病毒性肝炎
2012-11-23甘艳君陈思怀何洪章郎静宇李继祥
唐 妤,甘艳君,陈思怀,何洪章,郎静宇,李继祥
(1.西南大学荣昌校区动物医学系,重庆 荣昌402460;2.重庆永健生物技术有限公司,重庆 荣昌402460)
鸭病毒性肝炎(duck virus hepatitis,DVH)是一种传播迅速并对雏鸭具有高度致死性病毒病,以肝炎为主要特征。本病可由3种不同类型的鸭肝炎病毒(duck hepatitis virus,DHV)引起,即DHV-1、DHV-2和 DHV-3[1]。依据3D 基因(RNA 依赖性RNA聚合酶,RdRp)的核苷酸序列,DHV-2和DHV-3现已被归为星状病毒科(Astroviridae)的成员[2],但在台湾和韩国发现新型 DHV(new duck hepatitis virus,NDHV)。NDHV与DHV-1有相似的基因组结构、VP1基因的核苷酸和氨基酸序列相似性分别在71%和77%以下,无抗原相关性[4]。台湾和韩国NDHV在核苷酸和氨基酸水平上的相似性分别为71%~72%和77%~78%[4]。DHV-1、台湾NDHV和韩国NDHV分别被命名为DHVA、DHV-B和 DHV-C,其中 DHV-B仅台湾有病例报告,DHV-C目前仅发生于中国大陆与韩国[5]。2010年12月,重庆地区某些养鹅场的雏鹅疑似暴发鸭病毒性肝炎,经RT-PCR检测鸭肝炎病毒VP1基因、病毒分离鉴定及动物试验确诊为雏鹅暴发鸭病毒性肝炎。
1 材料与方法
1.1 临床诊断 2010年12月,重庆地区某些养鹅场的3~14日龄雏鹅疑似暴发鸭病毒性肝炎,发病率20%~30%,死亡率在20%~25%。病鹅表现为蹲伏,嗜睡,侧卧,两腿痉挛性后踢,头向后背呈现角弓反张,在出现症状后1~2h内死亡。死亡鹅的主要病变在肝脏,表现为肿大、有点状或瘀斑状出血。抗生素治疗无效,抗DHV-A和DHV-C二价抗体紧急预防注射能显著降低发病率和死亡率。
1.2 病料采集与处理 采集具有典型临床症状和病理变化的5日龄病死鹅肝脏,剪碎后按组织重量1∶4(W/V)加入灭菌生理盐水,高速匀浆制成肝组织乳剂,于-40℃反复冻融3次;加入氯仿(终浓度为5%),室温下振荡15min;5 000r/min(4℃)离心15min;上清液经微孔滤膜过滤除菌后备用。
1.3 病毒分离与纯化 将肝组织处理液用含双抗(青霉素、链霉素各300IU(μg)/mL)的生理盐水10倍稀释,经尿囊腔接种10日龄易感鸭胚(重庆永健生物技术有限公司提供),每胚0.2mL,37℃培养7 d,记录死胚情况。收集48~96h死亡鸭胚的尿囊液,经无菌和支原体检验合格后作为鸭胚毒,-40℃保存备用。
鸭胚毒用含双抗的生理盐水100倍稀释,与鸭肝炎病毒抗血清[抗鸭肝炎病毒Ⅰ型血清(中国兽医药品监察所范书才研究员惠赠),中和效价1∶775,批号:080613;抗鸭肝炎病毒韩国变异型LS株血清,自制,中和效价1∶617],按25∶1(V/V)混合,37℃作用1h;接种10日龄鸭胚,每胚0.2mL;37℃培养7d;收集48~168h死亡鸭胚的尿囊液。经无菌和无支原体检验合格后的尿囊液按上述方法再用抗血清中和1次,收集48h~96h死亡鸭胚的尿囊液即为分离病毒。
1.4 鸭胚中和试验 将鸭肝炎病毒抗血清5倍递进稀释后与200ELD50/0.2mL的病毒液等体积混合,37℃作用1h;经尿囊腔接种10日龄鸭胚,每胚0.2mL;37℃培养,每天照蛋2次,连续观察7d。试验设空白对照和阴性血清对照。鸭胚在37℃孵育观察168h。
1.5 动物试验 6~7日龄健康四川白鹅(重庆永健生物技术有限公司提供)用于动物试验,每只鹅颈部皮下接种1 000ELD50/0.5mL的病毒液,共接种15只。试验设临床病死鹅肝组织处理液对照(0.5 mL/只)和生理盐水对照。各组动物隔离饲养,连续观察7d,记录发病和死亡情况。剖检死亡鸭,观察病理变化,并采集肝组织用于DHV VP1基因检测。
1.6 病毒RNA的提取 按Trizol说明书操作从肝组织处理上清液和鸭胚尿囊液中提取病毒RNA。
1.7 RT-PCR 及测序 扩增 DHV-A 和 DHV-C VP1基因的引物按文献[6]报道的序列合成;扩增DHV-B VP1基因的引物以04G株序列设计,上游引物为B-F:GGGGACACTAACCAGCTTGGTG,下游引物为 B-R:GATGGAGCTCAAACGCCAGGG,由上海英骏生物技术有限公司合成。RTPCR按试剂盒(TaKaRa RNA PCR Kit Ver.3.0)的使用说明进行,其PCR条件为:94℃预变性2 min,在94℃30s、54℃30s、72℃1min进行30个循环,最后在72℃5min。PCR产物经1%琼脂糖电泳,切胶,用胶回收试剂盒(TaKaRa公司产品)回收DNA。纯化的PCR产物与pMD18-T载体进行TA克隆后测序(上海生工生物工程技术服务有限公司)。
1.8 序列分析 将测序结果用DNAStar的MegAlign程序与GenBank中登录的DHV VP1基因参考序列进行进化树分析。
2 结果
2.1 病料中鸭肝炎病毒VP1检测及序列分析 利用RT-PCR从病死鹅肝组织处理液中同时检测到DHV-A和DHV-C病毒的VP1基因,其分别与鸭肝炎病毒C80株(DHV-A型)和C-YCZ株(DHV-C型)的参考序列相似性最高,分别为98.3%和98.7%;DHV-B病毒VP1基因检测为阴性。
2.2 鸭肝炎病毒的分离鉴定 病死鹅肝组织处理液能在48~96h内100%(9/9)致死鸭胚,收集的尿囊液(鸭胚毒)经鸭肝炎病毒抗血清中和2次后获得CQ1和CQ2毒株。CQ1和CQ2株病毒经RTPCR分别检测到DHV-A和DHV-C型病毒的VP1基因,其与病料中检测到的相应VP1基因的核苷酸序列相似性100%。CQ1株和CQ2株病毒VP1基因与16株鸭肝炎病毒VP1基因的进化树分析结果见图1。在鸭胚中和试验中,CQ1株能被抗鸭肝炎病毒Ⅰ型(DHV-A型)血清中和,不被抗鸭肝炎病毒LS株(DHV-C型)血清中和;而CQ2株能被抗鸭肝炎病毒LS株血清中和,不被抗鸭肝炎病毒Ⅰ型血清中和。
2.3 病例复制 6~7日龄试验鹅接种临床病死鹅鹅肝组织处理液、CQ1株和CQ2株病毒后分别在19h、24h和22h开始发病,表现出蹲伏,嗜睡及临死前的角弓反张,死亡率分别为93%、67%和80%。死亡鹅的病理变化主要在肝脏,表现为轻微肿大和出血。接种肝组织处理液的病死鹅肝脏中能检测到DHV-A和DHV-C型病毒的 VP1基因,而接种CQ1和CQ2株病毒死亡鹅分别检测到DHV-A和DHV-C型病毒的VP1基因。
3 讨论
自1949年Levine和Fabricant报道美国长岛的鸭病毒性肝炎病例以来,鸭肝炎病毒在许多国家和地区相继分离出来。近年来,鸭病毒性肝炎的流行病学特征及鸭肝炎病毒的基因型等发生了一定的改变,在我国大陆及台湾有用弱毒疫苗免疫鸭群仍发生典型鸭肝炎的报道[7-8],从台湾和韩国病死鸭中分别分离 DHV-B 型和 DHV-C 型病毒[3-4]。本文利用RT-PCR从疑似暴发鸭病毒性肝炎的同一份病死鹅肝组织中检测到DHV-A和DHV-C型病毒的VP1基因,用鸭胚分离纯化到鸭肝炎病毒CQ1株(DHV-A 型)和 CQ2株(DHV-C型),及 CQ1株和CQ2株病毒人工接种雏鹅均能复制出与临床病例相似的病例。由此可确诊,重庆2010年12月某些鹅场雏鹅暴发的疾病由DHV-A型和DHV-C型病毒混合感染所致。
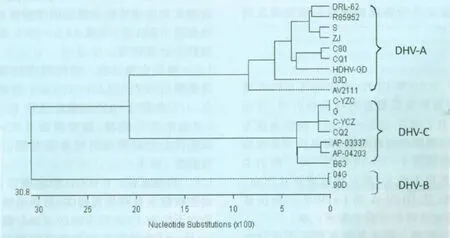
图1 CQ1株和CQ2株病毒与16株鸭肝炎病毒的进化树
鸭肝炎自然病例仅发生于雏鸭,成年种鸭即使在污染的圈舍中也无临床症状,产蛋正常[1]。本文确诊鸭肝炎病毒可自然感染雏鹅发病,其临床症状与病理变化与雏鸭感染后的表现一致,也可导致高发病率和死亡率,给养鹅业带来重要启示。在雏鹅养殖过程,除加强小鹅瘟等疾病的防控外,鸭肝炎病毒感染的危害也不容忽视。在重庆地区有鸭和鹅混养的习惯,尤其是在育雏阶段。本次从病死鹅分离DHV病毒的VP1基因分析发现,与鸭源病毒间的相似性高。由此推测,雏鹅暴发的鸭病毒性肝炎是由混养的患病或带毒鸭传染导致的。
[1]Saif Y M.禽病学[M].苏敬良,高福,索勋,主译.11版.北京:中国农业出版社,2005:376.
[2]Todd D,Smyth V J,Ball N W,etal.Identification of chicken enterovirus-like viruses,duck hepatitis virus type 2and duck hepatitis virus type 3as astroviruses[J].Avian Pathol,2009,38:21-30.
[3]Tseng C H,Knowles N J,Tsai H J.Molecular analysis of type 1duck hepatitis virus indicated that it should be assigned to a new genus[J].Virus Res,2007,123:190-203.
[4]Kim M C,Kwon Y K,Joh S J,etal.Recent Korean isolates of duck hepatitis virus reveal the presence of a new geno-and serotype when compared to duck hepatitis virus type 1type strains[J].Arch Virol,2007,152:2059-2072.
[5]Wang Liyan,Pan Meng,Fu Yu,etal.Classification of duck hepatitis virus into three genotypes based on molecular evolutionary analysis[J].Virus Genes,2008,37:52-59.
[6]何姌娅,于淼,张玉玲,等.2007~2009年华南地区鸭肝炎病毒流行病学调查及分离株的VP1基因变异分析[J].中国动物传染病学报,2010,18(1):7-15.
[7]Yang P P,Song M X,Ai W,etal.Preparation and identification of monoclonal antibodies against duck hepatitis virus[J].Chin J Prev Vet Med,2006,28(2):212-216.
[8]Lu Y S,Lin D F,Lee Y L,etal.Infectious bill atrophy syndrome caused by parvovirus in a co-outbreak with duck viral hepatitis in duckling in Taiwan[J].Exp Rep Tpriah,1993,29:63-70.
