苦参碱对宫颈癌Hela细胞凋亡相关蛋白表达的影响*
2012-11-22西电集团医院妇产科西安710077
西电集团医院妇产科 (西安710077)
王 丽 苏宝山▲ 吴 静▲
近年来体内外大量研究表明,苦参碱(Matrine,Mat)的抗肿瘤作用全面而广泛,但对这些作用机制的研究较少,至今仍不清楚。目前普遍认为,肿瘤的发生是机体组织过度增生与凋亡不足,增生与凋亡失衡的结果。Bcl-2、COX-2、Fas、Fas L蛋白均是细胞凋亡通路中发挥重要作用的分子,与肿瘤发生、发展关系密切,对它们的研究,能更深入的了解肿瘤发生的病因学,并指导肿瘤的临床治疗。研究表明,宫颈癌组织中COX-2、Bcl-2和Fas L均呈高表达,Fas表达下降,肿瘤细胞处于无限增殖状态,发生浸润、转移[1,2]。本实验前期已通过MTT法及流式细胞仪(FCM)检测证实Mat有抑制宫颈癌Hela细胞的增殖,诱导其凋亡作用,在此基础上,进一步用免疫细胞化学法检测 Mat作用宫颈癌 Hela细胞72h后,Hela细胞中Bcl-2、COX-2、Fas、Fas L蛋白的表达水平,初步探讨 Mat抑制宫颈癌Hela细胞的增殖,诱导其凋亡可能的作用机制,为Mat应用于临床肿瘤治疗提供理论依据。
材料和方法
1 材 料
1.1 人宫颈癌Hela细胞株:由西安交通大学医学院癌症研究所惠赠。
1.2 主要试剂:Mat纯度为98%,购自陕西昂盛生物医药科技有限公司;RPMI-1640培养基为美国GIBCO产品;小牛血清(BCS)杭州四季青生物工程材料研究所;SP试剂盒为武汉博士德生物技术公司。鼠抗人Bcl-2单克隆抗体、鼠抗人COX-2单克隆抗体、鼠抗人Fas单克隆抗体、鼠抗人Fas L单克隆抗体均购自美国Santa Cr uz公司产品,北京中山生物技术有限公司分装。
1.3 主要仪器和设备:CO2培养箱(SHEL-LAB型,美国),超净工作台,6孔细胞培养板(美国Costar公司)。
2 方 法
2.1 细胞培养:将宫颈癌Hela细胞用含10%小牛血清(BCS),青霉素100 U/ml,链霉素100μg/ml的RPMI 1640培养基,置于37℃、含5%CO2饱和湿度培养箱孵育传代培养。
2.2 实验方法:将无菌盖玻片(22 mm×22 mm)铺在6孔细胞培养板里,取对数生长期的Hela细胞1×106个/孔接种于已置盖玻片的6孔细胞培养板内,置37℃5%CO2饱度湿度孵箱内培养24h。细胞贴壁后弃去原液,加Mat溶液终浓度分别为1.0 mg/ml,1.5 mg/ml,2.0 mg/ml,对照只加 Hela细胞和培养液,共同培养72h。每个浓度组设3个复孔。取出有贴壁细胞的盖玻片,PBS液漂洗3遍,加入预先4℃保存的冷丙酮固定5 min,风干后贴于载玻片上,免疫细胞化学检测(SP法),检测 Mat作用后Bcl-2、COX-2、Fas和Fas L蛋白表达水平,按试剂盒说明书操作。结果判定:以PBS代替一抗作阴性对照,Fas、Fas L染色阳性为在细胞膜上出现棕黄色颗粒 ,胞质内也有染色,COX-2染色阳性为在细胞质中出现棕黄色颗粒,Bcl-2染色阳性为在细胞质或核膜中出现棕黄色颗粒。每片均随机选取4个高倍视野(400倍),每视野计数100个细胞,算出阳性细胞所占比例。综合考虑爬片中阳性细胞占所观察同类细胞数的百分比和阳性细胞着色强度两项指标,半定量分析判定结果。根据染色强度评分标准:标本无色为0分;淡黄色为1分;棕黄色为2分,棕黑色为3分。根据阳性细胞在观察细胞中所占比例评分,评分标准为:阳性细胞数 ≤10%为1分;11%~50%为2分;51%~75%为3分;大于75%为4分。两类分数乘积0~3分为(-);4~5分为(+ );6~7分为(++);8分以上为(+++ )。每组细胞片检测后以+~+++均为阳性。
2.3 统计学分析 实验数据使用SPSS10.0 for Windows统计学软件进行分析。两组间率的比较用χ2检验,以P<0.05为差异具有统计学意义。
结 果
实验数据经统计学分析,结果显示,对照组中Hela细胞中Fas蛋白表达较低(+),阳性表达率为16.7%,Fas L蛋白呈高表达(+++),表达率为81.0%。1.0、1.5、2.0 mg/ml的Mat分别作用于Hela细胞72h后Fas蛋白表达明显逐渐增加,随着Mat作用剂量增加,Hela细胞内Fas的表达水平增加,阳性率分别为54.2%66.7%和83.3% 与对照组相比,均差异有统计学意义﹙P<0.05﹚,见表1(图1、图2)。1.0、1.5、2.0 mg/ml的Mat分别作用于Hela细胞72h后Fas L蛋白表达逐渐减弱,随着Mat作用剂量增加,Hela细胞内Fas L的表达水平下降,阳性率分别为41.7%、37.5%和29.2%,与对照组相比,均差异有显著意义﹙P<0.05﹚,见表2(图3、图4)。
对照组Hela细胞胞浆呈棕黄色,Bcl-2蛋白呈高表达(+++),阳性表达率为91.7%;1.0、1.5、2.0 mg/ml的Mat作用于Hela细胞72h后Bcl-2蛋白表达逐渐下降,随着Mat作用剂量增加,Hela细胞内Bcl-2蛋白的表达水平下降,阳性率分别为58.3%、50.0%和33.3%,与对照组相比,均差异有统计学意义﹙P<0.05﹚,见表3(图5、图6)。
COX-2在对照组正常培养的Hela细胞胞浆呈深棕色,COX-2蛋白呈高表达(+++),阳性表达率为95.0%;1.0、1.5、2.0 mg/ml的Mat作用于Hela细胞72h后COX-2蛋白表达逐渐下降,随着Mat作用剂量增加,Hela细胞内COX-2蛋白的表达水平下降,阳性率分别为59.1%、45.5%和27.3%,与对照组相比,均差异有统计学意义﹙P<0.05﹚,见表4(图7)。
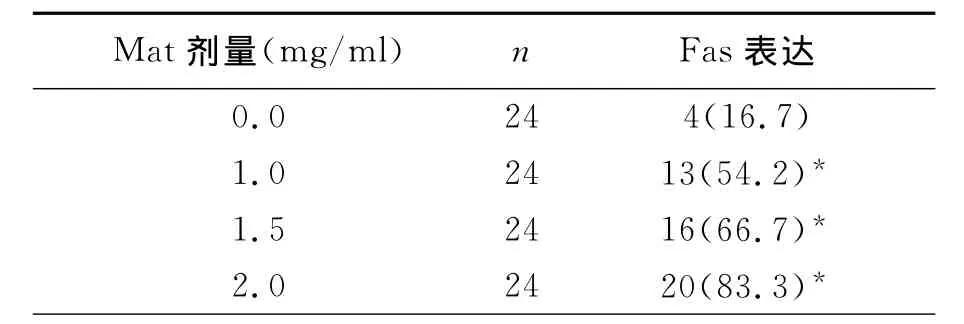
表1 Mat对Hela细胞中Fas蛋白表达的影响(%)
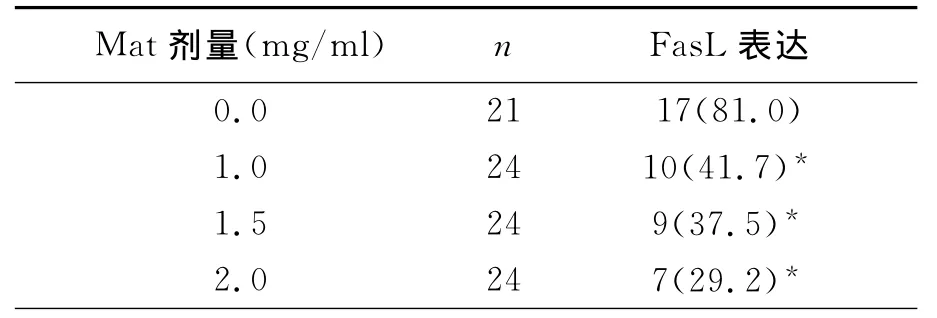
表2 Mat对Hela细胞中Fas L蛋白表达的影响(%)

表3 Mat对Hela细胞中Bcl-2蛋白表达的影响(%)
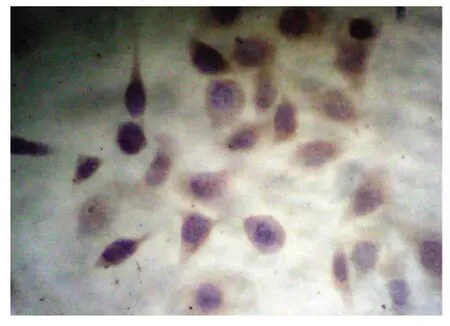
图1 Fas蛋白在对照组中低表达(DAB×400)
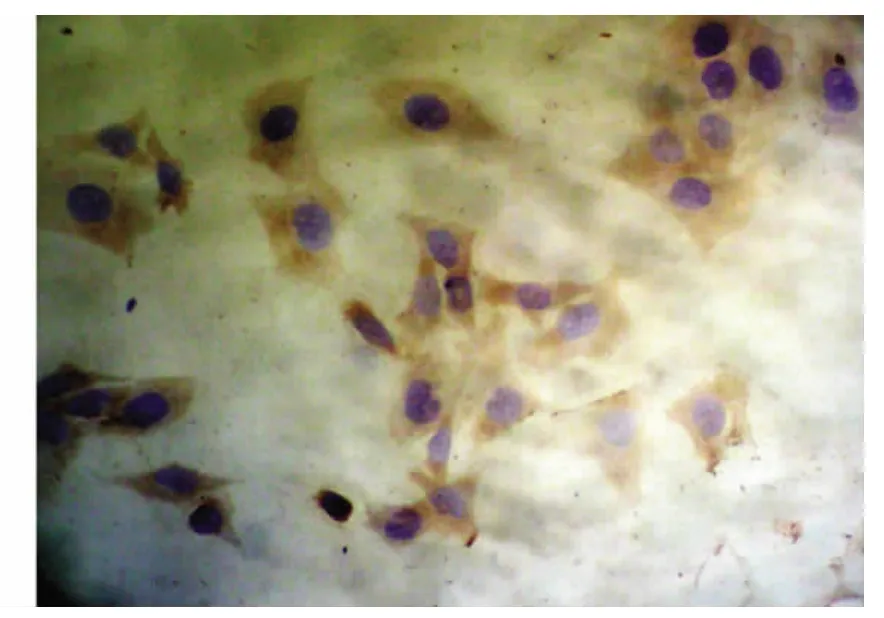
图2 Fas蛋白在苦参碱处理组中高表达(DAB×400)

图3 Fas L蛋白在对照组中高表达(DAB×400)

图4 Fas L蛋白在苦参碱处理组中低表达(DAB×400)

图5 Bcl-2蛋白在对照组中高表达(DAB×400)
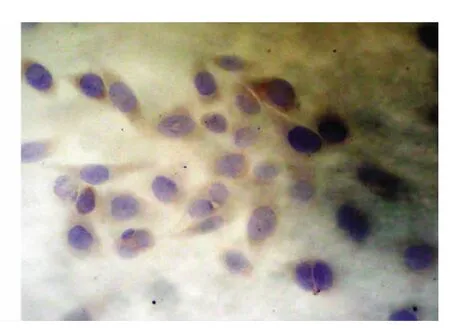
图6 Bcl-2蛋白在苦参碱处理组中低表达(DAB×400)
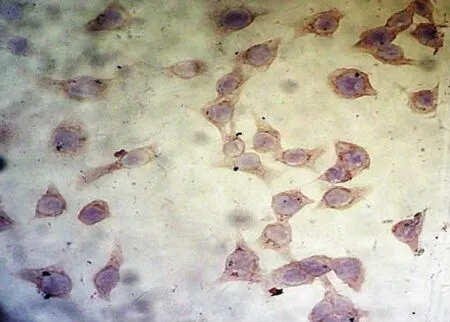
图7 COX-2蛋白在苦参碱处理组中低表达(DAB×400)

表4 Mat对Hela细胞中COX-2蛋白表达的影响(%)
讨 论
细胞凋亡是英国爱丁堡大学Kerr[3]等人于1972年提出的,凋亡是由多基因控制的细胞自主性程序化死亡过程,是机体对异常细胞、衰老细胞或潜在异常增生细胞的一种清除手段。研究表明,细胞凋亡通路较多,主要有三条通路[4],就是死亡受体通路、线粒体通路和内质网通路,三条通路密切关联,均激活不同的Caspase执行细胞凋亡作用。Caspase可降解细胞内结构蛋白、调节蛋白、DNA修复酶等多种蛋白执行凋亡过程。通过调控细胞信号转导系统诱导细胞凋亡来治疗肿瘤已经成为肿瘤学领域研究热点之一。Fas/Fas L介导的细胞凋亡就是通过经典的死亡受体通路。研究认为,肿瘤细胞表达Fas L与肿瘤的免疫逃逸有关。已知T淋巴细胞、B淋巴细胞及自然杀伤细胞表面均有Fas表达,特别是活化的T淋巴细胞Fas表达水平更高,当表达Fas的免疫细胞与表达Fas L的肿瘤细胞结合后,激活Fas/Fas L信号传递途径,引起免疫细胞的凋亡,使得肿瘤细胞逃避免疫杀伤。近年研究发现,多数恶性肿瘤细胞表面,如宫颈癌、卵巢癌、子宫内膜癌等细胞表面均有Fas L表达,诱导表达Fas的淋巴细胞、自然杀伤细胞凋亡,使肿瘤细胞逃避机体的免疫监视,肿瘤细胞对宿主免疫系统有主动攻击作用;而肿瘤细胞Fas表达越高,与自身的Fas L结合,启动细胞凋亡信号转导系统,引起细胞凋亡[5]。
Bcl-2即B细胞淋巴瘤/白血病-2,属于Bcl-2家族成员,定位于18q21.3号染色体,基因全长230kb。Bcl-2家族成员在细胞凋亡的线粒体途径中起重要调控作用。Bcl-2可与Bcl-2家族的Bcl-X1、Bcl-Xs、Bax、Bcl-2、Bad和Mc1-1形成同源或异源的蛋白二聚体形式,二聚体间以网络的形式相互作用,而特定的蛋白二聚体则可作为在细胞死亡信号通路上的分子开关,调控细胞的凋亡[6]。研究发现,早期宫颈癌中,致癌因子引起Bcl-2的过度表达,抑制了细胞凋亡,促使肿瘤的生长;在晚期宫颈癌中,由于多个癌基因和抑癌基因的影响,Bcl-2的表达下降,因此细胞内Bcl-2基因的过度表达可能是宫颈癌的早期事件。
COX是花生四烯酸合成前列腺素(PGs)的关键酶,有两种异构体,其中COX-2是一个重要原癌基因,在正常组织中不表达,可被多种因素如细胞因子、内毒素、致癌因子诱导,通过抑制细胞凋亡、促进细胞增殖、促进肿瘤细胞恶变及转移、尤其促进新生血管形成,影响癌的发生和发展[7]。研究发现敲除COX-2基因可显著减少肠道肿瘤和皮肤乳头状瘤的发生[8]。研究显示,在宫颈癌中COX-2表达显著增高[9]。近年来,针对COX-2为靶点的抗肿瘤治疗研究也越来越多。选择性COX-2抑制剂在肿瘤防治中有广阔前景。
Mat是从豆科槐属植物苦豆子中提取的单一生物碱,化学分子成为作为抗癌中药,大量研究已经证实,Mat有诱导肿瘤细胞凋亡的作用[11]。检测凋亡可通过多种方法,除了细胞形态学观察、流式细胞仪、原位末端标记法测凋亡率外,还可用免疫组织化学法检测凋亡相关蛋白的表达。本实验用免疫细胞化学(SP)法检测了Mat作用宫颈癌Hela细胞72h后凋亡相关蛋白的表达,结果发现抑制凋亡蛋白Bcl-2、COX-2及Fas L表达下降,促凋亡蛋白Fas表达增加,说明Mat下调Bcl-2、COX-2及Fas L表达,增加Fas的表达,可能是其诱导宫颈癌细胞凋亡的机制之一,为靶向治疗宫颈癌提供了新的思路,至于具体详细的机制还有待研究。
[1]张 璇,陈 莉,晓 宵,等.COX-2和NET-1基因蛋白在宫颈癌中表达的意义[J].肿瘤防治研究,2006,33(4):252-255.
[2]朱 青,韩苏夏,李明众,等.放疗前后宫颈癌细胞凋亡及Fas、P53及bcl-2的表达[J].现代肿瘤医学,2006,14(6):730-732.
[3]Kerr JFR,Wyllie AH,Cunie AR.Apoptosis basic biological pheno menon with wide ranging i mplications in tissue kinetics[J].Br J Cancer,26:239-257.
[4]Nakagawa T,Zhu H,Morishi ma N,etal.Caspase-12 mediates endoplas mic-reticulu m-specific apoptosis and cytotoxicity by amyloid-beta[J].Nature,2000,403(6765):98-103.
[5]Kase H,Aoki Y,Tanaka K.Fas ligand expression in cervical adenocarcino ma:relevance to ly mph node metastasis and tu mor progression[J].Gynecol Oncol,2003,90(1):70-74.
[6]Tho madaki H,corilas A.Bcl-2 fa mily of apoptosis-related genes:f unction And clinical i mplications in cancer[J].Crit Rev Clin Lab Sci,2006,43(1):1-67.
[7]吴 永,王和勇,张培德,等.环氧合酶-2在肿瘤浸润合转移中德作用和治疗研究[J].现代生物医学进展,2008,8(8):1580-1583.
[8]Rigas B,Kashfi K.Cancer prevention:A new era beyond COX-2[J].J Phar macol Exp Ther,2005,314:1-8.
[9]Ferrandina G,Ranelletti F O,Legge F,etal.Prognostic role of the radio bet ween cyclooxygenase-2 in tu mor and stro ma co mpart ments in cervical cancer[J].Clin Cancer Res,2004,10(9):3117.
[10]苏丽梅,戴贵东,聂黎红,等.苦参碱对豚鼠离体胆囊平滑肌条收缩功能的影响[J].陕西中医,2010,31(7):916-918.
[11]司维柯,尚桃元,康格非.苦参碱对人肝癌细胞 Hep G2的细胞形态影响和相关增殖因素的变化[J].第三军医大学学报,2000,22(6):553-556.
