对氧磷酶2基因多态性与脑梗死的相关性研究
2012-11-22张慎韬李东芳张华屏裴宇恒刘彩玉
张慎韬,李东芳,张华屏,裴宇恒,连 霞,刘彩玉
对氧磷酶(paraoxonase,PON)是一种有机磷三酯化合物水解酶,该酶可水解、中和导致动脉粥样硬化的特定脂质过氧化物,保护细胞膜不被脂质过氧化物破坏[1]。脑梗死作为一种血栓、动脉粥样硬化相关性疾病,在其发病过程中理论上可因PON2基因突变导致相应酶的功能缺损而加剧脑梗死的进程。近年研究表明,PON2S311C多态性与冠心病[2]、2型糖尿病有关[3],与胃肠疾病相关[4],但与脑梗死的相关性尚无确切定论。本研究旨在了解这一基因多态性在山西汉族人群的分布频率,同时探讨PON2基因多态性是否为脑梗死发病的危险因素。本实验浏览人类单倍体图计划(HapMap)[5],选取PON2标签SNP(tag SNPs)rs17876171单核苷酸多态性位点进行研究,探讨该点突变导致的多态性与脑梗死发病的相关性。
1 资料与方法
1.1 研究对象 收集2010年1月—2011年4月在山西医科大学第二医院神经内科就诊的脑梗死患者及部分健康体检人员的临床资料和外周血标本。对象均为山西地区汉族人,并签署知情同意书。病例组:首发急性脑梗死患者110例,其中男65例,女45例;年龄(58.2±10.5)岁。研究对象均有完整的临床资料,并符合1986年WHO脑卒中诊断标准以及1995年中华医学会全国第四届脑血管病学术会议修订的《各类脑血管疾病诊断要点》,均经头颅MRI+MRA+DWI证实有新鲜的梗死灶及颅内动脉闭塞或狭窄。此外还排除了风湿性心脏病、房颤、感染性心内膜炎等可引起继发性脑栓塞的情况,以及冠心病、心肌缺血、2型糖尿病。正常对照组:同期在我院接受健康体检人群100名,其中男57名,女43名;年龄(56.85±11.33)岁。对照组的年龄、性别与病例组相匹配,并除外颅内、外动脉闭塞性病变、冠心病、心肌梗死、糖尿病等。
1.2 主要试剂及仪器 Taq DNA聚合酶、dNTP购自Fermentas公司;引物由上海生工生物技术有限公司合成;限制性内切酶DdeI购自Fermentas公司;DL2000DNA Marker购自大连宝生物公司;主要仪器由美国Bio-Rad公司的PTC200型PCR扩增仪、北京六一科技有限公司的垂直电泳槽、电泳仪和凝胶成像系统等组成。
1.3 实验方法
1.3.1 标本收集 所有被检者均禁食12h~14h,晨起空腹抽取静脉血4mL~5mL,EDTA抗凝。其中2mL置于-80℃保存,用作DNA提取;另3mL静脉血分离血清测定三酰甘油(TG)、总胆固醇(TC)、高密度脂蛋白胆固醇(HDL-C)、低密度脂蛋白胆固醇(LDL-C)和血糖水平,并且记录入院时未服降压药时的血压情况,详细询问有无吸烟史、饮酒史及脑卒中家族史。
1.3.2 DNA提取 按酚-氯仿抽提取法,提取外周血中白细胞内的DNA,溶于TE溶液中,置-20℃冰箱保存。
1.3.3 PCR扩增 所用引物序列参考文献[3],并由上海生工生物工程公司合成。上游引物5′-ggaaaacagggcttattgatga-3′,下游引物5′-ctgggtcaatgttgctggttaaa-3′。PCR反应体系:包含1×PCR缓冲液(10mmol/L ris-HCl,50mol/L KCl,1.5mol/L MgCl2),200 μmol/L dNTP,上 下 游 引 物 各 100nmol/L,DNA200ng,Taq DNA聚合酶1U。反应条件:94%预变性5 min,然后按94℃40s、50℃40s、72℃90s共35次循环,最后72℃至10min。PCR结束后取10μL PCR产物行20g/L琼脂糖凝胶电泳(含0.5mL溴化乙锭),5V/cm电泳40min,在紫外灯下观察PCR扩增结果。
1.3.4 酶切反应 PCR扩增产物经限制性内切酶DdeI消化后,行8%非变性聚丙烯酰胺凝胶电泳,60V电泳1h~2h,最后经0.5μg/mL溴化乙锭染色,直至DNA条带显色为止。拍照观察、保存并分析结果。PON2产物片段总长度为331bp,经内切酶消化后,可出现3种片段的组合,分别为:128bp、105bp、67bp、31bp(CC 基 因 型);172bp、128bp、31bp(GG 基 因 型);172bp、128bp、105bp、67bp、31bp(CG基因型)。
1.4 统计学处理 应用Hardy-Weinberg(H-W)分析法,检验两样本的群体代表性。计量资料用均数±标准差(x±s)表示,两组间均数比较应用t检验和方差分析。两组间基因型及等位基因频率比较采用卡方检验。脑梗死的危险因素使用非条件Logistic回归方法分析。
2 结 果
2.1 H-W平衡分析结果 对SNPs rs17876171位点进行拟合优度检验,脑梗死组(χ2=2.352)和对照组的(χ2=1.342),脑梗死组与对照组基因型及等位基因频率分布没有偏离H-W平衡(P>0.05),表明两组受检者均来自于同一群体,达到遗传平衡。
2.2 两组受检者的一般资料 脑梗死组和对照组年龄、性别、空腹血糖、饮酒史差异无统计学意义(P>0.05)。但脑梗死组患者的吸烟史、收缩压、舒张压、卒中家族史、TC、TG、HDL-C、LDL-C,与对照组比较差异有统计学意义(P<0.05)。详见表1。
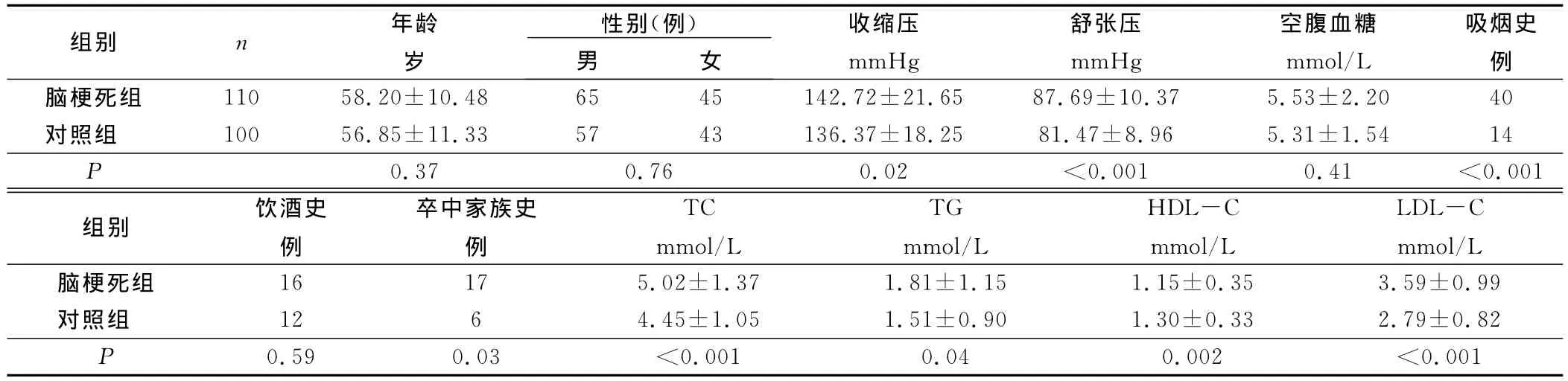
表1 两组一般资料比较
2.3 基因型和等位基因频率分布 脑梗死组基因型和等位基因频率分布与对照组相比均有统计学意义(P<0.05)。脑梗死组G等位基因频率为20.4%,对照组为13.0%,两组间差异有统计学意义(χ2=4.14,P<0.05)。携带G等位基因的基因型(GC+GG)与CC基因型比值比OR=2.15(1.25~3.70)。详见表2。2.4 多元Logistic回归分析 将脑梗死组作为自变量,以上述检验、方差分析和卡方检验所得有统计学意义的TG、TC、HDL-C、LDL-C、收缩压、舒张压以及携带G等位基因的基因型作为因变量,经过多元Logistic回归分析显示,收缩压、TG、吸烟史、GC+GG的回归系数b为正值;而HDL-C为负值。详见表3。

表2 两组基因型频率、等位基因频率比较 例(%)

表3 Logistic回归分析结果
3 讨 论
本研究立足于山西地区人群,采用病例对照研究,选取PON2标签位点tagSNP rs17876171,探讨该点突变(C→G)导致的基因多态性与脑梗死关系。本研究结果提示,脑梗死组PON2rs17876171位点G等位基因频率高于对照组,差异有统计学意义(P<0.05)。脑梗死组携带G等位基因的GG、GC基因型与CC基因型的相对危险度OR=2.15。经多元非条件Logistic回归分析显示,TG的OR值为6.781,95%CI(2.663,17.266);收缩压的OR 值为1.426,95%CI(1.097,1.853);吸烟史的OR值为1.988,95%CI(1.239,3.190);GC+GG的OR 值为2.179,95%CI(1.527,3.108)。因此,TG、血糖、收缩压和携带G等位基因为脑梗死的危险因子。
PON是一类Ca2+依赖性高密度脂蛋白相关脂酶,目前已发现有3个家族成员,包括PON1、PON2和PON3。PON2位于人类7号染色体长臂q21.3,包括9个外显子和8个内含子。该基因编码区在2个位点具有多态性,分别是148位丙氨酸(alanine,A)/甘氨酸(glycine,G)和311位半胱氨酸(cysteine,C)/丝氨酸(serine,S)[6]。在梗死形成过程中,PON 可以防止氧化型低密度脂蛋白(ox-LDL)生成,水解脂质过氧化物,并清除存在于ox-LDL中的致炎性氧化型脂质,发挥抗动脉粥样硬化作用[7],进而干预脑梗死的形成。最新研究表明PON2可以阻止线粒体内过氧化物的形成以及抑制细胞凋亡,进一步在分子水平阐述了PON2抗动脉硬化的机制[8]。目前研究较多的是PON1基因,但相比PON1仅在肝脏中表达,PON2的表达更为广泛,在多个组织中均有表达,并在动脉壁细胞,包括上皮细胞、平滑肌细胞和巨噬细胞以及细胞核周、线粒体、内质网中均被检测出来[9,10]。研究发现PON2基因敲除后的小鼠,相对野生型小鼠体内环境氧化压力升高、炎性反应加剧,动脉粥样硬化程度增大[7]。有学者认为PON2可在细胞水平发挥抗氧化作用,与血管内皮细胞的损伤及动脉粥样硬化关系更为密切,所以更具研究潜质。
Slowik等[2]研究认为PON2基因多态性与大血管病变有关,目前该基因与冠心病的相关性已有广泛的研究,但其与脑血管疾病之间的关系尚未完全明确。一项研究中报道PON2 311CC基因型在存在冠状动脉三支病变的人群中有着比较高的频率[11],而本实验结果提示G基因型(PON2 311C)是脑梗死的危险因素。这可能是由于脑梗死与冠心病的具有相同的发病机制,均是由动脉粥样硬化发展所致,所以出现该基因在脑梗死人群与冠心病人群中相同的结果。但本次的研究结果与英国学者Alireza等[6]的研究结论并不一致。这种差异可能源于等位基因出现的频率不仅受到基因多态性间的连锁不平衡影响,还存在着种族差异及环境等多因素的影响,且由于样本数量有限所导致。
本研究结果提示山西汉族地区携带PON2S311CG等位基因的人群发生脑梗死的风险增高。但尚需进一步扩大样本量和采样范围,以进一步证实该位点突变在脑梗死中的价值。期望通过检测PON2 311位等位基因筛选脑梗死高危人群,为脑梗死的预警提供新的线索。
[1] Durrington PN,Mackness B,Mackness MI.Paraoxonase and atherosclerosis[J].Arterioscler Thromb Vasc Biol,2001,21(4):473-480.
[2] Slowik A,Wloch D,Szermer P,et al.Paraoxonase 2Gene C311S polymorphism is associated with a risk of large vessel disease stroke in a Polish population[J].Cerebrovasc Dis,2007,23(5-6):395-400.
[3] Qu Y,Yang Z,Jin F,et al.The Ser311Cys variation in the paraoxonase 2gene increase the risk of type 2diabetes in northern Chinese[J].J Genet,2008,87(2):165-169.
[4] Louis PP,Devendra A,Marie CD,et al.The three-gene paraoxonase family:Physiologic roles,actions and regulation[J].Atherosclerosis,2011,214(1):20-36.
[5] The International Hap Map Consortium.The international hap map project[J].Nature,2003,426:789-796.
[6] Alireza P,Helen RA,Alastair C,et al.Paraoxonase gene polymorphisms and haplotype analysis in a stroke population[J].BMC Med Genet,2006,7:28.
[7] She ZG,Chen HZ,Yan Y,et al.The human paraoxonase gene cluster as a target in the treatment of atherosclerosis[J].Antioxid Redox Signal,2012,16(6):597-632.
[8] Altenhofer S,Witte I,Teiber JF,et al.One enzyme,two functions:PON2prevents mitochondrial superoxide formation and apoptosis independent from its lactonase activity[J].J Biol Chem,2010,285(32):24398-24403.
[9] Teiber JF,Billecke SS,La Du BN,et al.Estrogen esters as substrates for human paraoxonases[J].Arch Biochem Biophys,2007,461(1):24-29.
[10] Camps J,Marsillach J,Joven J.The paraoxonases:Role in human diseases and methodological difficulties in measurement[J].Crit Rev Clin Lab Sci,2009,46(2):83-106.
[11] Chen Q,Reis SE,Kammerer CM,et al.Association between the severity of angiographic coronary artery disease and paraoxonase gene polymorphisms in the National Heart,Lung,and Blood Institute-sponsored Women’s Ischemia Syndrome Evaluation(WISE)study[J].Am J Hum Genet,2003,72(1):13-22.
