2-十六烷氧基-5-羟甲基-1,3-苯二甲醛的合成
2012-11-21王春山
王春山, 张 泽
(安徽工程大学 生物与化学工程学院,安徽 芜湖 241000)
1,3-苯二甲醛类化合物在合成大环类功能性大分子及构建一些特殊几何构型分子方面具有重要的应用价值[1~3]。而这样的结构单元往往需要通过另外的官能团被嫁接到特定的载体上,其中羟基就是一种理想的选择。另一方面,具有液晶性质的大环功能性大分子在电子物理学及材料学等许多领域具有重要的应用前景,如何有效构建这一类性质的结构单元是目前有机合成及材料学领域的研究热点[4~6]。而长烷基链的引入往往能起到这方面的功能修饰作用[7~9]。
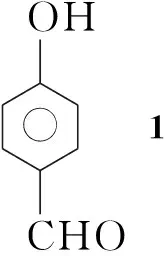
本文以对羟基苯甲醛(1)为原料,经酚苯环的二溴代、酚羟基的烷基化、醛的还原、醇羟基的保护、二甲酰化、去保护六步反应合成了一种多功能基化合物2-十六烷氧基-5-羟甲基-1,3-苯二甲醛(7, Scheme 1),总收率44%,其结构经1H NMR, IR和HR-MS确证。
本路线和方法高效可靠、收率较高,且操作相对便捷。7中两个互为间位的醛基、醇羟基以及长烷氧基链的结构特点使其在合成一些大环或具有液晶性质的功能性分子方面具有重要的潜在应用价值。
1 实验部分
1.1 仪器与试剂
XT-4型双目显微熔点仪(温度未校正);Bruker AVANCE 300型核磁共振仪(CDCl3为溶剂,TMS为内标); Brucker Vector-22型红外光谱仪(KBr压片);Micromass GCT-MS型高分辨质谱仪(+EI)。
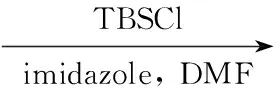
Scheme1
叔丁基二甲基氯硅烷(TBSCl),正丁基锂和四丁基氟化铵(TBAF), Acros公司;其余所用试剂均为分析纯,其中DMF和CH2Cl2用前经CaH2回流蒸馏纯化;Et2O和THF经金属钠回流蒸馏纯化。
1.2 合成
(1) 3,5-二溴-4-羟基苯甲醛(2)的合成
在圆底烧瓶中加入1 22.0 g(180 mmol),醋酸钠46.0 g(560 mmol)和醋酸600 mL,搅拌下于室温缓慢滴加液溴19.5 mL(191 mmol)的醋酸(200 mL)溶液(40 min);反应4 h。倾入烧杯中,搅拌下加水1.5 L,过滤,滤饼用水洗涤,于60 ℃真空干燥得白色固体2 47.4 g,收率94%, m.p.180 ℃~182 ℃(180 ℃~182 ℃[10]);1H NMRδ: 9.80(s, 1H), 8.02(s, 2H), 6.44(s, 1H)。
(2) 3,5-二溴-4-十六烷氧基苯甲醛(3)的合成
在反应瓶中依次加入228.0 g(100 mmol), K2CO334.5 g(250 mmol), KI 330 mg(2 mmol),n-C16H33Br(R-Br)34.0 g(110 mmol)及DMF 600 mL,搅拌下于140 ℃反应24 h。减压蒸除大部分溶剂后用混合溶剂[V(Et2O) ∶V(H2O)=1 ∶1](2×200 mL)萃取,合并有机层,用无水MgSO4干燥,减压蒸除溶剂后经硅胶柱层析[洗脱剂:A=V(石油醚) ∶V(乙酸乙酯)=8 ∶1]纯化得白色固体3 42.3 g,收率84%, m.p.49 ℃~50 ℃;1H NMRδ: 9.80(s, 1H), 7.99(s, 2H), 4.09(t,J=6.6 Hz, 2H), 1.85~1.92(m, 2H), 1.49(m, 2H), 1.21~1.33(m, 24H), 0.87(t,J=6.7 Hz, 3H); IRν: 2 920, 2 853, 1 684, 1 576 cm-1; HR-MSm/z: Calcd for C23H36O2Br2(M+) 502.108 2, found 502.107 7。
(3) 3,5-二溴-4-十六烷氧基苯甲醇(4)的合成
在反应瓶中加入325.2 g(50 mmol)和混合溶剂[V(CH2Cl2) ∶V(MeOH)=1 ∶1]500 mL,搅拌下于室温分批加入NaBH41.9 g(50 mmol);于室温反应3 h。加入饱和NH4Cl溶液50 mL,搅拌15 min。减压蒸除大部分溶剂后用乙醚(500 mL)溶解,用水洗涤两次,分液,有机层用MgSO4干燥,减压蒸除溶剂得白色固体4 24.3 g,收率96%, m.p.53 ℃~54 ℃;1H NMRδ: 7.49(s, 2H), 4.61(d,J=5.4 Hz, 2H), 3.99(t,J=6.6 Hz, 2H), 1.97(t,J=5.4 Hz, 1H), 1.85~1.91(m, 2H), 1.50(m, 2H), 1.21~1.33(m, 24H), 0.87(t,J=6.8 Hz, 3H); IRν: 2 925, 2 854, 1 594, 1 490 cm-1; HR-MSm/z: Calcd for C23H38O2Br2(M+) 504.123 9, found 504.124 3。
(4) 3,5-二溴-4-十六烷氧基苯甲醇TBS保护产物(5)的合成
氮气保护,在反应中依次加入44.0 g(8.0 mmol),咪唑0.7 g(10.0 mmol)和DMF 10 mL,搅拌下于0 ℃缓慢滴加TBSCl 1.4 g(9.5 mmol)的CH2Cl2(25 mL)溶液,滴毕,于室温反应过夜。加入CH2Cl250 mL,依次用饱和NaHCO3和水洗涤,分液,有机层用无水MgSO4干燥,减压蒸除溶剂得白色固体5 4.72 g,收率95%, m.p.47 ℃~50 ℃;1H NMRδ: 7.45(s, 2H), 4.91(d,J=5.4 Hz, 2H), 3.96(t,J=6.6 Hz, 2H), 1.78(m, 2H), 1.38(m, 2H), 1.25~1.35(m, 24H), 0.99(s, 9H), 0.90(t,J=6.8 Hz, 3H), 0.09(s, 6H); IRν: 2 955, 2 924, 2 857, 1 598, 1 452 cm-1; HR-MSm/z: Calcd for C29H52O2Br2Si(M+) 618.210 3, found 618.210 9。
(5) 2-十六烷氧基-5-TBS保护羟甲基-1,3-苯二甲醛(6)的合成
氮气保护,在反应瓶中加入54.4 g(7.1 mmol)和Et2O 50 mL,搅拌使其溶解;于-78 ℃缓慢注入n-BuLi/正己烷溶液9 mL(2.5 mol·L-1, 22.5 mmol),滴毕,于-78 ℃反应2 h;于0 ℃反应30 min;于-78 ℃迅速注入DMF 2.0 mL,于室温反应过夜。加入乙醚80 mL,冰浴冷却下用水淬灭反应,用乙醚(500 mL)萃取,合并有机层,用无水MgSO4干燥,减压蒸除溶剂后经硅胶柱层析(洗脱剂:A=6 ∶1)纯化得白色固体6 2.5 g,收率68%, m.p.83 ℃~85 ℃;1H NMRδ: 10.37(s, 2H), 7.92(s, 2H), 4.90(d,J=5.4 Hz, 2H), 3.93(t,J=6.6 Hz, 2H), 1.79(m, 2H), 1.37(m, 2H), 1.24~1.33(m, 24H), 0.98(s, 9H), 0.89(t,J=6.8 Hz, 3H), 0.09(s, 6H); IRν: 2 825, 2 724, 1 694, 1 598, 1 410 cm-1; HR-MSm/z: Calcd for C31H54O4Si(M+) 518.379 1, found 518.379 3。
(6)7的合成
在反应瓶中加入62.3 g(4.5 mmol)的THF(30 mL)溶液和TBAF 0.2 g,氮气保护下于室温反应4 h(TLC跟踪)。浓缩反应液,残余物经硅胶柱层析(洗脱剂:A=4 ∶1)纯化得白色固体7 1.6 g,收率90%, m.p.103 ℃~105 ℃;1H NMRδ: 10.41(s, 2H), 8.12(s, 2H), 4.77(d,J=5.4 Hz, 2H), 4.11(t,J=6.6 Hz, 2H), 1.86~1.91(m, 2H), 1.56(brs, 1H), 1.49(m, 2H), 1.22~1.32(m, 24H), 0.87(t,J=6.8 Hz, 3H); IRν: 3 358, 2 975, 2 894, 1 692, 1 602, 1 494 cm-1; HR-MSm/z: Calcd for C25H40O4(M+) 404.292 7, found 404.292 3。
2 结果与讨论
2.1 合成
在2的合成中,醋酸的用量不能小,而且溴素要被醋酸稀释后慢慢滴加,否则反应可能过于剧烈,导致反应物发黏致使反应失败。另外,要保持良好的搅拌状况。
在3的合成中,由于大量碳酸钾的存在导致反应呈非均相,反应速率较慢,加入少量的碘化钾会有效地促进反应的进行。此外,在较高温度及较长反应时间的情况下,为防止酚及醛基的氧化,反应须在惰性气氛下进行。
粗品4可不需纯化直接用TBS保护合成5,其分离产率不受明显影响。
要有效实现对TBS保护的二溴代物5中的两个溴原子都被醛基置换,正丁基锂的用量要大大过量,而且反应时间要充分,且后期要注意快速注入大大过量的DMF。否则会有不少只上一个醛基的副产物生成。
粗品6也可不需纯化而直接进行最后产物7的合成。
[1] Morgan B, Dolphin D. Synthesis of hydrocarbon-strapped porphyrins containing quinone and phenolic groups[J].J Org Chem,1987,52(24):5364-5374.
[2] Gopalsamuthiram V, Huang R, Wulff W D. The synthesis of optically active calix[4]arenes with one or three substituents on the methylene bridges[J].Chem Commun,2010,46(43):8213-8215.
[3] Suzuki K, Iida J, Sato S,etal. Discrete and well-defined hydrophobic phases confined in self-assembled spherical complexes[J].Angew Chem Int Ed,2008,47(31):5780-5782.
[4] Yablonovitch E. Inhibited spontaneous emission in solid-state physics and electronics[J].Phys Rev Lett,1987,58(20):2059-2062.
[5] John S. Strong localization of photons in certain disordered dielectric superlattices[J].Phys Rev Lett,1987,58(23):2486-2488.
[6] Lopez C. Materials aspects of photonic crystals[J].Adv Mater,2003,15(20):1679-1704.
[7] He X Z, Zhang B Y, Meng F B,etal. Effect of the length o f the carbochain on the phase behavior of side-chain cholesteric liquid-crystalline elastomers[J].J Appl Polym Sci,2005,96(4):1204-1210.
[8] Höger S, Enkelmann V, Bonrad K,etal. Alkyl-substituted shape-persistent macrocycles:The first discotic liquid crystal composed of a rigid periphery and a flexible core[J].Angew Chem Int Ed,2000,39(13):2268-2270.
[9] Weck M, Mohr B, Maughon B R,etal. Synthesis of discotic columnar side-chain liquid crystalline polymers by ring-opening metathesis polymerization[J].Macromolecules,1997,30(21):6430-6437.
[10] He L Y, Zhang L, Liu X F,etal. Discovering potent inhibitors against theβ-hydroxyacyl-acyl carrier protein dehydratase(FabZ) of helicobacter pylori:Structure-based design,synthesis,bioassay,and crystal structure determination[J].J Med Chem,2009,52(8):2465-2481.
