人工脂质体染色方法的探究
2012-11-21苏伟阚文静王绍华彭方
苏伟,阚文静,王绍华,彭方
(武汉大学生命科学学院,湖北 武汉 430072)
0 引言
人工脂质体是一种人工膜体系,可以形成单层膜,也可以是连续的双层或多层复合脂质组成的人工小球囊,直径不等,约25~100 nm.科研工作者利用乙醇注入法[1]、薄膜分散法、超声波分散法[2]、逆相蒸发法[3]、冷冻干燥法等多种方法成功地制备了人工脂质体.脂质体可以和细胞膜融合,将药物或者小分子送入细胞内部,应用于转基因或药物制备.因此,脂质体是一种良好的生物学材料,被广泛应用于生物领域、医学领域[4-5]和药学领域[6-8].1976年德国的马普生物物理研究所创建了膜片钳技术[9-10],利用双电极钳制细胞膜电位,记录离子通道的离子电流,反映了细胞膜单一的或多个的离子通道分子活动.膜片钳技术广泛地应用到平面双分子层、脂质体等人工标本上,对细胞膜离子通道进行性质鉴定及动力学研究,以阐述离子通道与细胞膜相互作用的机制,因而对脂质体的形态、结构有较高的要求.
脂质体的制备对后续定性和定量实验有着重要作用,所以,在制备脂质体的过程中,研究者需要找到一种观察脂质体的形态特征、预测脂质体制备效果的方法.传统研究方法中,电子显微镜成为观察脂质体的一种方法,但具有一定的局限性,只能观察平面结构,成本较高,且不能随时观察.本研究利用染色的方法对脂质体进行观察,通过不同染色方法的对比,将染色效果最佳的方法进行优化,从而能够在光学显微镜下观察到立体结构清晰、形态完整的脂质体.该方法简单、可行.目前对脂质体染色的研究尚少见报道,本研究对脂质体的染色进行了探究,建立了一种观察脂质体的新方法,为后续实验需要打下基础.
1 材料和仪器
1.1材料L-α-phosphatidylcholine(L-α-磷脂酰胆碱)(sigma),氯化钠(国药集团化学试剂有限公司,AR),结晶紫(沈阳试三生化科技开发有限公司),美蓝(上海易利生物科技有限公司),复红(北京恒业中远化工有限公司),钼蓝,苏丹黑(沈阳市试剂三厂).
1.2试剂1%的结晶紫染液,0.01%的美蓝染液,复红染液,钼蓝染液,苏丹黑染液参考《微生物学实验》进行配制,蒸馏水,三氯甲烷(国药集团化学试剂有限公司,AR).
1.3仪器玻璃珠,试管,摇床,烘箱,显微镜(Olympus BX51).
2 方法
2.1脂质体的制备取1 μgL-α-phosphatidylcholine于试管中,加入1 mL氯仿、一粒玻璃珠,待固体磷脂完全溶解后,氮气吹干,加入浓度依次为0%、0.9%、1.2%、1.5%、1.8%、3.0%的1 mL氯化钠溶液,分别编号为a1、a2、a3、a4、a5、a6.将样品放入42 ℃摇床,50 r/min,过夜.
2.2脂质体染色将一滴脂质体样品溶液置于载玻片中央,加盖玻片,在普通光学显微镜、相差显微镜下直接观察;分别取5 μL染液(1%的结晶紫染液,0.01%美蓝染液,复红染液,钼蓝染液,苏丹黑染液)于样品溶液(30 μL)中,混匀,镜检.
2.3梯度染色取染色效果最佳的染液进行梯度染色,30 μL样品液中分别加入1、3、5 μL染液,混匀,镜检,寻求最优的染色配比.
3 结果

表1 不同的染色液对脂质体染色效果的对比
1,1%结晶紫染液;2,复红染液;3,0.01%美蓝染液;4,苏丹黑染液;5,钼蓝染液.
“++”表示显微镜下,脂质体的染色效果最佳;“+”表示显微镜下,可观察的脂质体结构完整,着色良好,背景干净,形态清晰,数量多;“-”表示显微镜下,可观察的脂质体无完整结构,着色差,背景、形态模糊,数量少.
3.1不同染液对脂质体的染色效果实验结果表明,苏丹黑染液和美蓝染液不能使脂质体着色,与未染色脂质体镜检的结果区别不明显;加入钼蓝染液后,显微镜下无法检测到脂质体,推测脂质体被破坏;复红染液使脂质体着色,染色效果差;结晶紫染液染色效果最佳,结果见表1.结晶紫可能与外膜的极性基团发生吸附作用,使脂质体着色,具体的作用机制需进一步探讨.
3.2未染色与染色后的脂质体普通光学显微镜下,可观察到未经染色的脂质体形态,但是轮廓模糊,内部结构不清晰,结果见图1A;相差显微镜下,脂质体较易被观察,缺点是个体形态模糊,形态小的脂质体分辨率差,结果见图1B,可观察的脂质体数量少.经结晶紫染色后,可以观察到的脂质体的数量明显增多,能够清晰地辨别脂质体的内部结构(图2A和图2E),脂质体的立体结构突出(图2C和图2D),形态小的脂质体清晰可辨(图2B和图2F).
3.3最佳染色配比30 μL样品液中加入3 μL结晶紫染液的效果最佳,脂质体染色效果明显,背景不呈现紫色,干净(图2C和图2D);加入1 μL结晶紫染液,脂质体着色效果不佳,背景清晰(图2E和图2F);加入5 μL染液,脂质体和背景呈紫色(图2A和图2B),难于分辨立体结构(表2).

图1 未经染色,显微镜100×油镜下的脂质体A,普通光学显微镜;B,相差显微镜.

图2 经结晶紫染色,普通光学显微镜100×油镜下的脂质A、B的染色配比,30 μL样品液加入5 μL结晶紫染液,染液终浓度为0.14%;C、D的染色配比,30 μL样品液加入5 μL结晶紫染液,染液终浓度为0.09%;E、F的染液配比,30 μL样品液加入1 μL结晶紫染液,染液终浓度为0.03%.
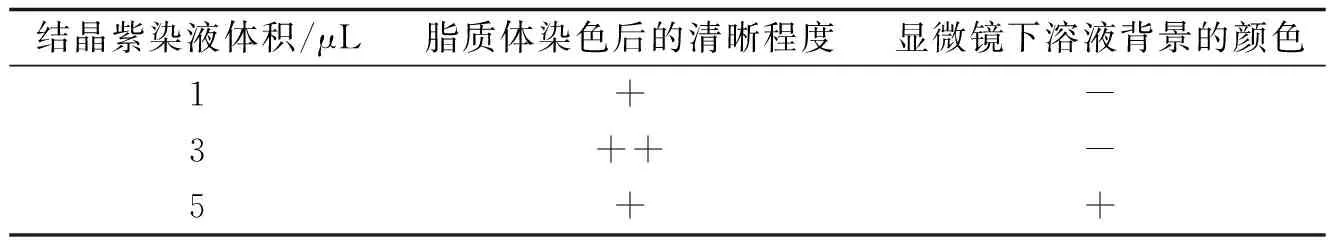
结晶紫染液体积/μL脂质体染色后的清晰程度显微镜下溶液背景的颜色1+-3++-5++
“++”表示脂质体染色清晰度最佳;“+”表示脂质体染色清晰,溶液背景呈紫色;“-”表示脂质体染色后不清晰,溶液背景为无色.
4 结论
本次实验通过几种染色液以及不同浓度的染液对脂质体进行染色,从而建立一种观察脂质体的新方法,能够在普通光学显微镜下利用结晶紫染色对脂质体的形成和形态进行简便可行的观察.与未染色前相比,脂质体立体轮廓清晰,可清晰分辨形态小、结构复杂的脂质体,从而显示出脂质体的形成效果,给后续实验的需要带来便利.
[1] 全东琴, 苏德森, 顾学裘. 药物载体空白脂质体前体的制备及性质的研究[J].沈阳药科大学学报, 1999, 16(3):160-164.
[2] 郭健新, 平其能, 黄罗生. 柔性环孢素纳米脂质体的制备及其变行性[J].中国药科大学学报,1999,30(3):187-191.
[3] Allen T M, Chorm A. Large unilamellar liposomes with low-up take into the reticuloendothelial system[J].FEBS Lett,1987,2(23):42-46.
[4] 林娟, 周庆翰, 赵晓军. 荧光光谱对自组装多肽作为药物载体的初步研究[J].光谱学与光谱分析,2009,10(10):2792-2796.
[5] 李庭, 曾光明, 汤琳, 等. 脂质体免疫传感器的研究进展[J].分析化学评述与进展, 2008,1(36):122-126.
[6] 陈鹰, 陈松. 磷脂类皮肤载体给药系统的研究进展[J].中国药房,2003,14(9):564-566.
[7] 胡静, 封钦锋. 硫唑嘌呤脂质体制备方法的研究[J].西北药学杂志, 2002,17(4):167-169.
[8] 马涛, 尚北城, 徐贵丽. 盐酸万古霉素阳离子脂质体的制备及其性质研究[J].广东药学学报,2010,26(6):551-554.
[9] 安广权, 赵雪莲, 高英超. 罗库溴铵复合物维库溴铵或阿曲库铵对骨骼肌成人型和胎儿型乙酰胆碱受体的作用[J].天津医药,2008,3(36):204-207.
[10] 刘力, 闵苏, 魏珂. 七氟醚和异氟醚对不同浓度罗库溴铵抑制乙酰胆碱受体内向电流的影响[J].中国药理学通报,2011(1):113-116.
