固相萃取-液相色谱法分析环境水样中有机磷农药残留
2012-11-21李春民章承林陈怀侠
李春民,章承林,陈怀侠
(1.湖北大学化学化工学院,湖北 武汉 430062;2.湖北生态工程职业技术学院,湖北 武汉 430020)
有机磷农药的大量生产和长期使用,致使不少地区土壤[1]、水体[2-4]、粮食[5-6]以及水果蔬菜[7-9]中有机磷农药残留远远超过国家安全标准[10-11],对环境、生物及人体健康构成严重威胁[12-13],因此,严格控制有机磷农药的使用以及准确高效地检测该类农药的残留十分重要.
目前有机磷农药的检测分析方法主要有色谱法[1-2]和一些联用技术[4-5].联用技术仪器昂贵、分析成本高;由于辛硫磷在高温下不稳定,不宜用气相色谱进行分析;液相色谱简便实用,但灵敏度有待提高.在液相色谱分析中,样品的前处理是分析复杂样品中农药残留的重要步骤,也是关系到色谱分析灵敏度的重要环节.传统的前处理方法如液液萃取、膜萃取、树脂吸附、索氏提取等均存在诸多局限[14-15],特别是液液萃取所需的样品量大,操作耗时,且大量的有机溶剂会造成严重的环境污染和人身伤害,而固相萃取(SPE)因其具有简化样品前处理过程、减少溶剂用量、提高分析效率、缩短分析时间、富集效果好、回收率高、对环境污染少等优点[16-20],已广泛应用于各类物质的分析检测.
本文中以SPE进行环境水样中有机磷农药的分离富集,优化了SPE提取条件,建立了环境水样中甲基对硫磷、杀螟硫磷、对硫磷、辛硫磷等4种常用有机磷农药的高效液相色谱分析方法,并应用于实际环境水样分析,获得了满意的结果.
1 实验部分
1.1仪器与试剂美国Dionex公司Summit P680型高效液相色谱仪(Dionex,美国),手动进样器,5 μL定量环,柱温箱(LGC-1025M,荆州市楚新电子产品开发有限公司),Chromeleon色谱管理软件,pHS-25型酸度计(上海伟业仪器厂),Aquaplus微量无机型超纯水机(AWJ1-0501-U,艾科浦公司),0.22 μm过滤膜(上海兴亚净化材料厂),DL-01溶剂过滤器(DL01真空泵+FB01T过滤瓶,天津市东康科技有限公司),真空萃取装置(艾杰尔科技公司),3 mL固相萃取柱(ProElut-C18,DIKMA,North America,USA),可调式移液器(Finnpipette,100~1 000 μL).
甲基对硫磷(99.0%)、杀螟硫磷(98.7%)、对硫磷(99.5%)、辛硫磷(99.0%)均购于迪马公司(USA);色谱纯乙腈、甲醇(Tedia公司,美国);分析纯磷酸(H3PO4含量不少于85.0%,天津市东丽区天大化学试剂厂)、分析纯氯化钠,超纯水等.
1.2 实验方法
1.2.1 标准溶液的配制 精确称取各标准品,用甲醇分别配制成浓度为1.0 mg/mL标准储备液,4 ℃下避光保存.实验前将储备液用超纯水稀释成所需浓度的标准工作液备用.
1.2.2 样品前处理过程 试剂瓶先后用自来水和超纯水清洗后,分别收集长江水、沙湖水和自来水,用0.22 μm过滤膜过滤两次,4 ℃下避光保存,并在收集12 h内进行富集和分析.
ProElut-C18固相萃取小柱分别用3 mL甲醇和3 mL超纯水清洗、活化,再将100 mL水样以10 mL/min的流速于SPE萃取柱上进行富集.上样完毕后用3 mL超纯水清洗固相萃取柱,并在真空状态下干燥3 min后,用0.9 mL乙腈以0.2 mL/min的流速洗脱分析物,最后用洗耳球挤出小柱中残留的乙腈,收集洗脱液,并进行液相色谱分析.
1.3色谱条件色谱柱:varian pursuit C18(4.6 mm×250 mm,varian technologies,5 μm, PaloAlto, CA,USA),预柱(2.1 mm×12.5 mm, 5 μm, agilent technologies, PaloAlto, CA,USA).流动相:甲醇-水(72∶28,V/V),流速:1 mL/min,进样量:20 μL,检测波长:275 nm,柱温:25 ℃.
2 结果与讨论
2.1 色谱条件的优化
2.1.1 检测波长的选择 甲基对硫磷的紫外吸收峰为215.4 nm和275.4 nm;杀螟硫磷的紫外吸收峰为211.2 nm和270 nm;对硫磷的紫外吸收峰为213.5 nm和276.2 nm;辛硫磷的紫外吸收峰为219.3 nm和284.4 nm,因波长太小干扰较多,考虑4种物质同时测定的灵敏度,最终选择检测波长为275 nm.
2.1.2 流动相的优化 通过对流动相组成的优化,保证各组分的色谱分离,最终选择72∶28的甲醇-水(V/V)为流动相.本实验还试用磷酸来调节流动相的酸度,考察酸度对色谱峰的影响.结果显示,各组分的色谱峰并未获得更好的改善,分离度反而有所下降,因此不必调节流动相的酸度.
2.2 SPE条件的优化
2.2.1 洗脱液种类的选择 分别考察了甲醇和乙腈的洗脱效果.通过比较,发现乙腈的洗脱回收率较高.故实验选择以乙腈为洗脱剂.
2.2.2 上样体积的选择 为了研究SPE小柱的穿漏情况,选择最佳的上样体积,以便获得较高的回收率,本实验分别考察了50、100、150、 200、300 mL的样品上样,实验结果见图1.由图可见,上样体积为100 mL时,4种化合物回收率较高,即本实验选择100 mL的样品上样进行分析.

图1 上样体积对回收率的影响

图2 洗脱剂体积对回收率的影响
2.2.3 洗脱剂体积的选择 100 mL样品溶液经SPE小柱富集后,分别用0.2、0.5、0.7、0.8、0.9、1.0和1.2 mL乙腈进行洗脱,洗脱效果见图2.由图可见,随着洗脱液体积的增加,回收率逐渐提高,当洗脱液体积为0.9 mL时,增加洗脱液体积,回收率基本不变,故本实验选用0.9 mL乙腈洗脱4种分析物.
2.2.4 上样流速的选择 分别选择5、10、12、16和18 mL/min的上样流速通过SPE萃取柱,发现流速为10 mL/min时,4种分析物的回收率均较高(如图3),故上样流速选用10 mL/min.
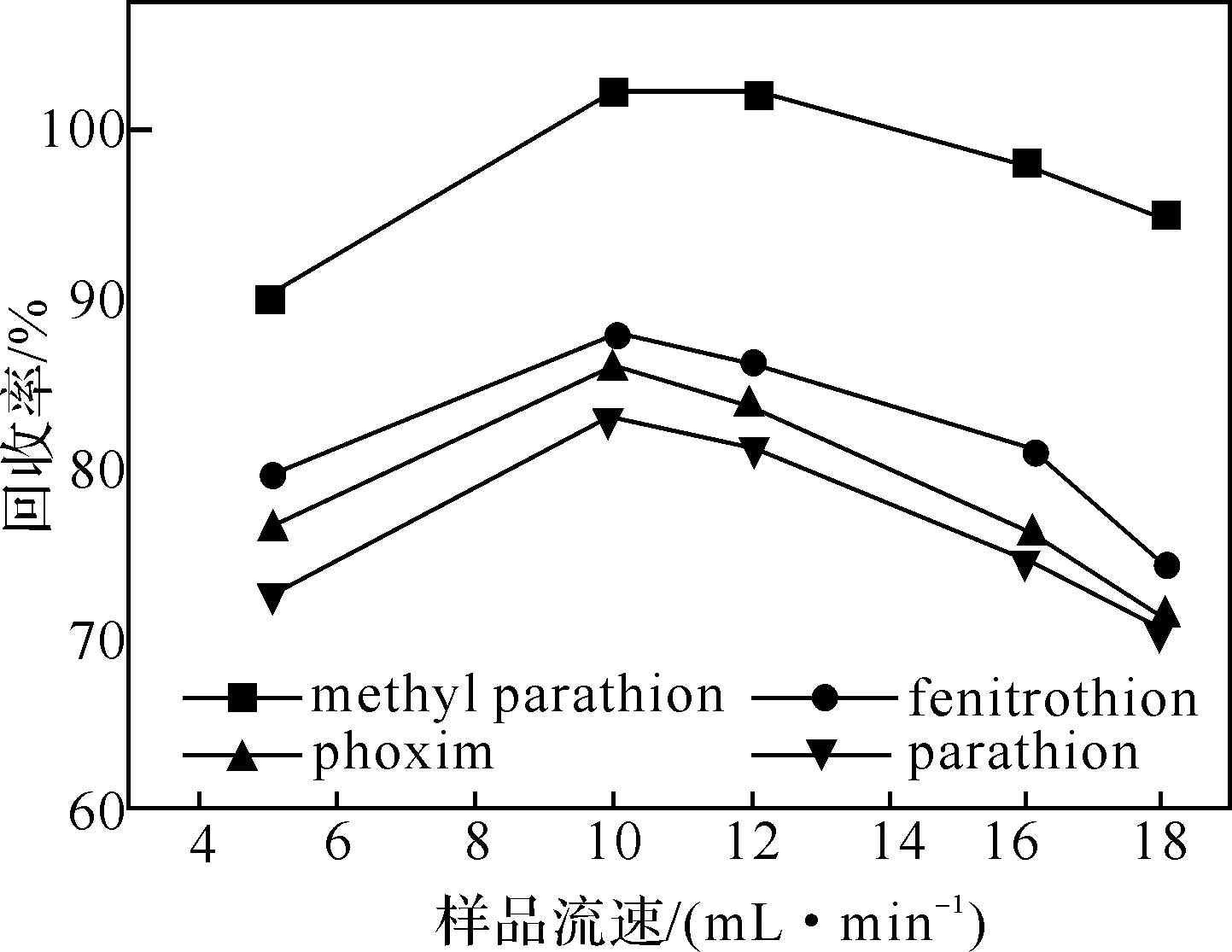
图3 样品流速对回收率的影响

图4 样品溶液pH值对峰面积的影响
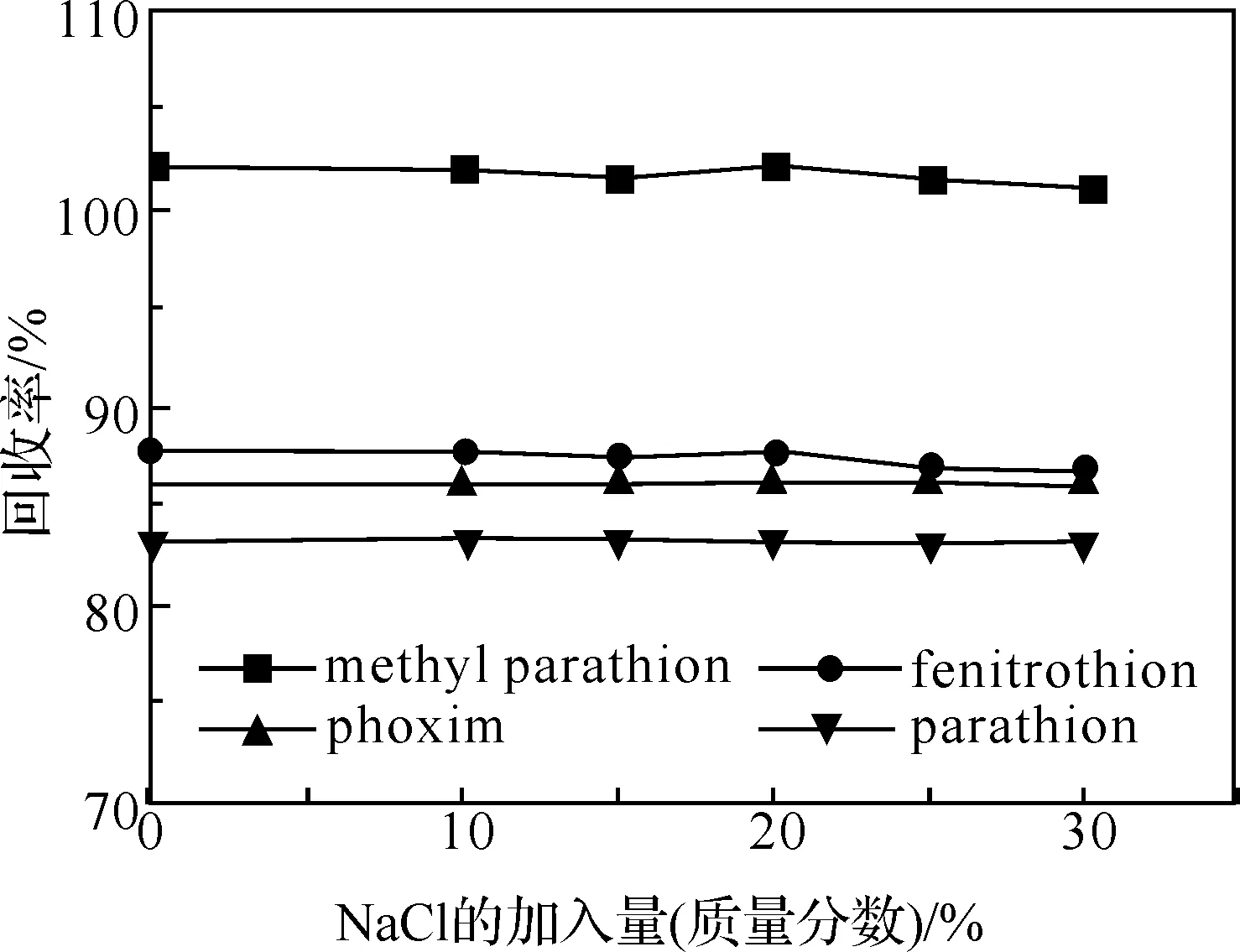
图5 样品溶液离子强度对峰面积的影响
2.2.5 样品溶液酸度的选择 为了考察样品溶液酸度对SPE萃取柱富集效果的影响,在pH值为2~6(样品原液的pH为5.64)范围内,用磷酸调节样品的酸度.实验结果见图4.由图可见,4种分析物随着pH值的降低,回收率基本保持不变.因此本实验不改变样品溶液的酸度.
2.2.6 样品溶液离子强度的影响 向样品溶液中分别加入0~30%的NaCl(m/v),调节溶液的离子强度.实验结果见图5.由图可见,离子强度的改变对4种化合物的回收率影响不大,故本实验的样品溶液中不必添加NaCl.
2.3 方法的评价
2.3.1 工作曲线及检测限 如图6中(A)、(B)所示,在优化的实验条件下,对加标空白环境水样进行分析,获得了比较满意的分离和富集效果,说明SPE-HPLC法能够准确地检测出纯HPLC法无法检测出的样品,具有更低的检测限.4种有机磷农药在自来水样中的线性关系见表1.由表可见,4种分析物在一定范围内线性关系良好,相关系数R2在0.999 0以上,检测限(S/N=3)为0.11~0.85 μg/mL,满足我国对环境水样中有机磷农药的分析检测要求.

表1 工作曲线及检测限
2.3.2 回收率和精密度考察 分别添加低、中、高浓度分析物的空白水样进行分析,获得方法的加标回收率.空白自来水样中分别添加10、30和60 μg/L等3个不同浓度的甲基对硫磷、杀螟硫磷、对硫磷和辛硫磷,在优化的实验条件下,进行液相色谱分析.实验结果见表2.可见,4种分析物的加标回收率在84.2%~102.2%之间,日内RSD均小于8.4%,日间RSD均小于9.7%,符合定量分析要求.
2.4实际样品的检测分析按照上述实验方法,分别分析长江水、沙湖水和自来水样,均未检测出4种有机磷农药.这可能是因为取水时节是多雨季节,致使沙湖和长江水样中浓度均较低而未能检测到分析物.但我们在加标样的SPE-HPLC分析中发现(如图6中(C)、(D)、(E)所示),尽管沙湖水和长江水的基质比自来水成分要复杂得多,但本实验采用的SPE-HPLC法仍然能准确地检测出4种有机磷农药的相关含量,说明像沙湖水和长江水这样的复杂水体对SPE-HPLC法检测4种有机磷农药的结果产生不了实质性地干扰作用.
3 结论
文中建立了环境水样中甲基对硫磷、杀螟硫磷、对硫磷和辛硫磷等4种常用有机磷农药残留的SPE-HPLC分析检测方法.该方法快速、处理简单、富集和分离效果好、回收率在84.2%~102.2%之间,检出限为0.11~0.85 μg/mL,适合于我国对环境水样中有机磷农药残留的分析检测的要求[10-11].

图6 自来水、沙湖水,长江水及标准混合液的相关色谱图 A:加标0.01 μg/mL自来水样HPLC;B:加标0.01 μg/mL自来水样SPE-HPLC;C:加标0.01 μg/mL长江水SPE-HPLC;D:加标0.01 μg/mL沙湖水样SPE-HPLC; E:5 μg/mL标准混合液SPE-HPLC
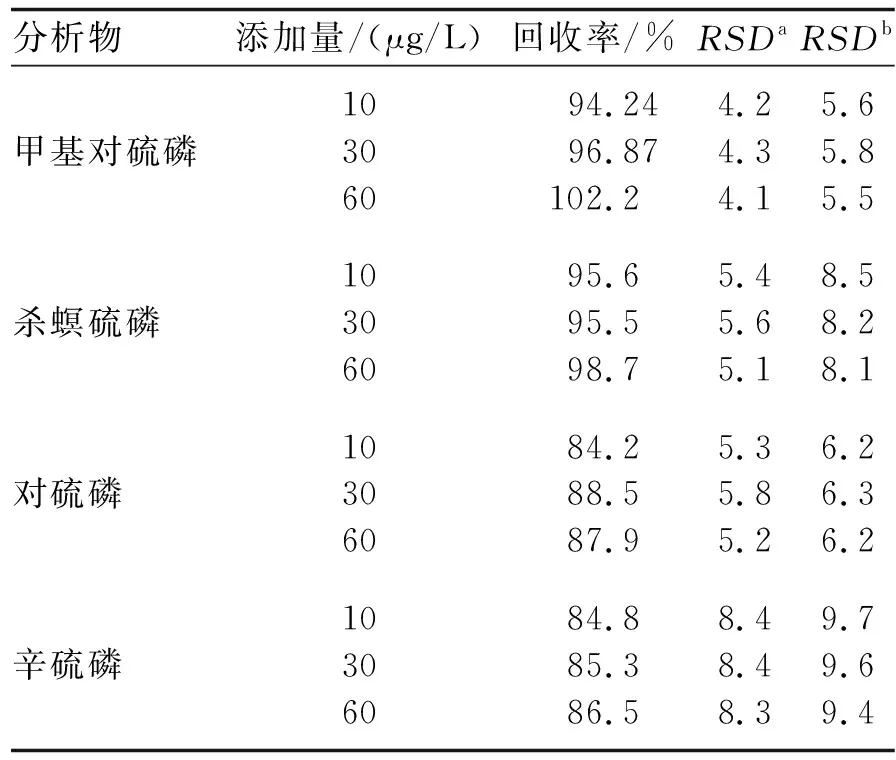
分析物添加量/(μg/L)回收率/%RSDaRSDb甲基对硫磷10306094.2496.87102.24.24.34.15.65.85.5杀螟硫磷10306095.695.598.75.45.65.18.58.28.1对硫磷10306084.288.587.95.35.85.26.26.36.2辛硫磷10306084.885.386.58.48.48.39.79.69.4
a:日内RSD,b:日间RSD
[1] 乔雄梧,朱九生,李捷. 土壤中残留对硫磷和甲基对硫磷的高效液相色谱分析[J].环境化学,1995,14(3):255-257.
[2] Rotich H K,张卓勇,赵进英. 环境水中甲基对硫磷、对硫磷和辛硫磷农药残留的SPE-HPLC分析[J].分析测试学报,2002,21(05):50-53.
[3] 郭强. 固相萃取法测定饮用水中的有机磷农药[J].科技情报开发与经济,2005,15(12):146-148.
[4] 杨元,高玲,景露,等. SPE-GC/MS法测定水中有机磷和氨基甲酸酯农药[J].中国测试,2009,35(2):86-89.
[5] 许秀丽,李礼,丁罡斗,等. 大米中13种有机磷农药的固相萃取结合大体积进样/气相色谱-质谱法快速分析[J].分析测试学报,2008,27(01):30-33.
[6] 曲丽萍,国娜. 气相色谱法快速测定大米中多种农药残留[J].黑龙江粮食,2005(06):21-22.
[7] 朱勇,杨挺,赵健. 有机磷类农药在大白菜苹果中残留检测[J].宁波农业科技,2006(03):6-8.
[8] 牛古丹,俞志刚,李晓霞. 固相萃取-高效液相色谱法测定果蔬中农药马拉硫磷残留量[J].化学研究与应用,2007,19(10):1166-1168.
[9] 朱兴江,丁振华,胡艳云,等. 固相萃取高效液相色谱法检测蔬菜水果中的唑螨酯残留[J].光谱实验室,2008,25(02):217-220.
[10] GB 5749-2006生活饮用水卫生标准[S].中国标准出版社,2006.
[11] GB 26130-2010食品中百草枯等54种农药最大残留限量[S].中国标准出版社,2010.
[12] 邹喜乐.论农药对环境的危害[J].湖南农机,2007(07):44-47.
[13] 崔伟伟,张强斌,朱先磊.农药残留的危害及其暴露研究进展[J].安徽农业科学,2010,38(2):883-884,889.
[14] 何聿,陈金泉,张兰. 有机磷农药残留前处理技术的研究[J].福建分析测试,2007,16(3):6-11.
[15] 吴建伟,李江.水中有机磷农药分析前处理方法探讨[J].环境监测管理与技术,2009,21(2):65-67.
[16] Korta E,Bakkali A,Berrueta L A,et al.Study of semi-automated solid-phase extraction for the determination of acaricide residues in honey by liquid chromatography[J].J Chromatogr A,2001,930(1/2):21-29.
[17] Kishida K,Furusawa N.Matrix solid-phase dispersion extraction and high-performance liquid chromatographic determination of residual sulfonamides in chicken[J].J Chromatogr A,2001,937(1/2):49-55.
[18] 江腾辉,鞠荣,徐汉虹.固相萃取技术在农药分析中的应用[J].农药,2004,43(10):463-466.
[19] 傅若农,近年国内固相萃取-色谱分析的进展[J].分析试验室,2007,26(2):100-122.
[20] 陈方荣,吴波,马培丽,等. 固相萃取-液相色谱法同时检测4种酸性PPCPs[J].湖北大学学报:自然科学版,2011,33(2):168-173.
