HGF+EGF联合诱导大鼠BMSCs分化肝样细胞的研究
2012-11-21袁丹妮李洪秀王鹏
袁丹妮 李洪秀 王鹏
BMSCs在体外环境下可以分化为肝细胞系。此外,MSCs存在于骨髓,具有供源丰富、易于获得、有自体供源、避免免疫排斥等优点。骨髓源的MSCs是较为理想的肝干细胞来源。本实验以HGF和EGF作为诱导分化剂,在体外诱导大鼠源性骨髓间充质干细胞向肝样细胞分化,并检测其分化率。试图为肝细胞移植找到新的种子细胞来源。
1 材料与方法
1.1 实验动物 SD大鼠8只,(辽宁医学院动物实验中心提供)。
1.2 方法
1.2.1 BMSCs的取材、分离及培养 ①10%水合氯醛腹腔注射麻醉致死大鼠,无菌条件下取出双侧股骨,剔除骨表面肌肉和骨膜,剪去两骺端暴露髓腔。②用D-HANK'S液冲洗髓腔至冲洗液澄清,轻轻吹打冲洗液,用200目钢网过滤掉大的团块后收集,1000rpm离心8 min;弃上清,用DMEM培养基(含15%FBS、青霉素100 U/ml、链霉素100 U/ml)重悬细胞。③显微镜下计数后,以1×105/ml密度接种于50 ml培养瓶中,置恒温孵箱(37℃,5%CO2饱和湿度)培养;48 h后全量换液。以后每周换液两次。等细胞长满瓶底的80%~90%时,传代培养。
1.2.2 诱导实验
1.2.2.1 实验分组 见表1。
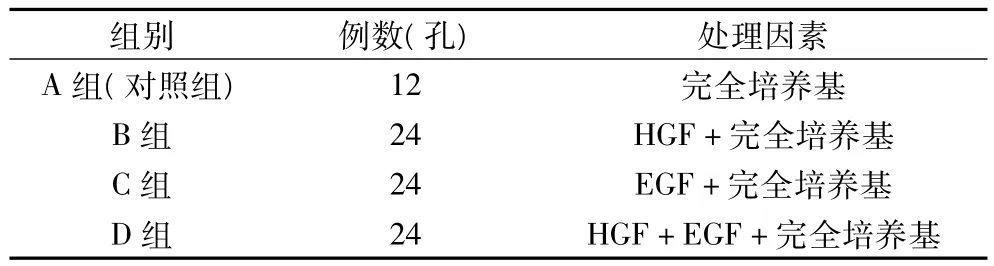
表1 实验分组
1.2.2.2 诱导方法 取传至2代的大鼠BMSCs,常规消化后,取1 ml 1×104/ml细胞悬液接种于24孔培养板中(孔中预先放置无菌盖玻片),待细胞生长近汇合状态(约占瓶底80%)时,弃除培养基,加入诱导培养液 1 ml,置于恒温孵箱(37℃、5%CO2)内进行诱导。在此过程中,用倒置显微镜连续观察细胞形态学变化。各组在诱导第7、Zdl行免疫细胞化学染色。拟行诱导分化的BMSCs,培养基中均不加防止细胞分化的LIF。
1.2.2.3 免疫细胞化学染色 接种于6孔板内细胞达到诱导时间后,行ABC法免疫细胞化学染色。一抗为兔抗大鼠AFP(1∶320)、兔抗大鼠 CK18(1∶1400),未分化组为阴性对照。免疫组化阳性为胞浆内有棕黄色颗粒。
2 实验结果
2.1 BMSCs形态学特征原代培养24 h内即可观察到在大量悬浮小圆形细胞之间出现呈梭形、菱形、三角形的细胞,这些细胞呈贴壁生长。第一次换液后,小圆形细胞数量明显减少,贴壁细胞增殖加快,形态渐趋一致,呈长梭形。培养7~9 d,贴壁细胞就可以铺满培养瓶底的90%以上。
2.2 诱导BMSCs的效应
2.2.1 形态学结果 BMSCs体外诱导过程的形态学观察BMSCs在大多呈现内皮细胞样的梭型或成纤维细胞样长条形,贴壁较紧,有克隆形成,平均9~11 d长满板底或培养瓶底。加入各种诱导成分,梭形或成纤维细胞样细胞随着诱导时间的延长,变成纺锤、不规则圆形或多角形,细胞数量逐渐变多,形似肝细胞。
2.2.2 免疫细胞化学染色及图像分析结果 在诱导分化第7、21天进行免疫细胞化学染色,A组细胞AFP、CK18均为阴性着色,而B、C、D、E组细胞AFP和CK18均为阳性着色。对各组细胞染色进行图像分析,每组细胞取4张切片,每张切片取5个视野,进行图像分析,并计算出各组细胞的阳性染色率P(U值),结果如下表。(表2,3)
表2 免疫细胞化学染色AFP染色阳性率(PU值,,n=4)

表2 免疫细胞化学染色AFP染色阳性率(PU值,,n=4)
注:1.A组:阴性对照组。B组:HGF组。C组:EGF组。D组:HGF+EGF组;2.7 d与21 d之间差异有显著性意义(F=8.740,P=0.006)。以21 d测得的PU值较高;3.各处理组之间差异有显著性意义(F=151.374,P=0.000)。两两比较差异均有显著性意义(P=000),D组诱导分化的效果最好,B组次之,C组较差;4.处理组与时间无交互效应(F=0.492,P=0.742)。
组别 7 d 21 d 合计A组34.00±22.30 39.35±24.51 36.672±3.29 2.36±1.87 4.20±3.29 3.28±2.67 B组 35.24±6.02 39.61±7.89 37.43±6.90 C组 21.68±6.37 25.73±4.90 23.71±5.69 D组 46.37±5.73 55.11±5.01 50.74±6.83合计
表3 免疫细胞化学染色CK18染色阳性率(PU值,,n=4)

表3 免疫细胞化学染色CK18染色阳性率(PU值,,n=4)
?
3 讨论
本研究在诱导大鼠BMSCs向肝样细胞分化过程中采用了HGF、EGF-4,HGF是一完全有丝分裂原,主要在肝脏Kupffer细胞与肝窦内皮细胞中产生,最初是作为肝细胞的一种潜在的有丝分裂原而被发现和克隆的,它是一种普遍存在并具有多能性的细胞因子,通过与受体 c-met相互作用而对多种细胞产生促有丝分裂及促形态形成作用,使运动能力增强,其受体c-met是一种膜外部分拥有酪氨酸激酶的跨膜蛋白,对具有c-met表达的多种细胞的有丝分裂及塑形都具有刺激作用[1,2]。
我们选择的HGF和EGF以及HGF+EGF作为诱导因子,在加入诱导因子后第7~21天进行细胞爬片,通过免疫细胞化学染色检测肝细胞标志AFP和CK18,并应用图像分析的方法计算BMSCs的分化比率。实验结果显示,在诱导分化第7~21天免疫细胞化学染色各诱导组均可检测出AFP和CK18表达,以HGF+EGF联合诱导分化BMSCs的阳性率最高,HGF次之,EGF则较弱。本实验的实验结果证明HGF和EGF具有诱导BMSCs向肝细胞分化的能力,免疫细胞化学染色结果证明二者联合使用效果更佳。说明了骨髓BMSCs在HGF+EGF的定向诱导下可以更好地向肝样细胞分化,为肝细胞工程的种子细胞来源提供了理论和实验依据。
[1]Miller SA,Dykes DD,Polesky HP.A simple salting out procedure forextracting DNA from human nucleated cells.Nucleic Acids Res,1988,16:1215.
[2]Hayashi Sl,Watanabe J,Nakachi K,et al.PCR detection of an A/Gpolymorphism within exon 7 of the CYP1 A1 gene.Nucleic Acids Res,1991,19:4797.
