稳定表达野生型p53基因人骨肉瘤细胞株的建立与鉴定
2012-11-20雷晓晶韩鹏飞
雷晓晶, 韩鹏飞, 吕 智
(1山西省长治市第二人民医院骨科, 长治 046010;2山西医科大学第二临床医学院骨科)
p53基因是目前细胞抑癌基因中研究最为广泛和深入的基因之一,它定位于人类染色体17p13.1,全长16-20 kb,有11个外显子和10个内含子,编码393个氨基酸[1]。p53基因分为野生型(wt p53)和突变型(mt p53)两种形式。正常的p53基因又叫野生型p53基因(wt p53),具有维持基因组稳定、抑制或阻止细胞转化、诱导肿瘤细胞凋亡的功能[2]。而骨肉瘤是一种常见的骨原发恶性肿瘤,其发病年龄多在11-30岁,严重危害青少年的身体健康。众多研究表明p53基因参与了骨肉瘤的发生、发展过程,并影响着骨肉瘤患者的治疗效果与预后。随着分子生物学手段的不断发展和完善,p53基因将在骨肉瘤的基因治疗中体现出不可估量的协同作用。本研究旨在采用脂质体介导的转染方法将外源性野生型p53基因导入体外培养的人骨肉瘤细胞株U-2 OS细胞中使其稳定表达,为进一步研究野生型p53基因在骨肉瘤自杀基因治疗中的协同作用奠定基础。
1 材料与方法
1.1 质粒、菌种和细胞株 野生型p53基因cDNA片段、表达载体pIRES-EGFP以及大肠杆菌BL21细胞均购自武汉三鹰生物技术有限公司;人骨肉瘤U-2 OS细胞购自南京凯基生物科技发展有限公司。
1.2 主要试剂 PCR上下游引物、dNTP、PCR产物纯化试剂盒、胶回收纯化试剂盒均购自上海赛百盛基因技术有限公司;Taq DNA聚合酶、限制性内切酶Eco RⅤ和NotⅠ、T4 DNA连接酶、蛋白质分子量标准混合物λDNA/Hin dⅢ均购自加拿大Fermentas公司(MBI);质粒提取纯化试剂盒购自FavorPrep公司;Lipofectamine2000转染试剂盒购自美国Invitrogen公司;小牛血清购自杭州四季青生物工程材料有限公司。
1.3 方法
1.3.1 野生型p53基因cDNA片段的扩增 设计一对特异性引物(5'-TTTT GATATC ATG GAG GAG CCG CAG TCA G-3';5'-TTTT GCGGCCGC AGA ATG TCA GTC TGA GTC AGG-3'),以野生型p53基因cDNA片段为模板,用德国Eppendorf PCR扩增仪按常规条件(每25μl反应体系中加入cDNA 2 μl,经94 ℃变性2.5 min,55 ℃退火30 s,72 ℃扩增1.5 min,25个循环;72 ℃ 扩增 5 min,4 ℃ 下保存)完成目的条带的扩增。经1%琼脂糖凝胶电泳检测目的片段,PCR产物纯化试剂盒纯化后,-20℃下保存。
1.3.2 重组质粒pIRES-EGFP-p53的构建 p53基因cDNA片段扩增、纯化后,将回收的目的片段与载体pIRES-EGFP分别用限制性内切酶Eco RⅤ和NotⅠ进行双酶切(酶切体系20μl:DNA 10μl,酶切缓冲液2 μl,限制性内切酶1 μl,无菌三蒸水 7 μl,目的片段37℃温浴8 h,表达载体37℃温浴3 h),酶切后经琼脂糖凝胶电泳检测,胶回收纯化试剂盒纯化后,将p53基因酶切片段与载体pIRES-EGFP酶切片段混合,用T4 DNA连接酶在22℃、4 h条件下,将二者连接形成重组质粒。
1.3.3 感受态大肠杆菌BL21的制备与转化 取一新鲜E.coli BL21菌落转接到含30 ml LB液体培养基的三角烧瓶中,37℃水浴振荡(250 r/min)培养5 h,取10 ml振荡菌液于冰浴中10 min,4 000 r/min离心5 min,收集菌体于10 ml无菌塑料离心管中;加入10 ml预冷的75 mmol/L CaCl2冰浴10 min,4 000 r/min二次离心5 min,再次收集菌体加入0.6 ml预冷的75 mmol/L CaCl2,置冰上作为受体菌菌液。取100μl受体菌菌液于1.5 ml无菌离心管中,依次加入 NTE缓冲液(10 mmol/L NaCl,10 mmol/L Tris-HCl,1 mmol/L EDTA,pH8.0)40 μl,重组质粒(pIRES-EGFP-p53)DNA 5μl置42℃水浴中2 min,再转到37℃水浴中5 min,然后加入500μl LB液体培养基,37℃水浴振荡(200 r/min)培养1 h,将培养物倒在含氨苄青霉素(Amp’50μg/ml)的LB琼脂上,并用涂布棒将菌液均匀涂布于整个平板表面;待表面水分吸收后,倒置放入37℃恒温培养箱中培养过夜。
1.3.4 重组质粒 pIRES-EGFP-p53的扩增与鉴定筛选转化阳性菌落,用质粒提纯试剂盒小量制备重组质粒DNA,德国Eppendorf PCR扩增仪按常规条件(每25μl反应体系中加入cDNA 2μl,经94℃变性2.5 min,55 ℃退火30 s,72 ℃延伸1.5 min,25个循环;72℃延伸5 min,4℃下保存)完成重组质粒DNA的扩增。经1%琼脂糖凝胶电泳检测目的片段,PCR产物纯化试剂盒纯化后,将重组质粒送上海生工生物工程技术有限公司鉴定测序。
1.3.5 重组质粒 pIRES-EGFP-p53的提取与纯化于50 ml离心管中加入10 ml的PEQ缓冲液平衡PM Maxi柱。取50 ml菌液4 000 r/min离心15 min收集大肠杆菌BL21,并依次加入PM 1、2、3缓冲液重悬并裂解细胞,9 000 r/min二次离心20 min,转移上清到平衡过的PM Maxi柱子中,静置待上清在重力作用下流干后,加入30 ml的PW 缓冲液,再次静置并丢弃废液。将PM Maxi柱置于一新的50 ml离心管中,先后加入PEL缓冲液及异丙醇溶液溶解并沉淀重组质粒DNA,12 000 r/min再次离心10 min,弃上清,75%乙醇洗涤并灭菌数次后,无菌TE溶解备用。
1.3.6 人骨肉瘤细胞株U-2 OS的培养与转染 人骨肉瘤U-2 OS细胞用含10%小牛血清的RPMI 1640培养液,在37℃条件下5%的CO2培养箱中贴壁培养。另取5μl重组质粒DNA与45μl无血清培养基混合得A液,再取5μl脂质体与45μl无血清培养基混合得B液,将A液与B液混匀,室温下放置30 min以形成脂质体-DNA复合物。参照Lipofectamine2000转染试剂盒使用说明将重组质粒DNA转染入U-2 OS细胞中,此后每5 d更换一次培养液,2周后荧光显微镜下挑选阳性细胞克隆并扩大培养。
1.3.7 人骨肉瘤细胞株U-2-p53 OS的筛选与鉴定荧光显微镜下人工挑选表达绿色荧光的阳性细胞克隆并扩大培养,筛选至少3次后得到稳定转染野生型p53基因的人骨肉瘤细胞株U-2-p53 OS。
2 结果
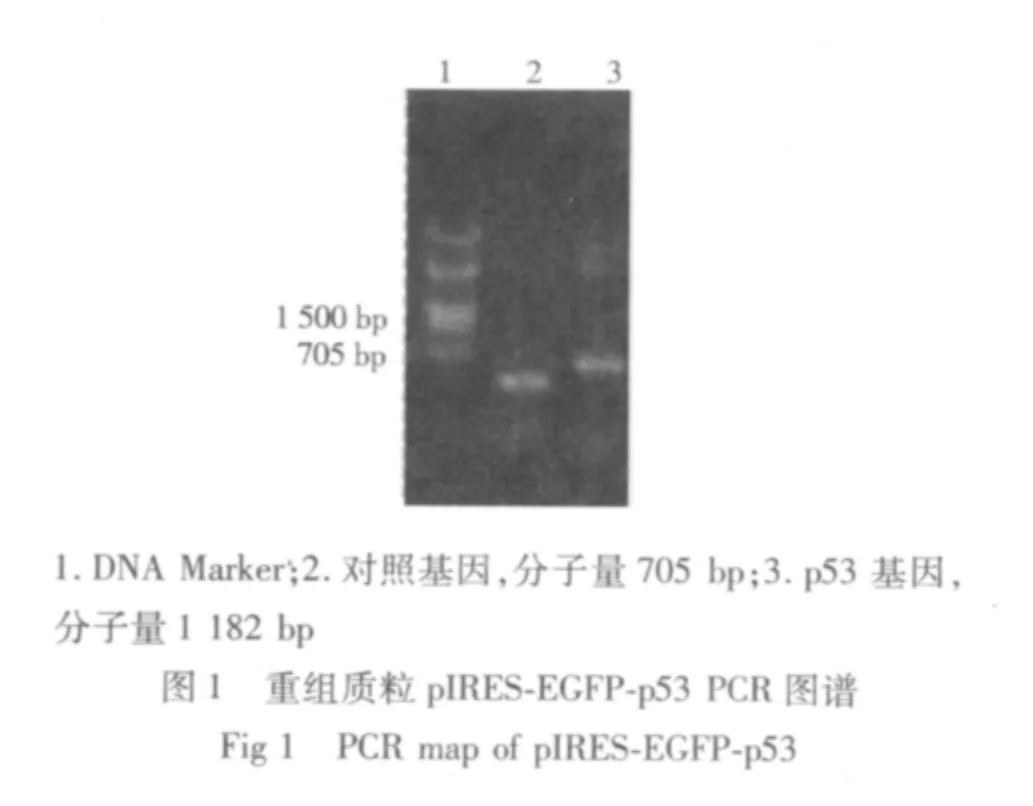
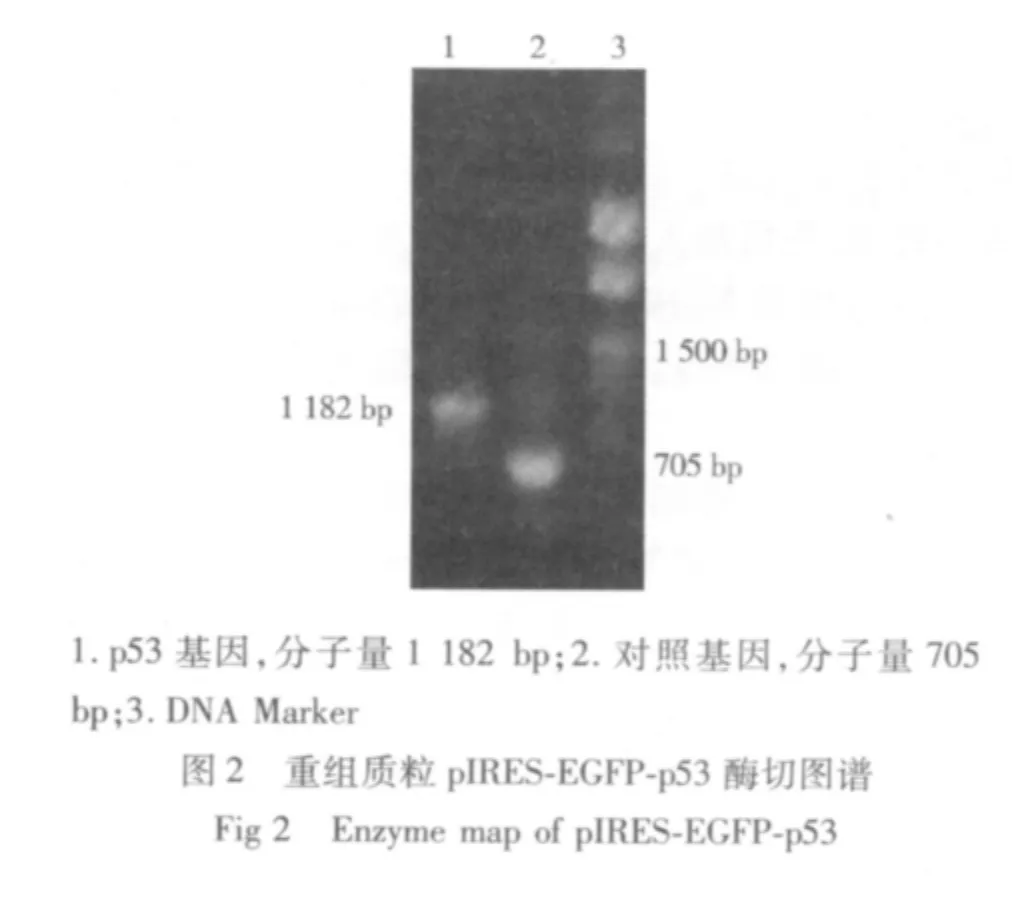
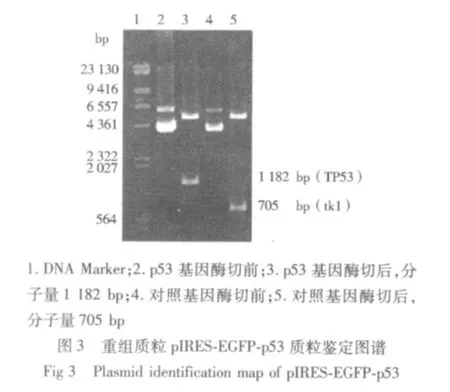
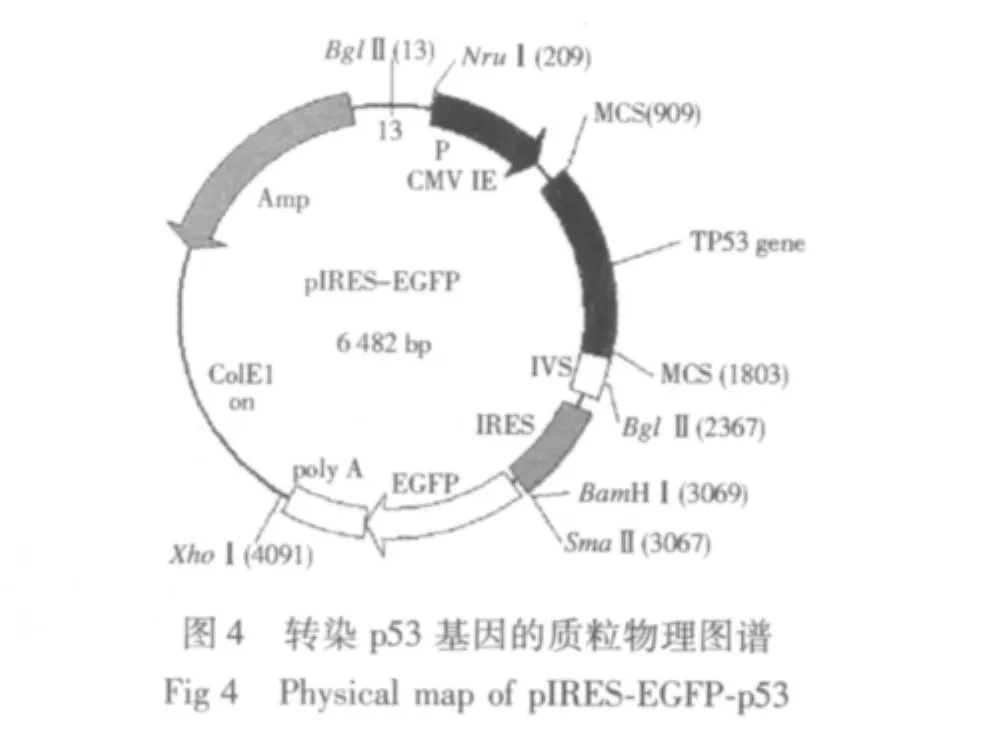
2.1 人骨肉瘤细胞株U-2 OS的转染结果 成功地构建出包含有野生型p53 cDNA片段的重组质粒pIRES-EGFP-p53,通过PCR、酶切电泳等方法鉴定质粒大小和位点均符合实验设计(见图1-4);并将该重组质粒成功导入人骨肉瘤细胞株U-2 OS细胞中,经荧光显微镜下人工筛选得到稳定转染的骨肉瘤细胞系,命名为U-2-p53 OS。
2.2 人骨肉瘤细胞株U-2-p53 OS的形态学观察转染48 h后观察骨肉瘤细胞,发现空白对照组(U-2 OS细胞)的细胞形态无明显变化,而阳性对照组(U-2-p53 OS细胞)则由转染前密集排列的多角形、星形细胞转变为排列稀疏的长梭形细胞,瘤细胞生长速度较前明显放缓,其中可见散在的凋亡细胞。
3 讨论
p53基因是肿瘤抑制基因家族中的重要一员,其在生命活动过程中具有调控细胞周期、诱导细胞凋亡、维持细胞基因组稳定以及抑制肿瘤生长等诸多生物学功能[3,4]。人类50%以上的恶性肿瘤发生发展过程中存在着p53基因突变和p53蛋白过度表达[2,5]。为研究野生型p53基因在骨肉瘤自杀基因治疗中的协同作用,首先要使外源性p53基因高效、稳定表达于所研究的骨肉瘤细胞中去。本实验通过Lipofectamine2000脂质体介导的转染方法,成功地将重组质粒pIRES-EGFP-p53导入人骨肉瘤细胞株U-2 OS中,筛选获得了稳定表达外源性野生型p53基因的U-2-p53 OS细胞系。该方法简单稳定、转染率高、重复性好,建立的外源性野生型p53基因转染人骨肉瘤细胞株的体外实验模型,为进一步研究野生型p53基因对骨肉瘤细胞生长抑制和诱导凋亡的机制奠定了基础。
[1]邹利军,杨述华,李进,等.单启动子p53/p14ARF非融合表达载体的构建及其在MG-63中的表达鉴定[J].医学分子生物学杂志,2007,4(3):234-239.
[2]黄永红,徐方云,王红梅,等.稳定表达外源性p53基因U14细胞系的建立及鉴定[J].江西医学院学报,2006,46(5):27-32.
[3]关婷,崔满华,李守柔,等.卵巢癌的p53基因治疗实验研究——人野生型p53基因真核细胞表达质粒的构建[J].白求恩医科大学学报,2000,26(4):354-355.
[4]钟叔平,曹亮,吴文翰.人野生型p53cDNA的克隆、表达和意义[J].中国病理生理杂志,1999,15(5):385-388.
[5]廖志红,赖祥进,曹林枝,等.pU HD10-3-p53质粒的扩增及分离纯化[J].广西医科大学学报,2006,23(4):555-556.
[6]韩鹏飞.抑癌基因在骨肉瘤中的研究[D].太原:山西医科大学,2009.
