Hemin诱导大鼠肝脏HO-1表达对非酒精性脂肪性肝炎的保护作用
2012-11-20赵曙光闻勤生
赵 丽, 赵曙光, 张 蓉, 闻勤生
(第四军医大学唐都医院消化内科, 西安 710038;*通讯作者,E-mail:wenqsss@yahoo.com.cn)
非酒精性脂肪性肝病(non-alcoholic fatty liver disease,NAFLD)包括单纯性脂肪肝、非酒精性脂肪性肝炎(non-alcoholic steatohepatitis,NASH)、肝硬化和肝癌,是临床常见的慢性肝病。NASH是NAFLD的一种类型,是由单纯性脂肪肝发展至肝纤维化、肝硬化甚至肝癌的关键转折点[1]。然而,NASH发病机制复杂,至今尚未完全阐明,目前公认的“二次打击”学说认为氧化物和抗氧化剂之间失衡造成的氧化应激及大量活性氧(reactive oxygen species,ROS)氧化不饱和脂质引起的脂质过氧化均可导致NASH的发生及发展。其中,氧化应激为单纯性脂肪肝进展为NASH的始动环节。近年来研究显示血红素加氧酶1(heme oxygenase-1,HO-1)对氧化应激所致的肝细胞损伤有保护作用[2]。脂肪变肝细胞的抗氧化防御能力较正常肝细胞显著降低,HO-1的外源性调节可能有助于减轻脂肪性肝损伤,延缓或阻止NASH的进展。本实验通过高脂饮食建立大鼠NASH模型,用HO-1诱导剂氯化血红素(hemin)进行干预,观察上调HO-1表达对肝脏氧化应激及肝功能相关指标的影响,探讨HO-1对NASH的保护作用。
1 材料与方法
1.1 主要试剂 Hemin购自南京建成生物有限公司;牛胆盐、胆固醇均购自北京奥博星生物技术责任有限公司;丙二醛(malondialdehyde,MDA)和谷胱甘肽(glutathione,GSH)试剂盒均购自南京建成生物有限公司;兔抗HO-1多克隆抗体购自美国Abzoom公司;羊抗兔IgG抗体(二抗)购自北京博奥森公司。
1.2 动物及分组 清洁级SD雄性大鼠24只,12周龄,体重(200±30)g,由第四军医大学实验动物中心提供。适应性喂养1周后随机分为对照组,模型组和hemin干预组,每组8只。对照组给予普通饲料,模型组及干预组给予髙脂饮食共8周。之后对照组继续普通饲料喂养,模型组继续髙脂饮食喂养,干预组给予髙脂饮食加每日hemin 15 mg/kg腹腔注射,共10 d。第10天处死大鼠,进行相关指标的检测。
1.3 大鼠NASH模型建立 参考钟岚等[3]方法配成高脂饲料(在普通饲料基础上加10%猪油、2%胆固醇及0.5%牛胆盐)。共喂养8周。
1.4 观察指标方法
1.4.1 肝组织病理学检测 肝脏右叶留取部分组织,浸泡于10%甲醛溶液中固定,石蜡包埋,切片,HE染色,光镜下观察。
1.4.2 肝功能检测 大鼠心脏内取血,常规分离血清,用全自动生化分析仪检测ALT、AST的变化。
1.4.3 GSH和MDA的检测 大鼠血浆,按照试剂盒说明分别用紫外分光光度法在不同波长下测定GSH、MAD水平。
1.4.4 Western blot检测肝脏 HO-1的表达 取蛋白样品经10%SDS聚丙烯酰胺凝胶电泳90 min,再以65 v转膜2 h将凝胶上的蛋白转移到PVDF膜上。取出转移膜置于封闭液中,室温、摇床上缓慢摇动状态下封闭1 h。滴加抗HO-1一抗(1∶1 000)4℃过夜,过夜后复温至室温,TBST缓冲液反复洗膜10 min×3次。将二抗用1×TBST稀释3 000倍,将洗涤后的一抗反应膜放入二抗工作液中(室温、避光缓慢摇动)作用60 min,用1×TBST洗膜,方法同上,洗去游离二抗。在暗室中向膜滴加发光液,室温作用4 min,曝光完成后将膜用PBST洗10 min,用膜再生液洗涤30 min,再用PBST洗3×10 min,将膜封闭后GelDoc凝胶成像仪采集图像。
2 结果
2.1 病理学变化 对照组大鼠肝脏无明显肿大,外观色泽呈红褐色,无明显异常;模型组大鼠肝脏明显肿大,外观色泽黄腻,偶可见局部白色变性灶,边缘圆钝,切面油腻;hemin干预组肝脏色泽、质地、体积较模型组均有所改善。光镜下观察,对照组大鼠肝组织结构完整、清晰,肝小叶结构正常,肝细胞排列成肝索,在中央静脉周围呈放射状分布,细胞呈多边形;模型组大鼠部分肝细胞内可见脂滴聚积,见少量炎细胞浸润,多位于汇管区,以淋巴细胞为主;hemin干预组脂肪变性及炎症表现均轻于模型组(见图1,见237页)。
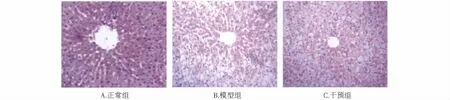
图1 各组大鼠肝脏病理学改变Fig 1 The pathological changes in rat liver tissues of different groups
2.2 血清 ALT、AST、MDA、GSH 变化 模型组ALT、AST、MDA 较对照组显著升高(P<0.01),hemin干预组ALT、AST、MDA较模型组显著降低(P<0.01),但干预组水平仍高对照组(P<0.01);模型组GSH较对照组显著降低(P<0.01),hemin干预组GSH较模型组显著升高(P<0.01),但干预组仍低于对照组(P<0.01,见表1)。
表1 各组血清AST、ALT、MDA和GSH水平比较(±s)Tab 1 Comparison of serum AST,ALT,MDA and GSH among different groups(±s)
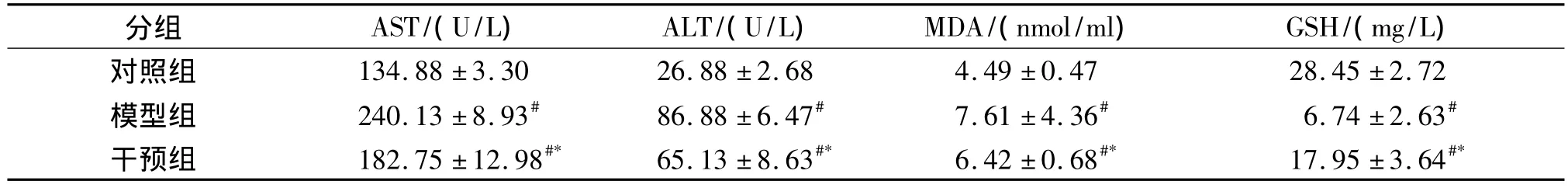
表1 各组血清AST、ALT、MDA和GSH水平比较(±s)Tab 1 Comparison of serum AST,ALT,MDA and GSH among different groups(±s)
与对照组比较,#P<0.01;与模型组比较,*P<0.01
干预组 182.75±12.98#* 65.13±8.63#* 6.42±0.68#* 17.95±3.64#*
2.3 肝脏HO-1表达的变化 Western blot检测各组大鼠肝脏HO-1表达,结果显示正常对照组大鼠肝脏组织中HO-1仅少量表达,模型组大鼠肝脏组织中HO-1的表达轻度增加,Hemin干预组大鼠肝脏组织中HO-1的表达较对照组及模型组均明显增加(见图2)。
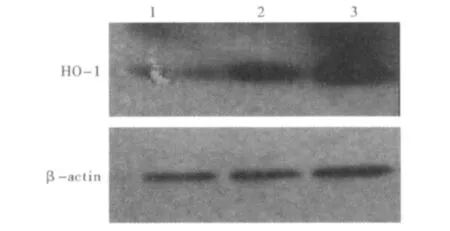
图2 Western blot检测各组大鼠肝脏HO-1的表达Fig 2 The expression of HO-1 by Western-blot in rat livers
3 讨论
非酒精性脂肪性肝病(NAFLD)的发病率呈逐年上升趋势,与高血压、高血脂、2型糖尿病等并列成为代谢综合征的重要组成部分。NAFLD包括单纯性脂肪肝、非酒精性脂肪性肝炎(non-alcoholic steatohepatitis,NASH)、肝硬化和肝癌,是临床常见的慢性肝病。NASH是NAFLD发病过程向更严重疾病发展的关键转折点[4]。有关NASH的发病机制以Day等[5]的“二次打击”理论最为普遍。初次打击是指在胰岛素抵抗及继发的高胰岛素血症基础上,出现大量游离脂肪酸(FFA)输入肝脏导致肝脏脂质沉积。第二次打击为过量的FFA沉积诱发氧化应激,进一步引起脂质过氧化产生大量活性氧,ROS的增加刺激单核巨噬细胞、枯否细胞和肝细胞等凋亡增加并异常释放炎性细胞因子,引起生物膜反应,导致线粒体肿胀、变性及通透性增加,肝细胞变性、坏死、炎性细胞浸润和纤维化形成,从而产生脂肪性肝炎。其中,氧化应激为单纯性脂肪肝进展为NASH的始动环节。
对HO-1的研究已有几十年的历史,以往认为HO-1的作用是催化血红素在机体内氧化降解,维持血红素代谢平衡,近年来认为其在氧化应激中具有重要作用[6]。HO-1是胆红素形成过程中的第一种酶,也是一种限速酶,它在NADPH、细胞色素P450还原酶和氧存在的情况下能氧化血红素生成一分子胆绿素,一分子一氧化碳以及一分子铁离子[7],随后胆绿素在胆绿素还原酶作用下生成胆红素,所产生的胆绿素及胆红素具有较维生素E更强的抗氧化作用,在体内对氧化损伤有明显的保护作用,对抗氧化应激而保护细胞[8]。HO-1活性的增高可促进运铁蛋白的合成,通过增加细胞内铁的流出而具有细胞保护作用[9]。近年来许多动物实验证明,诱导HO-1表达有助于机体对氧化应激和缺血再灌注损伤的保护。
本实验中,采用hemin大鼠腹腔注射方法,观察其对大鼠肝脏HO-1的诱导表达作用。hemin既是HO-1的底物,又是HO-1的促进剂,能诱导HO-1基因表达。肝组织学检查结果显示hemin干预组大鼠肝组织较模型组脂肪变性及炎症表现明显减轻。Western blot检测模型组HO-1表达较正常组稍增加,hemin干预组大鼠肝脏HO-1表达较正常组及模型组明显增加。MDA作为脂质过氧化产物之一,可以反映体内脂质过氧化的程度。GSH的活性成分为还原型谷胱甘肽,参与体内氧化还原过程同时还可对抗自由基对重要脏器的损害,保护细胞膜中含巯基的蛋白质和含巯基酶不被破坏,同时还可对抗自由基对重要脏器的损害。两者均反映机体氧化损伤程度。AST、ALT均反映肝脏组织受损程度。实验结果显示模型组MDA、AST、ALT明显较对照组增加,干预组介于两者之间。模型组GSH较对照组降低,干预组介于两者之间。实验结果表明hemin能诱导HO-1的表达并减轻髙脂饮食引起的肝脏氧化应激水平,从而起到对NASH保护作用。
本实验发现hemin诱导大鼠肝脏HO-1的表达,对大鼠NASH有保护作用。其机制可能与诱导HO-1表达能够减轻髙脂饮食引起的肝脏组织氧化应激水平,从而改善肝脏组织学及肝功能改变。此实验结果为以HO-1为靶点进行NASH防治提供新的实验基础及理论依据。
[1]Ludwig J,Viggiano TR,McGill DB,etal.Nonalcoholic steatohepatitis:Mayo Clinic experienceswith a hitherto unnamed disease[J].Mayo Clin Proc,1980,55(7):434-438.
[2]Babu AN,Damle SS,Moore EE,etal.Hemoglobin based oxygen carrier induces hepatic heme oxygenase 1 expression in Kupffer cells[J].Surgery,2007,1 42(2):289-294.
[3]钟岚,范建高,王国良,等.非酒精性脂肪性肝炎动物模型的建立[J].中华实用医学,2000,2(1):3-6.
[4]Zou Y,Li J.High-fat emulsion-induced rat model of nonalcoholic steatohepatitis[J].Life Sci,2006,79(11):1100-1107.
[5]Day CP,James OF.Steatohepatitis:a tale of two“hits”[J]?Gastroenterology,1998,114(4):842-845.
[6]Pae HO,Oh GS,Choi BM,etal.Carbon monoxide produced by heme oxygenase-1 suppresses T cell proliferation via inhibition of IL-2 production[J].J Immunol,2004,172(8):4744-4751.
[7]Otterbein LE,ChoI AM.Heme oxygenase:colors of defense against cellular stress[J].Am J Physiol Lung Cell Mol Physiol,2000,279(6):1029-1037.
[8]Kim YS,Zhuang H,Koehler RC,etal.Distinct protective mechanisms of HO-1 and HO-2 against hydroperoxide-induced cytotoxicity[J].Free Radic Biol Med,2005,38(1):85-92.
[9]赵武述.免疫平衡研究及其临床意义[M].北京:科学出版社,2005:90.
