糖尿病加剧小鼠脑缺血后脑内自噬活性的增高
2012-11-20王红梅孙晓江上海交通大学附属第六人民医院神经内科上海200233
张 婷 王红梅 李 强 孙晓江 (上海交通大学附属第六人民医院神经内科,上海 200233)
自噬是细胞对于环境变化的有效反应,维持细胞代谢的转换及动态平衡,对新陈代谢起着举足轻重的作用,可以作为一种防御机制清除胞质内受损的细胞器、代谢产物及病原体,进行亚细胞水平上的重构,保护受损的细胞。然而,自噬过度激活可以诱导细胞程序性死亡,称为Ⅱ型程序性细胞凋亡,从而引起一系列的疾病〔1,2〕。一些观点认为在缺血早期,脑内自噬途径过度激活是有害的〔3〕,但有的观点认为这是机体的潜在保护机制〔4〕。本文采用实验性动物模型,观察DM小鼠短暂性脑缺血引起的脑内自噬活性的改变。
1 对象与方法
1.1 实验动物 选择C57BL/6小鼠及沙士鼠。
1.2 方法
1.2.1 实验性DM小鼠模型 在实验开始时,实验动物随机分为四组:假手术(Sham)组、脑缺血(VO)组,DM-假手术(DMSham)组和 DM-脑缺血(DM-VO)组。参照 Zhang等方法〔5〕,以腹腔注射链脲佐菌素(STZ)诱导DM模型动物;同龄正常对照小鼠腹腔注射空白对照溶液(柠檬酸缓冲液,pH4.2)。STZ注射4 w后,小鼠尾端采血,Roch血糖仪及试纸检测血糖,以空腹血糖>8.0 mmol/L作为DM诱导成功的判断标准。选择符合条件的DM小鼠进行后续试验。
1.2.2 短暂性脑缺血模型的制作 C57BL/6小鼠及沙土鼠缺乏后交通动脉及完整的基底动脉环,两侧大脑供血相对独立,通过闭塞一侧或双侧颈动脉即可复制效果明显的同侧或双侧脑缺血模型〔6〕,所以双侧颈总动脉夹闭(CCAO)术被广泛用于中风病理机制研究。术前2 h禁食,自由饮水。以10%水合氯醛麻醉成功后,仰卧固定于手术台上,颈部皮肤剪毛备皮,碘酒酒精消毒,以无菌器械沿颈部正中切开皮肤及皮下组织,暴露颈部肌肉后,在一侧颈前肌肉和侧方肌肉间隙钝性分离该侧颈总动脉,并避免损伤伴随颈总动脉行走的迷走神经,以同样方法分离对侧颈总动脉,以2个小号外科血管夹分别夹毕双侧颈总动脉。双侧颈总动脉同时夹毕30 min后,松开血管夹,使血流再通,伤口内撒入少许青霉素,间断缝合皮肤,缝合完毕后酒精消毒伤口。术后送回笼中饲养。
1.2.3 透射电镜 取分离脑组织用震动切片机切成超薄切片(100 nm),参照文献〔7〕进行后续处理。采用JEOL JEM-1230透射电镜(JEOL,Japan)进行观察。
1.3 统计学方法 应用SPSS11.5统计软件进行分析,所有数据均采用s表示,多组间比较采用单因素方差分析,用LSD法进行两两比较。
2 结果
2.1 各组小鼠血糖水平比较 STZ处理后4 w,与非DM小鼠〔Sham 组(6.4±0.3)mmol/L〕,VO组(5.6±0.5)mmol/L,n=8)〕比较,DM小鼠血糖水平显著升高〔(DM-Sham组(17±1.4)mmol/L,DM-VO 组(14.2 ± 1.2)mmol/L,n=8,P<0.05〕。更重要的是,STZ治疗4 w后,与非DM小鼠对比,DM小鼠表现出多饮、多尿、多食和体重下降。
2.2 电镜检查自噬体形态 Sham组内质网、线粒体和突触等细胞器形态正常,细胞质内囊泡样小体(V)、自噬溶酶体(al)、环形多层膜结构(avm)以及自噬囊泡样电子致密物(avd)表达很少。而DM-VO组细胞质内V、al、avm以及avd表达显著增高。见图1。
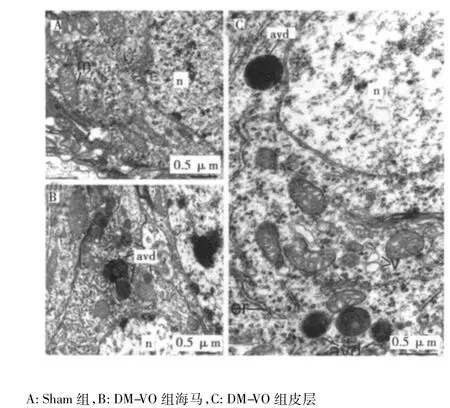
图1 DM脑缺血实验小鼠脑内自噬体的表达
2.3 各组自噬活性标记物LC3-Ⅱ表达水平 通过免疫印迹方法检测CCAO后实验动物在1 d、2 d、3 d及1 w时脑内LC3-Ⅱ的表达水平,与Sham组相比,缺血后LC3-Ⅱ表达增高,持续至少3 d。与Sham组比较,VO组在1 d(LC3-Ⅱ/LC3-Ⅰ 比率:皮层9.5±1.0,海马11.1±1.6,n=4)表达接近高峰,DM-Sham组(LC3-Ⅱ/LC3-Ⅰ 比值:皮层1.4 ±0.1,海马3.8 ±1.0,n=5)LC3-Ⅱ表达增高,DM-VO组(术后1 d时LC3-Ⅱ/LC3-Ⅰ比值:皮层3.1±0.5,海马1.3±0.1,n=4)较VO组LC3-Ⅱ表达显著增高(P<0.05)。
3 讨论
近年来自噬受到科学界的重视,2004年《科学》杂志曾对2005年科技领域将要发生的六件大事进行了预测,自噬作用研究位列第一。随着近年来对自噬机制的深入研究,已经验证了《科学》杂志当年的预测,发现其与很多疾病有密切的联系,诸如神经退行性病变、肿瘤、心肌病、病原微生物侵入感染以及老化等。自噬-溶酶体途径是真核细胞对于外界环境营养物质变化的一种适应性机制。细胞在营养物质贫乏的情况下,自噬途径被激活,从而代谢出一些基本的营养物质。在细胞老化过程中,不断产生有错误折叠的蛋白质、有害的代谢产物或是老化的细胞器如线粒体等。在病理生理情况下,自噬溶酶体途径调控短寿命和长寿命蛋白、细胞器降解,从而保证蛋白质正常工作,维持细胞的正常功能和生存,改善实验动物的行为学表现〔8〕。而电镜检查自噬体形态是检验自噬活性的金标准。本研究中,通过电镜和免疫印迹方法发现,DM-VO组细胞质内V、al、avm以及avd表达增高最为显著。自噬活性与应激相关,提示脑缺血(尤其是DM脑缺血)后脑内应激水平增高。
1 Levine B,Yuan J.Autophagy in cell death:an innocent convict〔J〕?J Clin Invest,2005;115(10):2679-88.
2 Klionsky DJ,Emr SD.Autophagy as a regulated pathway of cellular degradation〔J〕.Science,2000;290(5497):1717-21.
3 Puyal J,Vaslin A,Mottier V,et al.Postischemic treatment of neonatal cerebral ischemia should target autophagy〔J〕.Ann Neurol,2009;66(3):378-89.
4 Carloni S,Buonocore G,Balduini W.Protective role of autophagy in neonatal hypoxia-ischemia induced brain injury〔J〕.Neurobiol Dis,2008;32(3):329-39.
5 Zhang T,Liu X,Li Q,et al.Exacerbation of ischemia-induced amyloidbeta generation by diabetes is associated with autophagy activation in mice brain〔J〕.Neurosci Lett,2010;479(3):215-20.
6 Fujii M,Hara H,Meng W,et al.Strain-related differences in susceptibility to transient forebrain ischemia in SV-129 and C57black/6 mice〔J〕.Stroke,1997;28(9):1805-10.
7 Martone ME,Jones YZ,Young SJ,et al.Modification of postsynaptic densities after transient cerebral ischemia:a quantitative and three-dimensional ultrastructural study〔J〕.J Neurosci,1999;19(6):1988-97.
8 Ravikumar B,Vacher C,Berger Z,et al.Inhibition of mTOR induces autophagy and reduces toxicity of polyglutamine expansions in fly and mouse models of Huntington disease〔J〕.Nat Genet,2004;36(6):585-95.
