单向灌流法评价栀子厚朴汤方剂配伍对栀子苷肠吸收的影响*
2012-11-20汪汀,冯芳,2**
汪 汀 ,冯 芳 ,2**
中国药科大学 1药物分析教研室;2药物质量与安全预警教育部重点实验室,南京 210009
栀子厚朴汤出自《伤寒论》[1],由栀子、厚朴、枳实三味药材组成。方中栀子苦寒,清热除烦;厚朴苦温,行气消滞;枳实苦寒,破结消痞。栀子厚朴汤作为重要的抗焦虑方剂开始受到人们越来越多的关注。方中栀子药材具有抗焦虑[2]、抗抑郁[3]相关药理作用已见报道。本实验室前期关于栀子厚朴汤药效物质研究结果也表明,方中栀子药材在抗抑郁药效中发挥着一定作用[4]。但其活性成分栀子苷的极性较大,根据经典理论推测为吸收较差物质[5],这可能是其生物利用度低的主要原因之一。本文以栀子中主要活性成分栀子苷为指标,考察了栀子提取物、栀子与枳实、厚朴配伍以及栀子厚朴汤全方使用后的栀子苷的肠吸收变化,探讨中药复方用药与单味用药的吸收差异,说明中医复方配伍用药的科学性。
1 材 料
1.1 仪器
LC-2010C高效液相色谱仪、LC-solution工作站(岛津,日本);TGL-16B型高速离心机(上海安亭科学仪器厂);Libror AEC-210电子天平(岛津,日本)。
1.2 药材与试剂
栀子 (产地江西,批号:091222,南京建军药店);枳实(产地江西,批号:100118,南京先声药店);厚朴(产地四川,批号:100109,南京先声药店)。以上药材经中国药科大学秦民坚教授鉴定:栀子为茜草科植物栀子 (Gardenia jasminoides Ellis.)的干燥果实;枳实为芸香科植物酸橙(Citrus aurantium L.)的干燥幼果;厚朴为木兰科植物厚朴(Magnolia officinalis Rehd.Et Wils.)的干燥树皮、根皮及枝皮。以上三味药材粉碎,过60目筛,待用。
栀子苷对照品(纯度≥98.0%,成都康邦生物技术有限公司);甲醇(色谱纯,江苏汉邦科技有限公司);其余试剂均为市售分析纯;Krebs-Ringer's试剂(简称K-R液)自配;水为纯净水。
1.3 动物
健康 SD 大鼠(普通级),雄性,(200±20)g,购自南京青龙山动物养殖中心,合格证号:SCXK(苏)2012-0001。
2 方 法
2.1 汤剂的准备
2.1.1 栀子厚朴汤取栀子9 g、枳实10 g、厚朴62.4 g,加 10 倍量(1∶10,w/v)水浸泡 0.5 h 后,武火煮沸、文火煎煮1 h,如此再分别以8倍量、5倍量水同法煎煮,合并3次煎煮滤液,适当浓缩后转移至200 mL量瓶中,用水定容,即得栀子厚朴汤(ZZHPD)。
2.1.2 方药不同配伍汤剂A:栀子9 g;B:栀子(9 g)-枳实(10 g);C:栀子(9 g)-厚朴(62.4 g)。 分别按与ZZHPD相同煎煮方法制备,即得栀子汤剂(ZZ);栀子-枳实汤剂(ZZ-ZS);栀子-厚朴汤剂(ZZ-HP)。
2.1.3 汤剂中栀子苷含量测定ZZHPD及其不同配伍汤剂中栀子苷的含量测定参考文献[6]。
2.2 栀子厚朴汤及方药不同配伍栀子苷肠吸收参数的测定
2.2.1 对照品溶液的配制取栀子苷对照品适量,置10 mL量瓶中,加甲醇溶解并稀释配制成浓度为10mg·mL-1的对照品贮备液。分别精密移取储备液适量,加甲醇稀释,制得栀子苷浓度分别为1000、800、600、400、200、100 μg·mL-1的系列栀子苷对照品溶液。
2.2.2 肠灌流液的配制按照“2.1”项下方法准备栀子厚朴汤以及方药不同配伍汤剂,并计算各汤剂中栀子苷含量,分别量取ZZ、ZZ-ZS、ZZ-HP、ZZHPD汤剂适量,置100 mL量瓶中,加K-R液稀释至刻度, 得到栀子苷含量约为65 μg·mL-1的ZZ、ZZZS、ZZ-HP、ZZHPD 肠灌流液。
2.2.3 色谱条件色谱柱:Phceda C18柱(250 mm×4.6 mm,5 μm);流动相:甲醇(A)-0.1%乙酸水溶液(B),梯度洗脱,洗脱程序如下:30%A(0~16 min),30%~95%A(16~22 min),95%~30%A(22~27 min),30%A(27~30 min);流速:1.0 mL·min-1;检测波长:238 nm;柱温:25℃;进样量:20 μL。
2.2.4 在体单向肠灌流实验模型的建立[7-8]24只SD大鼠适应性饲养一周后,随机等分为4组,在灌流实验前禁食12 h,自由饮水。腹腔注射20%乌拉坦(5 mL·kg-1)麻醉,背位固定于手术台上,沿大鼠腹中线剪口约3 cm,打开腹腔,在所考察的试验肠段(从胃部幽门下行1 cm处开始沿小肠下行至盲肠上端1 cm的全段小肠)的两端处各剪一个小V型口,小心插入硅胶管并结扎,注意避免伤及血管,恰当摆向实验肠段使灌流液能流通顺畅为宜,伤口用浸有生理盐水的脱脂棉覆盖保湿,红外灯保温。以预热的生理盐水(37℃)从小肠上端开口轻缓冲洗肠道(方向勿相反),直至将小肠的内容物排除干净为止,通空气排净生理盐水,接着用预热的肠灌流液(37℃)进行在体单向灌流,以建立灌流体系,灌流方向要与肠道冲洗方向一致。实验开始前以实验灌流液(37℃)灌充肠段,以 0.2 mL·min-1的速度平衡 l h后,从第一滴供试液滴下开始计时,进口处用己知重量的装有实验灌流液的小瓶灌流,恒流泵保持流速不变,同时出口处放另一已知重量的小瓶收集流出肠液,每隔15 min迅速更换下一个称重好的盛有实验灌流液的小瓶和空的收集液小瓶,放冷至室温后,称量灌流液小瓶和收集液小瓶的重量,共收集8个时间段(K1~K8)的样品,实验持续时间为120 min。实验结束后,将大鼠小肠剪下,沿肠管剪开,平铺于坐标纸上,测量小肠长度与内径。本实验分别以栀子苷含量约为 65 μg·mL-1的 ZZ、ZZ-ZS、ZZ-HP、ZZHPD肠灌流液进行灌流,并收集每个时间段的灌流流出液,用已建立的HPLC法测定入口灌流液浓度,并分别测定每只动物收集到的8个时间段的出口灌流液中栀子苷的准确浓度。
2.2.5 肠灌流液样品处理准确量取200 μL空白肠灌流液样品或含药肠灌流液样品,加入200 μL甲醇,旋涡混匀,16000 r·min-1离心 20 min,取上清液,即得空白肠灌流液或含药肠灌流液的待测样品,进样20 μL,进行HPLC法分析。
2.2.6 大鼠肠吸收动力学参数计算与统计分析将肠灌流液样品按“2.2.5”项下方法处理,进样,记录色谱图,按外标法计算各时间段接收的肠灌流液中的栀子苷含量,以重量计算各组的吸收速率常数(Ka)和小肠有效渗透系数(Peff),并采用SPSS11.5统计软件对各组灌流液栀子苷的吸收参数进行t检验。公式为:

Cout和Cin分别为肠道流出液、灌入液的浓度(μg·mL-1),Qin为肠道入口灌流液的流量(mL·min-1),V为灌流肠段的体积(mL),A为灌流肠段的表面积(cm2),Vin和Vout分别为灌入和流出收集的灌流液体积(mL)。L为实验肠段的长度(cm),R为小肠半径(cm)(采用重量法计算,假设进出口的溶液密度一样,并用灌入液和流出液的质量分别表示灌入液和流出液的体积)。
3 结 果
3.1 专属性考察
按“2.2.4”项下方法制作大鼠在体小肠单向灌流模型,但肠灌流液为不含任何药物的K-R液,收集灌流流出液作为空白灌流肠液样品。按照“3.2”项下方法,制备含药灌流肠液,按“2.2.5”项下方法处理,进样,记录色谱图。结果表明:空白灌流肠液与汤剂中其他成分不干扰测定。见图1。
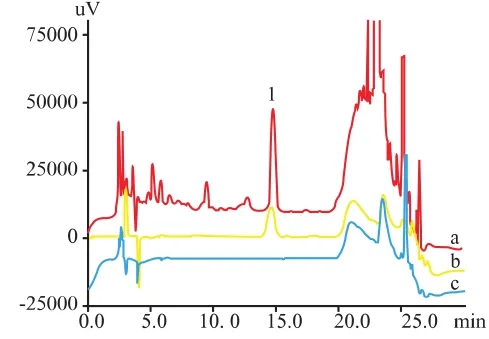
图1 专属性色谱图
3.2 标准曲线的制作和最低定量限
取大鼠空白灌流肠液6份,每份180 μL,分别加入栀子苷系列标准溶液20 μL,使含药肠灌流液栀子苷浓度为:10、20、40、60、80、100 μg·mL-1。 按“2.2.5”项下操作,同法处理空白灌流肠液进样,记录色谱图。以肠灌流液中栀子苷的质量浓度为横坐标(X),峰面积为纵坐标(Y),用最小二乘法进行回归运算,得线性方程为:Y=1.564×104X+3.313×102(r=0.9999)。 栀子苷的最低定量限为:10 μg·mL-1。
3.3 准确度、精密度与提取回收率
按照“3.2”项下“标准曲线的制作”方法处理,配制低、中、高三个不同浓度点(栀子苷的含量分别为20、50、80 μg·mL-1)的含栀子苷肠灌流液样品,每个浓度点平行配制5份样品,连续测定3天,并依据当日制作的标准曲线,计算各质量控制样品的日内及日间精密度和准确度。结果表明,本方法精密度和准确度符合生物样本测定要求(见表1)。
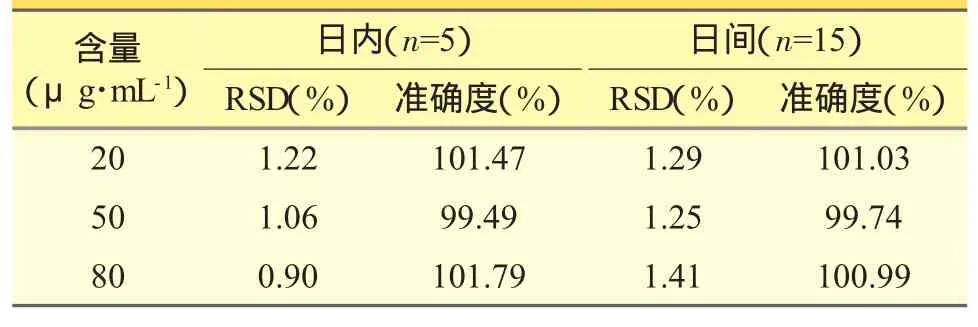
表1 含栀子苷肠灌流液样本HPLC法测定日内、日间精密度以及准确度结果
按照“3.2”项下“标准曲线的制作”方法处理,配制低、中、高三个不同浓度点(栀子苷的含量同上)的含栀子苷肠灌流液样品,按“2.2.5”项下方法处理,进样,以测得的峰面积与相应浓度标准品溶液进样所得峰面积相比较,计算提取回收率。结果表明,栀子苷在各质量浓度下的提取回收率分别为:94.86%、92.07%、91.93%。
3.4 稳定性试验
方法学稳定性试验主要考察空白肠灌流液加入栀子苷室温放置8 h,3次冻融循环,-20℃冰柜中放置10天的稳定性,以及处理后样本4℃进样器放置的稳定性。结果表明,样本在存储以及测定过程中稳定,样本处理后放置进样器内12 h无明显变化。
药物在灌流液中的稳定性实验主要考察栀子苷在肠灌流液中37℃保温前和保温后3 h的稳定性。结果表明,相同浓度的栀子苷在37℃肠灌流液中3 h内所测得的峰面积基本保持不变。
3.5 单味栀子与各配伍汤剂中栀子苷吸收的比较
采用重量法公式计算各组的吸收速率常数(Ka)和小肠有效渗透系数 (Peff), 实验结果 (见表2)经SPSS11.5统计软件进行t检验。结果:ZZHPD、ZZHP、ZZ-ZS灌流液组分别与ZZ灌流液组比较吸收参数均有显著性差异,表明栀子配伍枳实和/或厚朴对栀子苷的吸收有促进作用;ZZ-HP灌流液组与ZZ-ZS灌流液组相比较,吸收参数无显著性差异,表明枳实与厚朴对于栀子苷的吸收促进作用程度相当;ZZHPD灌流液中栀子苷的吸收程度较ZZ-HP灌流液组或ZZ-ZS灌流液组有所下降,表明栀子厚朴汤全方中栀子苷的吸收程度较单味栀子汤剂中栀子苷吸收程度的提高,可能是枳实或厚朴各自作用综合起效的结果。
表2 ZZ、ZZ-HP、ZZ-ZS、ZZHPD配伍对于肠灌流液中栀子苷的吸收速率常数(Ka)和有效渗透系数(Peff)的影响(n=6,±s)

表2 ZZ、ZZ-HP、ZZ-ZS、ZZHPD配伍对于肠灌流液中栀子苷的吸收速率常数(Ka)和有效渗透系数(Peff)的影响(n=6,±s)
注:与 ZZ 灌流液组比较,*P<0.05;Ka为 K1~K8的平均值
组别Ka(min-1,×10-3)Peff(cm·min-1,×10-4)ZZ灌流液 2.81±0.12 2.69±0.12 ZZ-HP灌流液 3.13±0.10* 3.02±0.11*ZZ-ZS灌流液 3.17±0.06* 3.06±0.06*ZZHPD灌流液 2.96±0.10* 2.83±0.10*
4 讨 论
本实验选用大鼠作为实验动物,并且根据人用剂量折算大鼠服药剂量。制备ZZ、ZZ-ZS、ZZ-HP、ZZHPD四组含有栀子的方药不同配伍汤剂[8],并对其中栀子苷含量进行测定,结果显示:四组汤剂中栀子苷含量分别为:1662.7、1725.9、1790.6、1622.4μg·mL-1。栀子厚朴汤用量是栀子药材9 g,以栀子厚朴汤全方即栀子苷含量1622.4 μg·mL-1计算。根据人与大鼠体表面积折算比例计算,人(60 kg)用剂量约为大鼠(200 g)给药剂量的1/6倍[9]。本实验采用的大鼠体重为(200±20)g,大鼠日用量约为 32.45 mg·kg-1,则 100 mL 灌流液的浓度约为 65 μg·mL-1。
中药为多种成分组成的共存体,含色素较多,可能会干扰紫外分光光度法测定肠灌流液中酚红浓度,因而不宜使用酚红法校正小肠对水分的吸收。另外,关于离子型药物酚红的小肠吸收研究已有相关报道[10],用其作为小肠不吸收物质进行肠灌流液体积矫正的方法会对实验造成误差。因此,本实验采用国际上常用的大鼠在体单向肠灌流模型,研究栀子厚朴汤方剂配伍对栀子苷吸收的影响,采用重量法校正。由于小肠对水分吸收所造成的灌流液体积变化,方法简便可行,稳定性和重复性好。重量法进行肠灌流过程中往往需要密度校正,因为灌流液是含有样品的一定浓度的盐溶液,而且经过小肠灌流,小肠会有分泌物或者小肠黏膜脱落,所以流出液的密度大于1。但是本实验用的灌流速度(0.2 mL·min-1)接近大鼠小肠正常的蠕动速度[11],小肠黏膜几乎不脱落,因此,灌流液流经肠道密度可以认为不发生变化。
许多研究表明,中药配伍有减毒增效作用,而中药配伍的研究主要集中在研究配伍改善活性成分的溶出和药理效应上,本文从吸收的角度研究了中药配伍的优效结果,结果显示,主要药效物质栀子苷在配伍汤剂中的小肠吸收参数与单味药材汤剂相比有明显的提高,提示中药配伍可增强某些活性成分的吸收。枳实中含有大量柚皮苷、橙皮苷、新橙皮苷等黄酮苷类成分,有报道称其在人体的吸收机制是经肠道菌群代谢为黄酮苷元后经肠道吸收入血[12],栀子苷与其有相似的吸收机制,因此推测枳实与栀子合用会竞争肠道菌群代谢,进而使得栀子苷的肠道局部浓度相对增加,致吸收增加。方中厚朴与枳实均对栀子苷的吸收表现出促进作用,由此可见,栀子厚朴汤中特征化学成分的药理作用并非单味药材相应作用的简单加合,而是方药相互作用、综合起效的结果,在一定程度上说明了中医复方配伍用药的意义所在。
[1]张仲景.伤寒论[M].北京:中国中医药出版社,2006:10.
[2]Kazuo T,Hiroko K,Noriko O,et al.Anxiolytic effect of gardeniae fructus-extract containing active ingredient from kamishoyosan (KSS),a Japanese traditional Kampomedicine[J].Life Sci,2005,77(24):3010-20.
[3]郝文宇.栀子粗提物治疗慢性应激致抑郁模型小鼠的机制研究[D].北京:北京协和医学院 中国医学科学院,2009.
[4]晏 艳,冯 芳,王 丹.栀子厚朴汤抗抑郁活性成分的研究[J].药学进展,2010,34(6):275-80.
[5]张倩怡,杜守颖,陆 洋,等.栀子提取物中栀子苷油水分配系数及大鼠肠吸收动力学研究 [J].中国中药杂志,2009,34(14):1840-4.
[6]朱 兰,冯 芳,任扬帆,等.多种色谱-波谱联用技术分析栀子厚朴汤中特征成分及其配伍前后的溶出变化[J].中国药科大学学报,2009,40(5):426-30.
[7]Sun MH,Zhai XZ,Xue KW,et al.Intestinal absorption and intestinal lymphatic transport of sirolimus from self-microemulsifying drug delivery systemsassessed using the single-pass intestinal perfusion (SPIP)technique and a chylomicron flow blocking approach:Linear correlation with oral bioavailabilities in rats[J].Eur J Pharm Sci,2011,43(3):132-40.
[8]Zuo Z,Zhang L,Zhou LM,et al.Intestinal absorption of hawthorn flavonoids-in vitro,in situ and in vivo correlations[J].Life Sci,2006,79(26):2455-62.
[9]黄继汉,黄晓晖,陈志扬,等.药理试验中动物间和动物与人体间的等效剂量换算 [J].中国临床药理学与治疗学,2004,9(9):1069-72.
[10]胡一桥,郑梁元,钱陈钦,等.离子型药物酚红的小肠吸收研究[J].中国药科大学学报,1996,27(6):355-9.
[11]Zhao YH,Abraham MH,Le J,et al.Evaluation of rat intestinal absorption data and correlation with human intestinal absorption[J].Eur J Med Chem,2003,38(3):233-43.
[12]杨 静,钱大玮,段金廒,等.肠道细菌对中药成分代谢的研究进展[J].中草药,2011,42(11):2335-44.
