肺癌18F-FDG PET-CT与高分辨CT的临床应用
2012-11-15王少雁孔令山左长京韩一平第二军医大学长海医院核医学科上海00433第二军医大学长海医院呼吸内科通讯作者mailchangjingzuogmailcom
彭 婕,程 超,张 建,王少雁,孔令山,左长京,韩一平 (第二军医大学长海医院核医学科,上海 00433;第二军医大学长海医院呼吸内科;通讯作者,E-mail:changjing.zuo@gmail.com)
肺癌的诊治近年取得长足进步,但是术后5年总生存率仍低于50%[1]。应用无创影像学对肺癌进行诊断、准确分期,并制定出恰当的个体化治疗方案及治疗后的再分期、疗效评估、预后判断,对提高肺癌患者生存率具有十分重要的意义。本研究对病理证实的肺癌的18F-氟代脱氧葡萄糖(18F-FDG)PET-CT及肺高分辨CT(high resolution CT,HRCT)的影像表现进行回顾分析,探讨其在诊断及分期方面的价值。
1 资料与方法
1.1 资料 回顾分析2010-11~2011-05在长海医院核医学科行PET-CT并经病理组织学或细胞学检查证实为肺癌的患者65例,男性45例,女性20例;平均年龄(60.9 ±12.5)岁;其中鳞癌 17 例,腺癌33例(包括细支气管肺泡癌4例),腺鳞癌2例,小细胞癌8例,神经内分泌癌1例和未定型癌4例。转移灶诊断经病理组织学和/或超声、CT、磁共振成像(MRI)及骨扫描影像学检查诊断并经临床随访6个月以上确诊。
1.2 检查仪器与方法18F-FDG由上海原子科兴药业有限公司提供,放射化学纯度大于95%;采用西门子Biograph trupoint 64层52环HD PET-CT。患者禁食6-8 h,确定血糖 <5.8 mmol/L后,按4.44-8.14 MBq/kg体重静脉注射18F-FDG,静卧休息1 h并排尿后行PET-CT检查,常规扫描7-8个床位,每个床位2.5 min,扫描范围自颅顶至股骨中段;23例肺孤立结节(solitary pulmonary nodule,SPN)常规扫描后1 h行肺部延迟扫描;采用迭代方法重建图像,CT透射扫描数据作衰减校正,得到CT图像、PET图像和PET-CT融合图像;所有患者均行肺部HRCT扫描,扫描参数选择120 kv,150 mAs,扫描时间0.75 s/层,层厚 2.0 mm,螺距 1.25,重建间隔1.0 mm,FOV为380 mm,骨算法重建。
1.3 图像分析 HRCT图像由2位有经验的影像科医生阅片,观察肺部病灶大小、形态、部位、数目及CT值;PET图像由2位有经验的PET-CT医师阅片,观察病灶FDG的放射性分布及测量标准摄取值(standardized uptake value,SUV),延迟扫描者计算FDG 滞留指数(retention index,RI),RI=(SUV 延迟-SUV早期)/SUV早期 ×100%;肿瘤大小按PET-CT融合图像目测法三维测量,取三维径线的最大值;PET-CT结合HRCT及临床病史资料,确定诊断。CT图像评价淋巴结标准为最大径>10 mm诊断为阳性,<10 mm为正常;PET图像评价淋巴结标准为SUVmax>2.5为恶性,PET-CT结合两者标准符合其中一项或两项均诊断为转移。
2 结果
2.1 肺癌的PET-CT及HRCT表现 65例肺癌患者中,PET-CT结合HRCT检出肺部原发病灶敏感性100%,准确性93.8%(61/65),PET-CT 既可显示病灶大小、范围,又可观察及其与周围继发病变的界限(图1)。其中1例弥漫性细支气管肺泡癌患者因有10余年石棉接触史误诊为石棉肺,1例误诊为结核,2例小磨玻璃灶误诊为炎性。
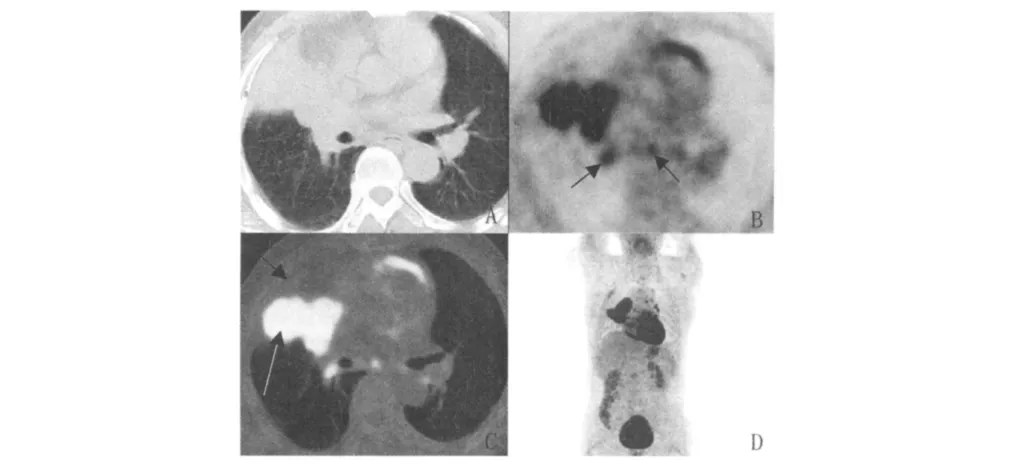
图1 患者,男,63岁,右肺中叶中央型小细胞肺癌的影像学表现Fig 1 Imagings of a 63-year-old male patient with center type small cell lung cancer
PET检出肺部病灶敏感性93.8%(61/65),准确性90.7%(59/65),SUVmax为9.78 ±5.63,SPN 延迟扫描 SUVmax为 11.76 ±5.40,SUVmax升高 3.2 ±1.3,RI为(39.31 ± 3.62)%。其中鳞癌 SUVmax为13.43 ±5.00,实性腺癌 SUVmax为 9.53 ±4.89,小细胞癌SUVmax为11.23±4.60;4例细支气管肺泡癌SUVmax为 0.91 ± 0.14,延迟后 SUVmax为 0.79 ±0.14,FDG无明显滞留(图2)。同机融合非屏气肺部CT和肺HRCT均可显示肺部病灶部位、大小、边缘及与邻近结构关系,表现多为实性结节(34/65)或软组织肿块(27/65),CT 值(36.20 ±12.50)HU,最大径(3.98±2.11)cm;4例细支气管肺泡癌表现为磨玻璃灶;大部分病灶边界清晰,合并阻塞性肺炎或肺不张者界限不清。与PET-CT非屏气肺部CT相比,HRCT可以通过冠状、矢状及多平面重组(MPR)等后处理重建更清晰显示病灶分叶(45例)、毛刺(38例)、胸膜牵拉(40例)、血管集束征(25例)、支气管截断征(29例)以及内部微结节(3例)、空泡(31例)、空洞(8例)或微小钙化灶(2例)等细微特征。HRCT检出肺部病灶敏感性96.9%(63/65),准确性72.3%(47/65)。
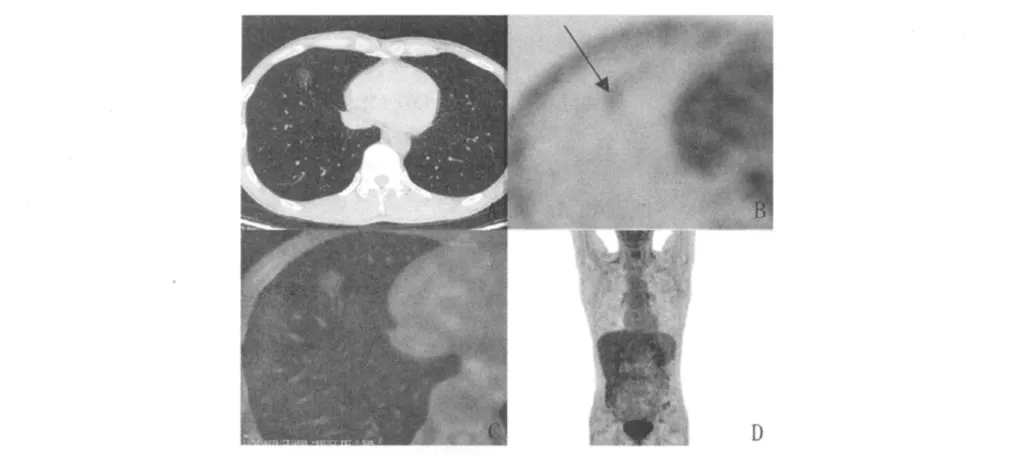
图2 患者,男,38岁,右肺下叶腺癌的影像学表现Fig 2 Imagings of a 38-year-old male patient with lung adenocarcinoma
65例患者中,经组织细胞学或影像学诊断并临床随访6个月以上确诊转移46例,PET-CT诊断转移44例,准确性95.6%。1例细胞学证实心包转移者PET-CT误诊为心包炎、心包积液;1例早期坐骨转移CT未见骨质破坏,FDG摄取无异常增高而漏诊,MR显示异常信号。转移患者中36例具有单个或多个部位淋巴结转移,位于肺门、纵隔、锁骨上窝、颈部、腹腔及腹膜后等部位。PET-CT诊断19例患者发生单发或多发远处转移,表现为放射性摄取增高的结节、软组织肿块或破坏征象,SUVmax>2.5。肺癌各病理类型及转移部位见表1。
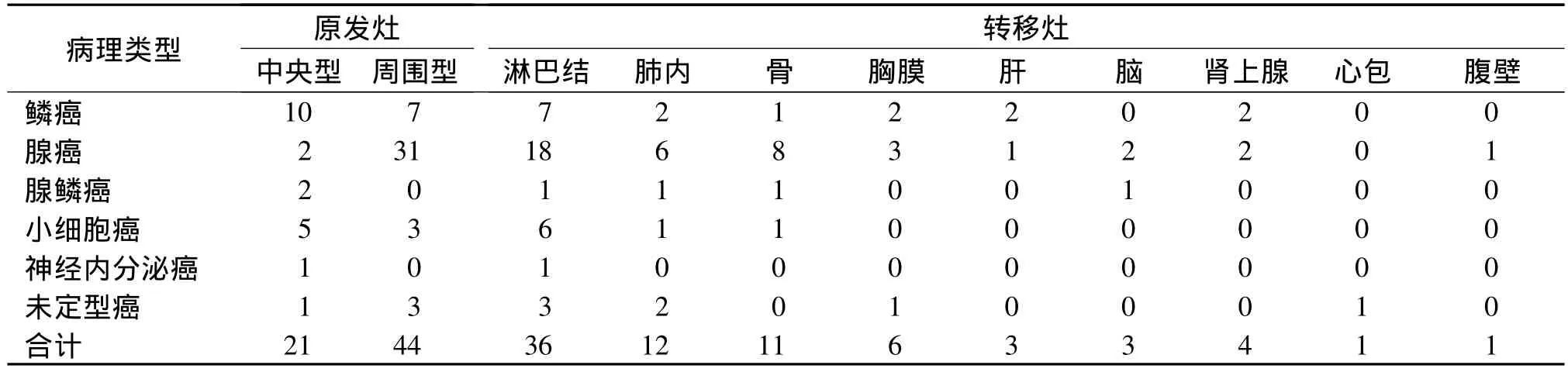
表1 65例肺癌各病理类型原发灶及转移灶分布Tab 1 Distribution of primary tumor and metastasis in 65 cases of different pathological types of lung cancer
2.2 SUVmax值与肿瘤大小的关系 因本组4例细支气管肺泡癌放射性摄取未见明显增高,故仅分析实性结节或肿块的SUVmax与肿瘤大小的关系。将61例患者的原发灶大小按最大径<3 cm、3-6 cm、>6 cm分为三个等级,各等级病例数及SUVmax见表2。肺癌实性肿瘤大小与SUVmax值的双变量关系散点图见图3。肺癌肿瘤大小与SUVmax的双变量呈正相关(r=0.51,t=4.56,P<0.000 5);其中鳞癌的肿瘤大小与 SUVmax无明显相关性(r=0.40,P>0.05);腺癌的肿瘤大小与 SUVmax呈正相关(r=0.35,P<0.05);小细胞肺癌的肿瘤大小与 SUVmax二者呈正相关(r=0.75,P<0.05)。
表261例肺癌原发病灶各等级的SUVmax(±s)Tab 2 SUVmaxof primary tumors in 61 cases of lung cancer(±s)
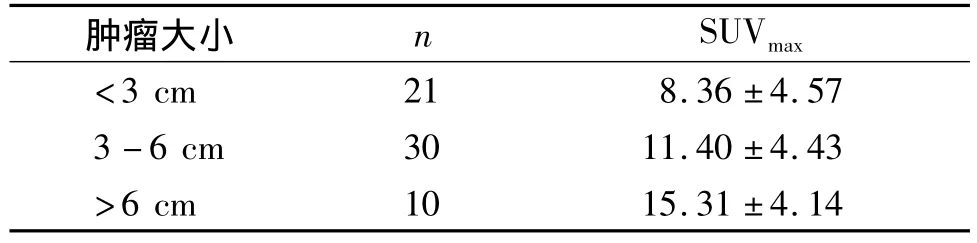
表261例肺癌原发病灶各等级的SUVmax(±s)Tab 2 SUVmaxof primary tumors in 61 cases of lung cancer(±s)
肿瘤大小 n SUVmax<3 cm 21 8.36 ±4.57 3-6 cm 30 11.40 ±4.43>6 cm 10 15.31 ±4.14
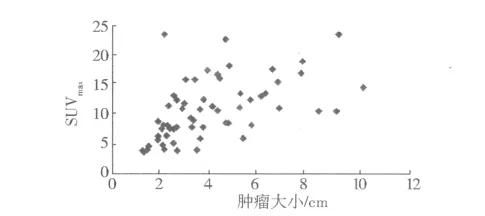
图3 SUVmax与肿瘤大小的双变量关系散点图Fig 3 Relationship between SUVmaxand size of lung tumor
3 讨论
CT检查是诊断肺癌的常规影像学方法,HRCT可提供肺部占位的精确位置、大小、形态、边缘及内部特征,但对于肺部结节(尤其是孤立结节)的定性诊断尚存在一定限制。18F-FDG PET通过病灶对显像剂的摄取反映其生理代谢状态,进行定性、定量诊断,但其空间分辨率较低。PET-CT将断层解剖和功能代谢图像融合,实现两种技术的优势互补,从而显著提高临床诊断效能[2]及肿瘤诊断和分期的准确性。本组65例肺癌患者PET-CT结合HRCT检出灵敏度达100%,诊断正确性达93.8%,单独HRCT和PET诊断准确性分别为72.3%和90.7%,与Shim等[3]报道基本一致。
本组病例中央型肺癌主要为鳞癌、小细胞癌及腺鳞癌,根据HRCT改变基本可以明确肺癌诊断。对照病理,鳞癌与腺鳞癌的表现类似,HRCT示边缘多有分叶、毛刺,易中心坏死,中心密度不均匀减低,易形成按叶或段分布的阻塞性肺炎或肺不张,PET显示放射性摄取增高,部分为中心低外围高的不均匀分布;小细胞肺癌CT示与支气管长轴一致的茄形或纺锤形肿块,边缘清楚光滑,浅分叶,密度多较均匀,中心坏死少见,PET放射性摄取较均匀增高,少部分可形成多发多向性阻塞性肺炎或肺不张,这与鳞癌引起的阻塞性肺炎或肺不张分布截然不同[4]。两者PET-CT影像表现为临床鉴别小细胞与非小细胞中央型肺癌提供了一定的影像依据。当肺癌沿支气管壁生长,未形成肿块者易误诊,本组1例沿中叶下叶支气管呈“鹿茸样”分布,误诊为感染。合并阻塞性肺炎或肺不张时,CT往往难以分辨肿块与周围继发病变的界限;PET表现为肺癌病灶FDG摄取呈结节状或团块状增高;PET-CT既可显示病灶大小、范围及其与周围继发病变的界限,使外科医师能精确制定手术方案、明确手术路径及病变切除范围;也可为放射治疗的更合理、准确靶区定位、提高肿瘤照射剂量及减低正常组织损伤提供可靠的依据。
周围型肺癌多数为腺癌,典型HRCT表现为边缘有毛刺,其内“空泡征”,有胸膜凹陷或胸膜牵拉征象,周边存在或不存在磨玻璃“晕征”;少部分为小细胞癌,HRCT表现为边缘光滑锐利的结节或肿块,多发分叶征。仅通过CT表现鉴别周围型肺占位性病变,尤其是SPN的良恶性较困难。PET-CT的SUVmax在鉴别良恶性方面具有一定的参考价值。Bryant等[5]研究发现,如果 SUVmax为 0-2.5,则肺结节恶性的概率为24%;如果 SUVmax2.6-4.0,恶性的概率为80%;如果SUVmax>4.1,则结节恶性的可能性为96%。本组病灶 SUVmax为9.78±5.63,与报道一致,且本组对SPN行延迟扫描,实性病灶延迟后 SUVmax升高 3.2 ±1.3,RI为(39.31 ±3.62)%,显著高于文献报道良性肺结节的RI[6]。SUV易受血糖、寒冷、紧张等多种因素影响,单时相PET-CT扫描的SUV反映病灶的代谢信息有一定限制。有研究[7]报道,延迟扫描对病灶的恶性判断具有一定的价值,本组资料对SPN行双时相扫描,前后对比其SUV变化,计算RI值,以提高 SUVmax在2.5附近结节的诊断准确率。
不同病理类型的肿瘤FDG代谢亦不同,SUVmax与肺癌的病理类型相关[8]。本组资料4例细支气管肺泡癌表现为弥漫分布微小结节或磨玻璃灶,放射性摄取无明显增高,SUVmax为0.91 ±0.14,延迟后SUVmax为0.79 ±0.14,降低 0.25,其病理基础是受累增厚的肺泡间隔构成的框架内充满黏液蛋白质或其他渗液[9]。因此,对于HRCT和PET表现都不典型的肺部病灶,除了观察其影像表现及代谢异常,须结合临床抗炎治疗或短期随访观察以提高诊断的准确性。
研究表明,肺部恶性结节直径越大,SUVmax可能越高,两者存在线性相关[10]。本组资料表明肺癌实性病灶、腺癌及小细胞癌最大径与SUVmax呈正相关,而鳞癌病灶最大径与SUVmax无明显相关,原因不明,可能由于鳞癌病灶通常偏大且中心易出现坏死造成。另有荟萃分析[11]表明,原发灶的SUVmax值测量对非小细胞肺癌的预后判断具有一定的价值,原发灶高SUVmax值预后可能更差,这需要对本组肺癌患者进行继续追踪随访,进一步研究SUVmax与其预后及生存率的关系。
肺癌的分期对于预后及治疗策略至关重要[11]。本组资料表明18F-FDG PET-CT一次全身扫描,可以发现异常淋巴结,对其精确定位、提高N1、N2的分辨率,使其对淋巴结的分期更为准确;同时可发现远处多器官转移灶,或者临床发现转移病灶后通过PET-CT寻找原发病灶。有研究表明18F-FDG PETCT在肺癌分期方面显著优于单独使用CT,并在淋巴结分期中提供更高的准确性和特异性[3],对治疗方案选择、放疗靶区的设置以及预后具有重要意义。
18F-FDG反映病灶糖代谢异常,非肿瘤特异性显像剂[12]。活动期炎症或感染过程及部分良性肿瘤可摄取FDG呈阳性[13],同时也存在假阴性,肿瘤细胞只有积聚到一定数量,病灶FDG摄取才会增高,支气管肺泡癌和分化好的腺癌可出现假阴性。PET-CT的假阳性和假阴性会对肺癌原发灶和转移灶的定位、定性诊断造成一定干扰。本组资料采用PET-CT双时相扫描,并结合HRCT,相对于常规的影像诊断技术在肺癌原发病灶和转移灶的诊断、分型及分期上具有一定优势及更多的参考信息。
[1] Yang P,Allen MS,Aubry MC,et al.Clinical features of 5,628 primary lung cancer patients:experience at Mayo clinic from 1997 to 2003[J].Chest,2005,128(1):452-462.
[2] Miele E,Spinelli GP,Tomao F,et al.Positron Emission Tomography(PET)radiotracers in oncology-utility of18F-Fluoro-deoxyglucose(FDG)-PET in the management of patients with nonsmall-cell lung cancer(NSCLC)[J].J Exp Clin Cancer Res,2008,27:52.
[3] Shim SS,Lee KS,Kim BT,et al.Non-small cell lung cancer:prospective comparison of integrated FDG PET/CT and CT alone for preoperative staging[J].Radiology,2005,236(3):1011-1019.
[4] 朱晓华.胸部疾病少见CT征象分析[M].北京:人民卫生出版社,2007:111.
[5] Bryant AS,Cerfolio RJ.The maximum standardized uptake values on integrated FDG-PET/CT is useful in differentiating benign from malignant pulmonary nodules[J].Ann Thorac Surg,2006,82(3):1016-1020.
[6] 王城,王雪梅,王春梅,等.18F-FDG PET-CT双时相显像结合高分辨CT诊断孤立性肺结节的价值[J].国际放射医学核医学杂志,2011,35(3):154-158.
[7] Kubota K,Itoh M,Ozaki K,et al.Advantage of delayed whole-body FDG-PET imaging for tumor detection[J].Eur J Nucl Med,2001,28(6):696-703.
[8] Rohren EM,Lowe VJ.Update in PET imaging of nonsmall cell lung cancer[J].Semin Nucl Med,2004,34(2):134-153.
[9] 蔡祖龙,赵绍宏.细支气管肺泡癌的影像学[J].中国医学计算机成像杂志,2001,7(1):24-29.
[10] Khalaf M,Abdel-Nabi H,Baker J,et al.Relation between nodule size and18F-FDG-PET SUV for maglignant and benign pulmonary nodules[J].J Hematol Oncol,2008,1:13.
[11] Berghmans T,Dusart M,Paesmans M,et al.Primary tumor standardized uptake value(SUVmax)measured on fluorodeoxyglucose positron emission tomography(FDG-PET)is of prognostic value for survival in non-small cell lung cancer(NSCLC)[J].J Thorac Oncol,2008,3(1):6-12.
[12] 杨洋,范艳芬,孙希文.18F-FDG PET/CT在肺内结节诊断及治疗中的临床应用[J].中华临床医师杂志:电子版,2010,4(10):1951-1954.
[13] Heyneman LE,Patz EF.PET imaging in patients with bronchioloalveolar cell carcinoma[J].Lung Cancer,2002,38(3):261-266.
