椎管注射PPADS对内脏痛大鼠行为学及胸髓P2X7受体表达的影响
2012-11-15饶志仁黄裕新赵曙光王旭霞王景杰第四军医大学唐都医院消化内科西安70038第四军医大学神经科学研究所通讯作者mailtianli3yahoocn
秦 明,饶志仁,黄裕新,杨 琦,赵曙光,王旭霞,王景杰 (第四军医大学唐都医院消化内科,西安 70038;第四军医大学神经科学研究所;通讯作者,E-mail:tianli3@yahoo.cn)
嘌呤受体(P2X)属于配体门控性非选择性阳离子通道受体,可被ATP激活,广泛参与神经信息的传递及调控,其亚型P2X4受体及P2X7受体与疼痛产生有密切的关系[1-3]。我们前期实验观察到,腹腔注射乙酸后大鼠P2X4受体在孤束核及胸髓背角浅层表达明显增高,提示P2X4受体参与了乙酸致内脏痛的痛觉信息传递[4]。为进一步探讨P2X7受体在内脏疼痛信息传递中的作用,本文对椎管鞘内注射P2X7受体拮抗剂—磷酸吡哆醛(PPADS)后内脏痛大鼠行为学及胸髓P2X7受体和fos表达的变化进行研究,以探讨P2X7受体在内脏疼痛信息传递中的作用。
1 材料和方法
1.1 材料 成年雄性SD大鼠32只,体重200-220 g(第四军医大学动物中心提供),安静、温暖(20℃)、避强光的环境中饲养72 h。随机分为空白组、模型组、PPADS组、NS组,每组8只。
1.2 方法
1.2.1 模型制作 空白组大鼠不做处理。模型组将0.6%乙酸(V/V,10 ml/Kg)注射入大鼠腹腔内造成内脏痛模型。PPADS组大鼠经腹腔注射氯胺酮(50-100 mg/kg)麻醉后经脊髓鞘内置入聚乙烯PE-8 软管(内径0.2 mm,外径0.5 mm),封外口,固定,局部抗感染处理。术后1周观察动物状态良好,无活动障碍,即可进行正式实验。大鼠在清醒状态下,用25 μl微量注射器吸取10 μl PPADS(10 nmol/μl)及用于冲管的10 μl的生理盐水,两药之间以1 μl空气相隔,然后向椎管鞘内注射,注射90 min后按前述方法再做内脏痛模型。NS组用25 μl微量注射器吸取20 μl的生理盐水向大鼠鞘内注射,注射90 min后再做内脏痛模型。然后观察并记录60 min内各组大鼠行为学的反应。
1.2.2 内脏痛指数的计算 按Schmauss标准[5]计算内脏痛指数(VPI)。把扭体行为分成0-3四个等级:零级为正常姿势;一级为身体斜向一边;二级为后肢伸展,后爪频繁后摆;三级为腹部肌肉收缩,后肢外伸。统计各等级出现的次数乘以相应的数值,分数相加的总和作为动物内脏痛的指数。据此标准可把此行为学量化。
1.2.3 免疫组织化学方法 各组大鼠在行为学记录结束后用1%戊巴比妥钠(60 mg/kg,i.p.)麻醉,迅速开胸经左心室至升主动脉插管,4%多聚甲醛灌流固定,取胸髓T8节段冰冻切片机切制连续冠状切片,片厚30 μm。切片在0.01 mol/L PBS中漂洗后,进行免疫荧光染色:①入兔抗P2X7受体的抗体稀释液(1∶500,Sigma),孵育 24 h(室温);②入混有FITC标记的羊抗兔IgG(1∶500,Sigma)荧光二抗避光放置2-4 h(室温)。以上每一步骤之后均用0.01 mol/L PBS液充分漂洗3次,每次10 min。另取实验组1套切片,用兔抗 fos的抗体稀释液(1∶1 000,Santa Cruz)替代抗 P2X7受体抗体稀释液,按上述方法进行免疫组化染色。切片经漂洗后裱片、晾干、封固后在荧光显微镜下观察并采集图像。
1.2.4 数据处理和统计分析 切片经图像分析仪(Quantimet570C,Leica)处理。每只大鼠随机选取6张切片,计算脊髓内fos阳性数目的总和,而后在每组动物间取均数;P2X7受体阳性免疫反应产物的强弱以灰度值来表示。实验数据以±s表示,采用SPSS12.0统计软件作统计处理,各组fos和P2X7受体表达的比较采用单因素方差分析的方法分析数据。
2 结果
2.1 行为学观察 空白组动物行为学上没有变化。其他组大鼠腹腔注射乙酸后出现了明显的腹部收缩试验,即腹部肌肉收缩,同时伴有一侧后肢外伸。以注射后10 min左右出现明显变化,在30-40 min时达到高峰。PPADS组大鼠的腹部收缩试验明显减轻,计算其内脏痛指数较模型组明显减少(P<0.01);NS组大鼠亦出现明显的腹部收缩试验,其内脏痛指数与模型组比较差异没有统计学意义(见表1)。
表1 各组大鼠内脏痛指数及脊髓后角P2X7受体和fos阳性免疫反应表达的变化(n=8,±s)Tab 1 Changes of visceral pain index(VPI)and positive immunoreactive expression of P2X7receptor,fos in dorsal horn of spinal cord of rats (n=8,±s)
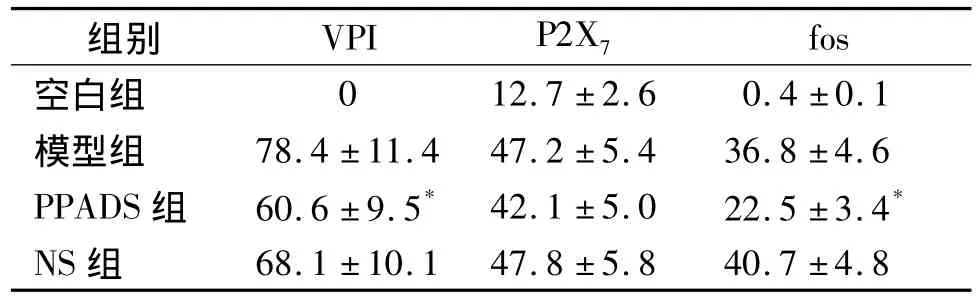
表1 各组大鼠内脏痛指数及脊髓后角P2X7受体和fos阳性免疫反应表达的变化(n=8,±s)Tab 1 Changes of visceral pain index(VPI)and positive immunoreactive expression of P2X7receptor,fos in dorsal horn of spinal cord of rats (n=8,±s)
与模型组比较,*P<0.01
组别 VPI P2X7fos空白组0 12.7 ±2.6 0.4 ±0.1模型组 78.4 ±11.4 47.2 ±5.4 36.8 ±4.6 PPADS 组 60.6 ±9.5* 42.1 ±5.0 22.5 ±3.4*NS组68.1 ±10.1 47.8 ±5.8 40.7 ±4.8
2.2 免疫组化反应观察 空白组脊髓内未见到阳性免疫组化表达。模型组在胸髓后角浅层可见到大量P2X7受体阳性免疫反应产物表达,表现为绿色细丝状及短条状(图1A)。在同一部位,亦可见较多fos阳性免疫反应产物表达,表现为亮绿色卵圆形(图1B)。
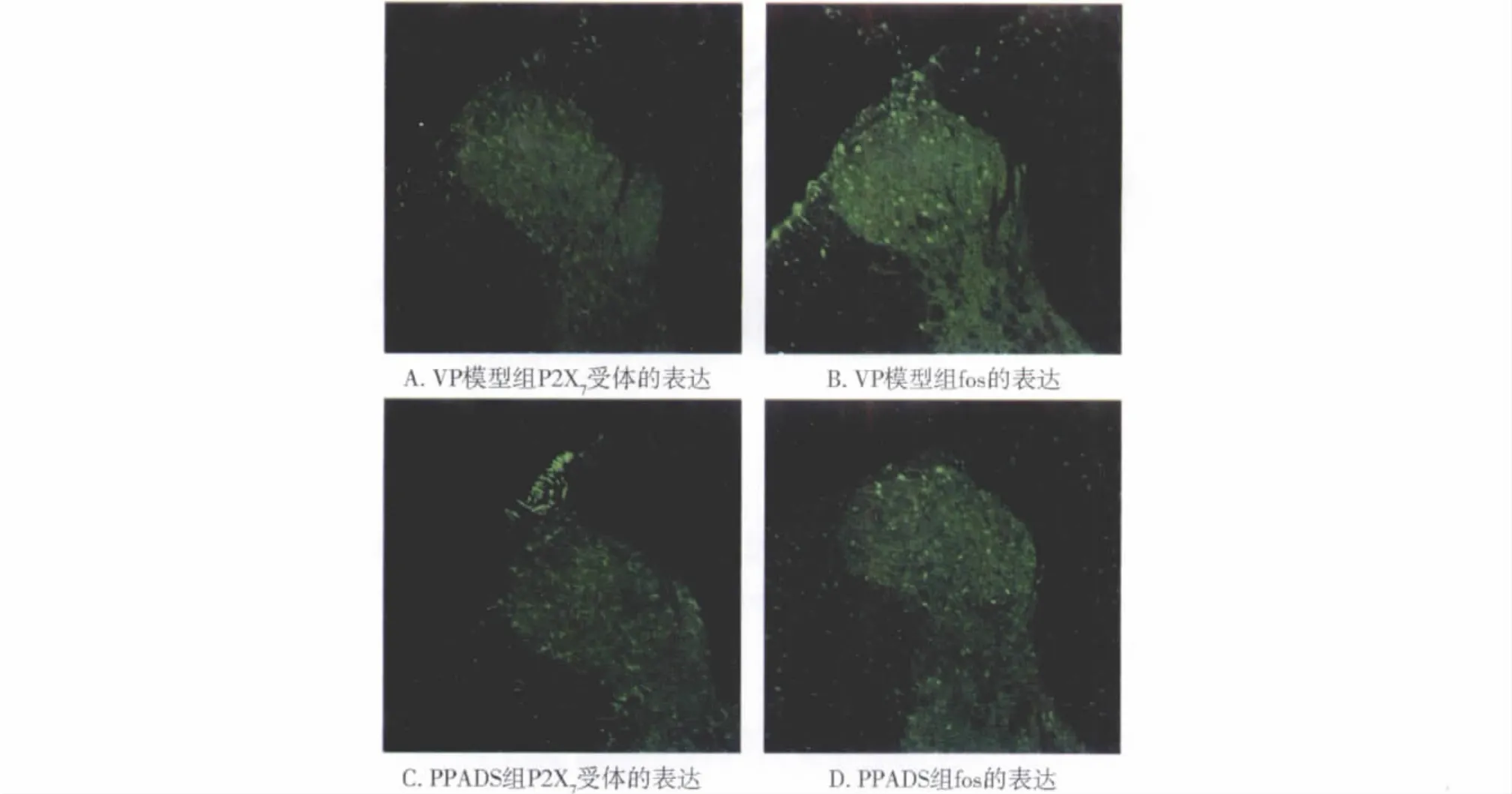
图1 PPADS组和模型组胸髓后角内P2X7受体和fos阳性免疫反应的表达Fig 1 Immunoreactive positive expression of P2X7receptor and fos in dorsal horn of thoracic spinal cord in rats
PPADS组胸髓后角P2X7受体阳性免疫反应产物亦有大量表达,但同一部位的fos阳性免疫反应数目明显减少(图1C,D),其中 fos阳性免疫反应数目与模型组比较差异有统计学意义(见表1)。NS组P2X7受体及fos阳性反应与模型组之间比较,差异无统计学意义(见表1)。
3 讨论
腹腔内脏出现炎症、溃疡、梗阻、肿瘤等疾患均可导致机体内脏性疼痛。内脏痛的性质模糊,定位不明确,机体的反应强烈,有关其疼痛信息传递的内在机制仍不明确,以至在临床治疗上一直是个难题。P2X7受体属于嘌呤受体P2X受体亚型之一,可被ATP激活,在机体疼痛信息的整合、调控中起重要作用[2,3]。为探讨其在内脏疼痛信息传递中的作用,本实验对鞘内注射P2X受体拮抗剂PPADS前后内脏痛模型大鼠疼痛行为学及脊髓P2X7受体和fos表达情况进行了研究。
本实验观察到,大鼠腹腔注射乙酸后出现明显的腹部收缩实验,且免疫组化染色发现在脊髓后角浅层有大量P2X7受体阳性产物表达,同时该部位的fos阳性数目亦明显增加。脊髓后角是伤害性刺激初级传入纤维的主要终止部位和中枢内源性镇痛系统发挥作用的重要部位,在伤害性信息的传递、整合、调控等过程中起重要作用。fos作为一种即刻早期基因,它的表达反映出该部位的神经元处于活动状态,对某种刺激起反应。上述实验结果提示内脏痛刺激可激活脊髓后角部位P2X7受体及fos阳性神经元功能。P2X7受体在神经系统中分布广泛,作用复杂,不仅可以直接参与突触信号传递,也可易化突触后神经传递,并在神经胶质-神经元以及胶质网络内的信号传递中发挥重要作用[6,7]。P2X7受体作为启动痛觉信号传入的重要因子,在胸髓背角中的大量表达提示P2X7受体可能参与介导了内脏痛在中枢神经系统中伤害性信息的传递,是神经网络内部信号传递的一种重要结构成分。为进一步验证P2X7受体在内脏疼痛信息传递中的生理功能,我们通过椎管鞘内注射一种P2X受体拮抗剂PPADS,抑制P2X7受体功能后,对大鼠内脏疼痛的行为学变化进行了研究。结果发现鞘内注射PPADS干预后内脏痛模型大鼠的行为学反应明显减轻,免疫组化染色观察到尽管脊髓后角P2X7受体的表达没有明显变化,但该部位的fos阳性表达数目明显减少。提示抑制P2X7受体功能可间接对其周围的神经元的功能产生影响。P2X7受体广泛存在于中枢神经星形胶质细胞及小胶质细胞,实验证实,这些胶质细胞可通过释放多种神经递质及调质从而对周围的胶质细胞,特别是神经元的功能发挥调节作用[8-10]。我们推测P2X7受体在内脏痛信息传递中起积极的易化作用;P2X7受体可能通过影响其周围的神经元功能,进而参与内脏疼痛信息的调控,但有关其具体细胞分子信号调节机制仍需深入探索。
[1] Tsuda M,Shigemoto-Mogami Y,Koizumi S,et al.P2X4receptors induced in spinal microglia gate tactile allodynia after nerve injury[J].Nature,2003,424:778-783.
[2] Chessell IP,Hatcher JP,Bountra C,et al.Disruption of the P2X7purinoceptor gene abolishes chronic inflammatory and neuropathic pain[J].Pain,2005,114(3):386-396.
[3] Chen Y,Zhang X,Wang C,et al.Activation of P2X7 receptors in glial satellite cells reduces pain through downregulation of P2X3 receptors in nociceptive neurons[J].Proc Natl Acad Sci USA,2008,105(43):16773-16778.
[4] 秦明,王景杰,段丽,等.乙酸致内脏痛大鼠孤束核及胸髓中P2X4受体表达的变化[J].神经解剖学杂志,2006,22(5):551-554.
[5] Schmauss C,Yaksh TL.In vivostudies on spinal opiate receptor systems mediating antinociception.Ⅱ.Pharmacological profiles suggesting a differential association of mu,delta and kappa receptors with visceral chemical and cutaneous thermal stimuli in the rats[J].J Pharmacol Ther,1984,28:1-12.
[6] Gordon GR,Baimoukhametova DV,Hewitt SA,et al.Norepinephrine triggers release of glial ATP to increase postsynaptic efficacy[J].Nat Neurosci,2005,8(8):1078-1086.
[7] Yu Y,Ugawa S,Ueda T,et al.Cellular localization of P2X7receptor mRNA in the rat brain[J].Brain Res,2008,1194:45-55.
[8] Binshtok AM,Wang H,Zimmermann K,et al.Nociceptors are interleukin-1 beta sensors[J].J Neurosci,2008,28(52):14062-14073.
[9] Miyoshi K,Obata K,Kondo T,et al.Interleukin-18-mediated microglia/astrocyte interaction in the spinal cord enhances neuropathic pain processing after nerve injury[J].J Neurosci,2008,28(48):12775-12787.
[10] Allen NJ,Barres BA.Glia-more than just brain glue[J].Nature,2009,457:675-677.
