天然沸石在饮用水中除氟工艺研究
2012-11-15邵玉玲王学艳
邵玉玲,王学艳
(1.黑龙江省齐齐哈尔水文局水环境分中心,黑龙江齐齐哈尔161005;2.黑龙江省齐齐哈尔水文局浏园站,黑龙江齐齐哈尔161005)
1 去除含氟水的主要方法
目前,含氟水的除氟方法主要有物理分离法,包括离子交换法,离子吸附法;化学沉淀法:包括混凝沉淀法、钙盐沉淀法、共沉浮选法、以及电化学法这些方法中,实际经常采用的是交换吸附法。混凝沉淀法是传统的除氟方法,实际应用中己经很少使用,离子交换法费用高,且对废水水质要求严格,应用也受限制。下面就这几种方法的研究进展情况进行介绍。
2 几种方法的研究进展情况
2.1 离子交换法
主要采用阴离子交换树脂,磺化烟煤,锯屑等的离子的阴离子交换作用达到除氟的目的。离子交换树脂具有较高的交换吸附能力,能有效降氟至1 mg/L,但由于饮用水中含有其他阴离子如 SO4,NO3,Cl-等,会造成竞争吸附,阴离子交换树脂对饮用水中主要的阴离子的交换吸附能力为:SO4>NO3>Cl->F-,因此,对于地下水而言,阴离子交换树脂对氟离子的选择交换吸附能力很低,一般交换容量在1 mg氟离子/克树脂。它还有处理后再生费用大的缺点。因此实际饮用水是难以用该树脂来处理的。
2.2 离子吸附法
是适用性较好的方法,主要包括骨炭法,活性氧化铝法,活性氧化镁法和沸石法。一般将吸附剂装入填充柱,采用动态吸附方式进行,操作简便,除氟效果稳定,价格便宜。主要的缺点是吸附剂吸附容量低,它们的吸附容量都不大,比如斜发沸石吸附容量最高为0.06~0.3 mg/g沸石,活性氧化铝的也没有超过2 mg/g。实际常用的活性氧化铝除氟效果好,容量稳定,高氟水中含氟量为1 mg/L左右时,可以处理至含氟量低于1 mg/L,若原水氟浓度过高,处理效果急剧下降,若原水中含有磷酸根和过量硫酸根时,影响除氟效果。活性氧化铝吸附容量随pH的升高而降低,除氟效果较好的pH为5~6.5,对酸度的要求比较严格,而且铝盐在水中的溶解度非常大,容易从载体上流失,经过再生后的吸附容量下降非常快,另外,饮水中的铝离子对人体神经有危害。另一传统吸附剂活性氧化镁的吸附量可达14 mg/g,但再生要在420℃ ~1 000℃进行灼烧,操作麻烦,最佳的吸附pH范围为6~7。还有人把粉煤灰作为吸附剂,虽说粉煤灰的的价格极其低廉,不用再生,但是它的吸附容量仅为0.03 mg/g所以在大量处理饮用水工艺中,投加量将非常巨大,这对一于远离粉煤灰的地区将会产生很高的附加运输成本,不宜推广。沸石为天然矿物,廉价易得,无毒无害,可将含氟量为3~10 mg/L得饮用水降到1.0 mg/L以下,各项指标均达到国家饮用水标准。且有资料称沸石有越用越好得趋势、工艺简单、易于操作和推广。现在用活化沸石除氟已经成为实用的技术[7]。
2.3 混凝沉淀法
经常采用得是氢氧化铝、氯化铝和硫酸铝等铝盐混凝共沉淀除氟,它的一个基本控制参数是pH值,它对pH值的要求也很严格,一般控制在6.5~7.5。这种方法投药量大,为除氟量的100~200倍,造成水中大量增加并会产生大量含水污泥,会造成污泥的难以处理,同时也很难将水中的氟浓度降到符合饮水标准。各类铝盐除氟是由于铝盐形成的矾花粒子Al(OH)3对水中氟离子的吸附,起吸附能力比活性氧化铝强,但无法再生。在同一pH条件下,聚合铝的除氟容量最高,氯化铝和硫酸铝的吸附性能较差。另外,它只能适于低浓度的氟溶液,比如低于3 mg/L的含氟水。所以在对于饮水除氟离子实际应用中混凝沉淀法己经很少使用。
钙盐沉淀法主要采用氧化钙、氢氧化钙、氯化钙、石灰等。氧化钙投加到水中,主要是与水中的氟离子形成氟化钙沉淀而除氟,受氟化钙溶解度的影响,该方法不能达到饮用水标准,主要用于含氟较高的工业水处理。石灰和氢氧化钙除氟的机理是与水中的Ca、Mg无机盐反应生成大量的 Mg(OH)2和CaCO3沉淀。Mg(OH)2沉淀表面以一级交换吸附共沉淀而使氟离子浓度降低,同时沉淀亦有少量除氟作用。
2.4 电化学法
一般说来,所需设备和构筑物较多,基建投资高,占地面积大,且操作水平要求也较高。考虑到我国饮用水需进行除氟处理的地方多分布在西北干旱地区和一些边远地区,经济不发达。由于缺少集中水处理设备,农村,矿区多于城市,此方法一般不易在这些地区适用。
2.5 沸石的结构
沸石是一种架状构造的含水铝硅酸盐矿物,主要含有 Na、Ca以及少数 Sr、Ba、K、Mg等金属离子。沸石的化学组成,通常用下式表示:(Na,K)x(Mg,Ca,Sr,Ba)y{Al(x+2y)Si[n-(x+2y)]O2n}·mH2O(式中 Al的个数等于阳离子的总价数;O的个数为Al和Si总数的2倍。
沸石的密度为1.92~2.80 g/cm3,莫氏硬度为5~5.5,无色,肉红色,淡绿色或其它颜色。沸石具有多孔性、筛分性、离子交换性、耐酸性及对水的强结合性。
沸石的结构一般由三维硅(铝)氧格架组成,其基本单元是以硅为中心和周围4个氧离子排列而成的硅氧四面体(SiO4),见图1。
各个硅氧四面体通过处于四面体顶点的氧原子互相连接起来,形成许多宽阔的孔穴和空道,这是沸石与其它架状硅酸盐矿物不同之处,因而沸石具有很大的比表面积(400~800 m/g)。沸石这种格架结构决定了它具有较高的吸附交换性能。沸石这些孔穴和孔道可吸附大量的其他分子或离子,沸石的吸附量远远超过其他物质。沸石的孔穴和孔道大小均匀,直径在0.3~1 nm,小于这个直径的物质能被吸附,而大于这个直径的物质则被排除在外不被吸附,沸石具有选择吸附的特性。沸石表面还具有很大的色散力和静电力,故其吸附力很大。它们含水量的多少随外界温度和湿度的变化而变化。其中在铝氧四面体中由于一个氧原子的价电子没有得到中和,使得整个铝氧四面体带有负电荷,为保持电中性,附近必须有一个带正电荷的金属阳离子(M+)来抵消(通常是碱金属或碱土金属离子),这些阳离子和铝硅酸盐结合相当弱,具有很大的流动性,极易和周围水溶液中的阳离子发生交换作用,交换后的沸石结构不被破坏。沸石的这种结构决定了它具有离子交换性和交换的选择性。
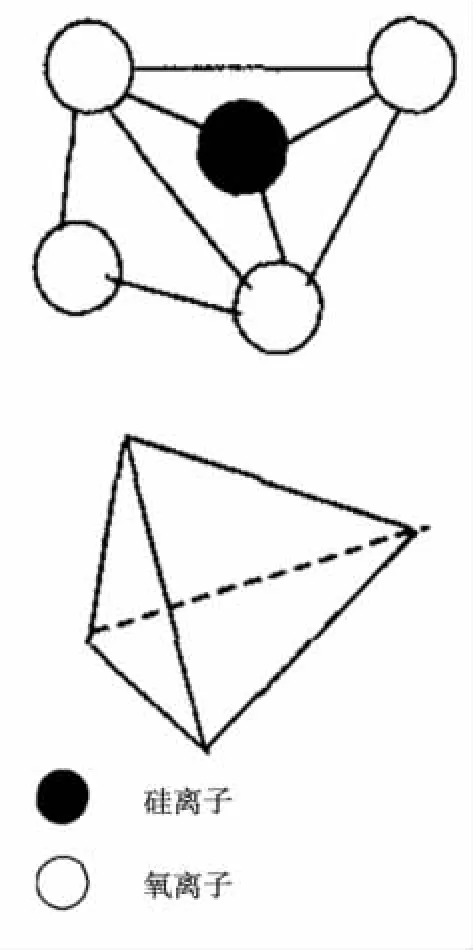
图1 沸石的结构单元图
硅氧四面体只能通过角顶互相连接构成硅氧四面体群。位于公共顶角上的氧原子为相邻的4个硅氧四面体所共有,它的负二价电荷被相邻的两个四面体中心的硅原子中和,因此,角顶的氧离子在电性上是不活泼的,为惰性氧。每个硅氧四面体中硅与氧的比为1∶2,硅离子被顶角上的4个氧离子(各以负一价)所中和,故电价为0。
3 除氟工艺研究内容
3.1 改性方式
①NaCl改性沸石的静态实验研究;②NaOH改性沸石的静态实验研究;③HCl改性沸石的静态实验研究;④镧改性沸石的静态实验研究;⑤铈改性沸石的静态实验研究;⑥淬火改性沸石的静态实验研究。
3.2 本实验分为静态和动态两部分
静态实验部分主要研究改性沸石在不同条件下对原水中氟离子的去除情况。具体内容包括:①不同浸泡液浓度浸泡沸石对氟离子去除率的影响;②不同浸泡沸石的时间对沸石吸附氟离子效果的影响;③不同搅拌时间对沸石吸附氟离子效果的影响;④改性沸石投加量对氟离子去除率的影响;⑤原水不同pH值对沸石吸附氟离子的影响。
动态实验部分主要包括固定进水流量改变沸石用量对除氟效果的影响;用量选定后通过蠕动泵的转速控制进水流量对改性沸石吸附氟离子的效果进行研究,讨论固定沸石用量改变进水流速对除氟效果的影响。
4 研究方法
1)实验材料:天然水洗烘干的张家口除氟沸石
2)实验仪器和试剂:PXS一215型离子活度计;PF一1型氟离子选择性电极;饱和甘汞参比电极;78HW—1型恒温磁力搅拌器(杭州仪表电机有限公司);LD4—2A型离心机(北京医用离心机厂);CS501型超级恒温器(220V,50Hz,重庆试验设备厂)。
3)氟离子标准溶液:称取在105℃烘干2 h的氟化钠0.221 g于烧杯中.用新制蒸馏水溶解后,移入1 000 mL容量瓶中定容。此溶液1 mL含0.1 mg氟离子。溶液储于聚乙烯塑料瓶中,用时逐级稀释。
TISAB 缓冲溶液:称取102gKNO3,83gNaAc,32 g柠檬酸钾,分别溶解后转入1 000 mL容量瓶中,加入14 mL冰醋酸,用水稀释至800 mI左右,摇匀,溶液pH值在5~5.5,稀释至刻度,摇匀备用。
5 实验步骤
1)静态试验时需定量分取含氟水于玻璃烧杯中,改变试验条件,加入一定量改性沸石。在六连搅拌器下快搅拌吸附15 min,分取25 mL水样于聚乙烯烧杯中,加入TISAB缓冲溶液10 mL,用电磁搅拌器搅拌均匀,测定电位值。
2)动态实验时,首先将沸石装入酸式滴定管中,采用上面进水的方式将沸石导入见图2所示的装置中,上层恒速进水通过蠕动泵完成,如图原水通过滴定管中改性沸石对氟离子进行去除。测定出水氟离子浓度用聚乙烯烧杯接取水样,加入TISAB缓冲溶液10 mL,用电磁搅拌器搅拌均匀,测定电位值。
6 测定方法
本实验采用了直接离子选择电极法,用柠檬酸钾一硝酸钾作离子强度调节缓冲液(TISAB)。选择性电极为氟电极,它具有选择性地对氟离子敏感的特性,利用此性质测定氟离子的含量。测定浓度范围:氟离子含量 10-2~10-6mol/L(190~0.019 mg/L)测定过程:用离子活度计以氟离子电极为测定电极,饱和甘汞电极为参比电极,磁力搅拌器搅拌下,测定溶液电位。
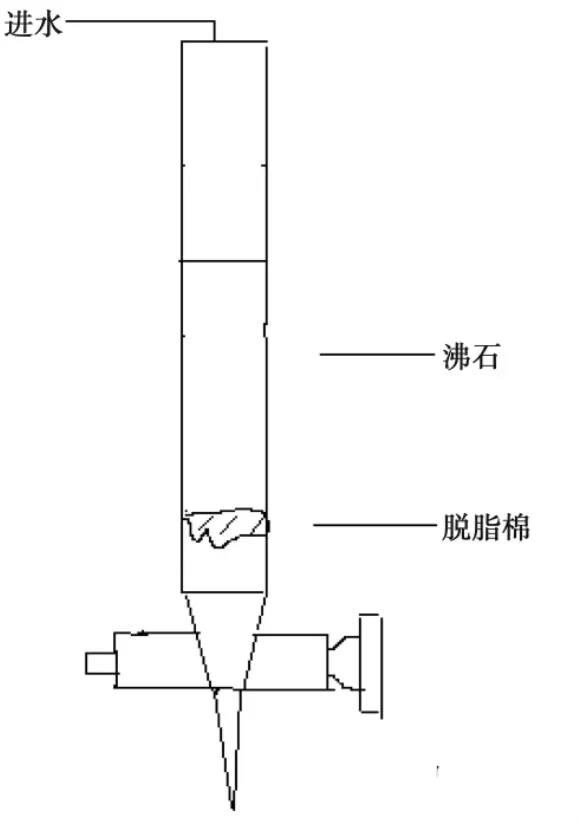
图2 动态实验装置示意图
本实验采用标准工作曲线法测定氟的浓度,配制一系列已知浓度的标准氟离子溶液,分别测定其电动势以氟电极电位对氟离子浓度,在半对数坐标纸上作图得一直线(工作曲线)。则在相同条件下测定地下水中氟电极电位,在工作曲线上可直接查得试液中氟离子的浓度。
氟离子的测定:在pH5~6的条件下。以氟离子选择性电极作指示电极,饱和甘汞电极为参比电极,用直接电位法进行测定,氟离子活度与电极电位符合Nernst关系式。
7 数据处理
7.1 静态实验
氟离子去除率=(C0-C)/C0×100%
C0为原水氟离子浓度,mg/l;C不处理后原水中氟离子浓度,mg/L
C0为原水氟离子浓度,mg/L;C为处理后原水中氟离子浓度,mg/L;V为处理原水体积,L;m为所用沸石质量,g。
7.2 动态实验
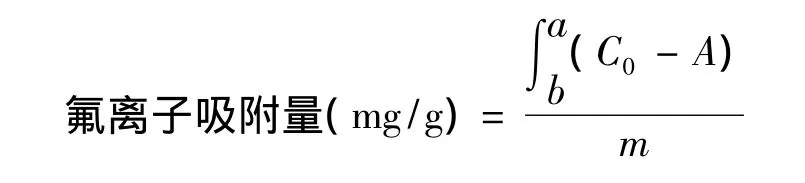
a为动态实验达到穿透曲线时所用的时间;C0为原水氟离子浓度,mg/L;A为动态实验中拟合的关于出水时间与出水氟离子浓度的曲线方程;m为沸石的用量,g。
8 结论
1)天然沸石具有一定的除氟能力,但效果不很明显。对沸石的改性中,一方面,沸石发达的内部孔道特性使得物理吸附加强,吸附活性位增多,从而化学吸附点增多,使得F-可以比较充分地与阳离子形成化合物。达到去除的目的;同时化学吸附在除氟中发挥主要作用,这可从改性后的沸石除氟能力大大提高得到证明,表明通过离子扩散进入沸石内部骨架的阳离子在除氟过程中发挥了重要的作用。
2)不同的浓度浸泡液浸泡沸石,不同的浸泡沸石的时间,改性沸石投加量不同的搅拌时间以及不同的原水pH值对改性沸石去除氟离子都有一定的影响。
3)动态试验表明:改性沸石除氟的效果在动态实验中明显优于静态实验。沸石在动态处理中要考虑到沸石用量和进水流量两方面影响因素。
4)停留时间是动态处理影响出水的主要因素,停留时间越长,沸石的吸附量越大。相同进水流量时,沸石用量越大,停留时间越长;相同沸石用量时,进水流量越小,停留时间越长,但考虑到实际生活中的水处理效率,流量不宜过小。
5)用硫酸铝钾溶液作为沸石再生液,可在一定条件下收到良好的再生效果。
[1]中国疾病预防控制中心环境与健康相关产品安全所.GB/T 5750.1—2006生活饮用水标准检验方法[S].北京:中国标准出版社,2006.
[2]马伟芳,刘文君。共存氯离子对饮用水纳滤除氟的影响研究[J]. 环境科学,2009,30(3):787-791.
[3]中国科学院大连化学物理研究所分子筛组.沸石分子筛[M].北京:科学出版社,1978.
[4]李桂荣,张淑英,刘裴文.沸石降低饮用水中氟离子的试验研究[J].给水排水,1991(04):5-9.
