超声协同作用下亚微米掺铝氧化锌催化降解亚甲基蓝的研究
2012-11-14陈珊珊铁绍龙
陈珊珊,万 霞,铁绍龙
(华南师范大学化学与环境学院,广东广州 510006)
超声协同作用下亚微米掺铝氧化锌催化降解亚甲基蓝的研究
陈珊珊,万 霞*,铁绍龙
(华南师范大学化学与环境学院,广东广州 510006)
通过溶液直接沉淀法制备了掺Al3+的亚微米氧化锌Zn(Al)O.研究在掺铝氧化锌存在和超声协同下,溶液初始pH、H2O2浓度、反应温度、Zn(Al)O投加量、Co2+浓度、亚甲基蓝(MB)浓度等实验条件对MB降解率的影响,结果表明:采用Fenton/Co2++Zn(Al)O+超声体系,在H2O2浓度为100 mmol/L,pH 5~9,温度30~50 ℃,Co2+浓度0.1~0.3 mmol/L,Zn(Al)O投加量1.0 g/L的条件下,MB溶液降解初始质量浓度达80 mg/L,自然光下超声1 h后降解率高达72%. 掺铝氧化锌循环1次后降解率为68%, 2次下降到48%.在自然光下降解,该文合成的Zn(Al)O的降解率是P25(降解率约40%)的1.8倍.
掺铝氧化锌; 超声; Fenton/Co2+体系; 降解亚甲基蓝
氧化锌作为一种重要的半导体材料,作为压敏、压电、气体传感、图像记录、磁性等材料被广泛使用.因纳米ZnO尺寸小,比表面积大,表面剩余键多,光活性高,在降解有机污染物方面得到广泛研究. 如SAKTHIVEL等[1]使用氧化锌催化、光降解酸性棕-14,获得了比二氧化钛更好的效果. KANEVA等[2]采用溶胶凝胶法合成出纳米级氧化锌,并将其做成薄膜涂层用于光催化降解孔雀绿,降解速率明显提高. PAUPORTE等[3]用电沉积的方法制备的ZnO/SDS(十二烷基磺酸钠)疏水薄膜,用于光催化降解亚甲基蓝比亲水薄膜具有更高的降解率. ULLAH等[4]使用锰掺杂氧化锌纳米球在可见光条件下降解污染物,发现降解率为不掺锰的50倍. 其他元素如Co[5]、Sn[6]等掺杂的氧化锌也被用于降解有机物. 目前研究的降解体系主要有Fenton、紫外光-Fenton、电-Fenton、超声-Fenton和微波-Fenton等,又以光催化-Fenton/Fe2+体系最多,该体系更适合于在酸性条件下进行. 有研究[7]证明Co2+离子的独立存在不利于体系中H2O2产生高活性的羟自由基(OH·),导致Fenton/Co2+体系的研究较少. 如果有合适于Co2+的螯合剂如酞菁染料和抗坏血酸等存在,羟自由基(OH·)就能有效地生成[8]. 超声作用形成的空化气泡在爆炸的瞬间产生高达5 000 K甚至10 000 K以上和100 MPa以上的局部高温高压环境, 足以使有机物在空化气泡内发生化学键断裂、水相燃烧和热分解等过程. 本文使用自行合成的亚微米级掺铝ZnO,选择亚甲基蓝作为降解对象,采用Fenton/Co2+体系, 探讨在不添加任何螯合剂,借助于Zn(Al)O的存在, 在超声协同作用下开展降解MB的实验研究.
1 实验部分
1.1纳米掺铝氧化锌的合成
将分析纯的醋酸锌和硝酸铝按照Zn2+∶Al3+=1∶0.03的摩尔比配成溶液,在三颈瓶中加入水和甘油,加热溶液至105 ℃左右,控制一定速度慢慢(2 h内完成)滴入醋酸锌和三乙醇胺溶液,保温2 h. 陈化12 h后,洗涤沉淀,在80 ℃烘干24 h,备用.
1.2亚甲基蓝降解实验
称取一定量的氧化锌加到含有去离子水、亚甲基蓝和硫酸钴的溶液中,超声仪(53 kHz/100 W)分散30 min,加入双氧水稀至100 mL, 立即置于超声仪中,在自然光下进行超声(图1). 一定时间后取出约2 mL反应液,用直径为0.45 μm的水系过滤膜分离除去Zn(Al)O,稀释一定比例后在紫外可见分光光度计上测定滤液在max=665 nm处(MB的最大吸收波长)的吸光度值At, 由公式η%=(A0-At)/A0×100%计算亚甲基蓝的降解率,其中A0和At分别为初始和反应时间t时的亚甲基蓝吸光度值.
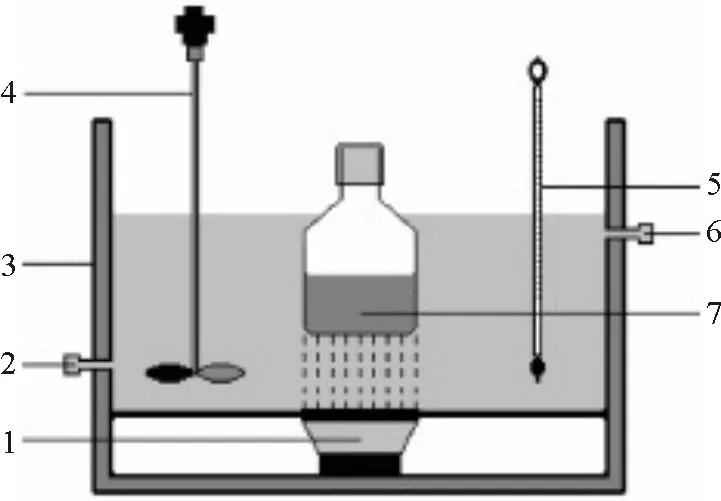
1:超声波发射器;2:进水口;3:水槽壁;4:搅拌桨;5:温度计;6:出水口;7:反应容器
图1 超声协同降解亚甲基蓝的装置图
Figure 1 Illustration of experimental apparatus
1.3亚甲基蓝(MB)降解的实验条件研究
(1)双氧水浓度对MB降解率的影响 恒定其他实验条件(亚甲基蓝 80 mg/L, Co2+1.0 mmol/L, pH 6.5, Zn(Al)O 1.0 g/L, 温度50 ℃±2 ℃), 双氧水初始浓度从0 mmol/L升高到250 mmol/L,超声1 h, 分析亚甲基蓝(MB)降解率的变化.
(2) 初始pH值对MB降解率的影响 恒定其他实验条件(亚甲基蓝 80 mg/L, Co2+1.0 mmol/L, H2O2100 mmol/L, Zn(Al)O 1.0 g/L,温度50 ℃±2 ℃),分析初始pH的改变对MB降解率的影响.
(3) 掺铝氧化锌投加量对MB降解率的影响 恒定其他实验条件(亚甲基蓝 80 mg/L, Co2+1.0 mmol/L, H2O2100 mmol/L, 温度50 ℃±2 ℃,pH 6.5),研究掺铝氧化锌投加量在0~8.0 g/L之间变化对MB降解率的影响.
(4) 亚甲基蓝初始浓度对MB降解率的影响 恒定其他实验条件(H2O2100 mmol/L, Co2+1.0 mmol/L, pH 6.5, Zn(Al)O 1.0 g/L,温度 50 ℃±2 ℃,1 h超声降解时间),研究亚甲基蓝初始浓度的变化对MB降解率的影响.
(5)降解温度对MB降解率的影响 恒定其他反应条件(MB 80 mg/L, H2O2100 mmol/L, Co2+1.0 mmol/L, pH 6.5, Zn(Al)O 1.0 g/L),研究温度从30 ℃上升到50 ℃时对MB的降解率的影响.
1.4不同降解方法对MB降解率的影响
相同降解条件(亚甲基蓝 80 mg/L, H2O2100 mmol/L, Co2+0.3 mmol/L, pH 6.5, 反应温度50 ℃±2 ℃,研究用Fenton-超声-Zn(Al)O、Fenton-Zn(Al)O、Fenton-超声和Fenton对MB降解率的影响.
1.5掺铝氧化锌的循环使用
相同降解条件(亚甲基蓝 80 mg/L, H2O2100 mmol/L, Co2+0.3 mmol/L, pH 6.5, Zn(Al)O 1.0 g/L,反应温度50 ℃±2 ℃),采用Fenton/Co2++超声+掺铝氧化锌体系, 使用循环次数不同的掺铝氧化锌,相同合成条件下获得的ZnO和P25二氧化钛催化剂对MB进行降解实验.
1.6样品的分析和测试
使用X射线粉末衍射仪(北京普析仪器厂, Y-2000型)对Zn(Al)O样品进行晶体结构分析.用扫描电镜(Oxford, Quanta 400, UK)分析氧化锌的形貌和大小. 样品在超声仪(SK2200HP,53kHz/100W,上海科导超声仪器有限公司)上进行分散和超声协同降解. 使用紫外可见分光光度计(UV-1700,Shimadzu)进行亚甲基蓝浓度的测定.
2 结果与讨论
2.1亚微米掺铝氧化锌的性质表征
图2为合成的ZnO和掺铝量3%(摩尔百分数)的Zn(Al)O样品的XRD粉末衍射图.结果显示,合成的ZnO和Zn(Al)O各衍射峰位置和相对强度与JCPDS标准卡中800075号的标准ZnO完全吻合,具有六方晶系纤锌矿结构,少量Al3+的掺杂并未引起晶格的岐变. 只是掺杂Al3+后衍射峰强度减弱, 峰宽增大, 说明Al3+的加入会导致ZnO晶体结晶度适当减弱, 粒径大小也有所减小.

图2 标准ZnO、自制ZnO和Zn(Al)O样品的粉末衍射XRD
Figure 2 XRD patterns of standard ZnO, prepared ZnO and Al3+-doped ZnO
图3A表明,掺铝氧化锌呈棒状, 棒大小为(75 ~150 nm)×(155 ~240 nm)之间,比较均匀. 经过循环使用2次后的氧化锌(图3B)形貌和表面几乎没有什么变化,说明掺铝氧化锌晶体的结晶度高,2次超声作用并未造成形貌和表面的破坏,稳定性好.

图3 Zn(Al)O(A)和循环使用2次后的Zn(Al)O(B)样品的扫描电镜图
Figure 3 SEM images of Zn(Al)O(A) and recycling twice Zn(Al)O(B)
2.2实验条件对亚甲基蓝(MB)降解率的影响
2.2.1 双氧水浓度对MB降解率的影响 在双氧水浓度低于100 mmol/L范围,随着其浓度增加,MB的降解率显著增加(图4). 因为H2O2浓度越高,体系中产生的羟基自由基(OH·)越多,而羟基自由基是导致亚甲基蓝分解的直接因素. 当双氧水浓度超过100 mmol/L后,MB的降解率基本保持不变. 因为过量的H2O2对OH·具有清除作用,且自身的无效分解加剧,导致降解率逐渐降低,因此双氧水的最佳浓度为100 mmol/L.
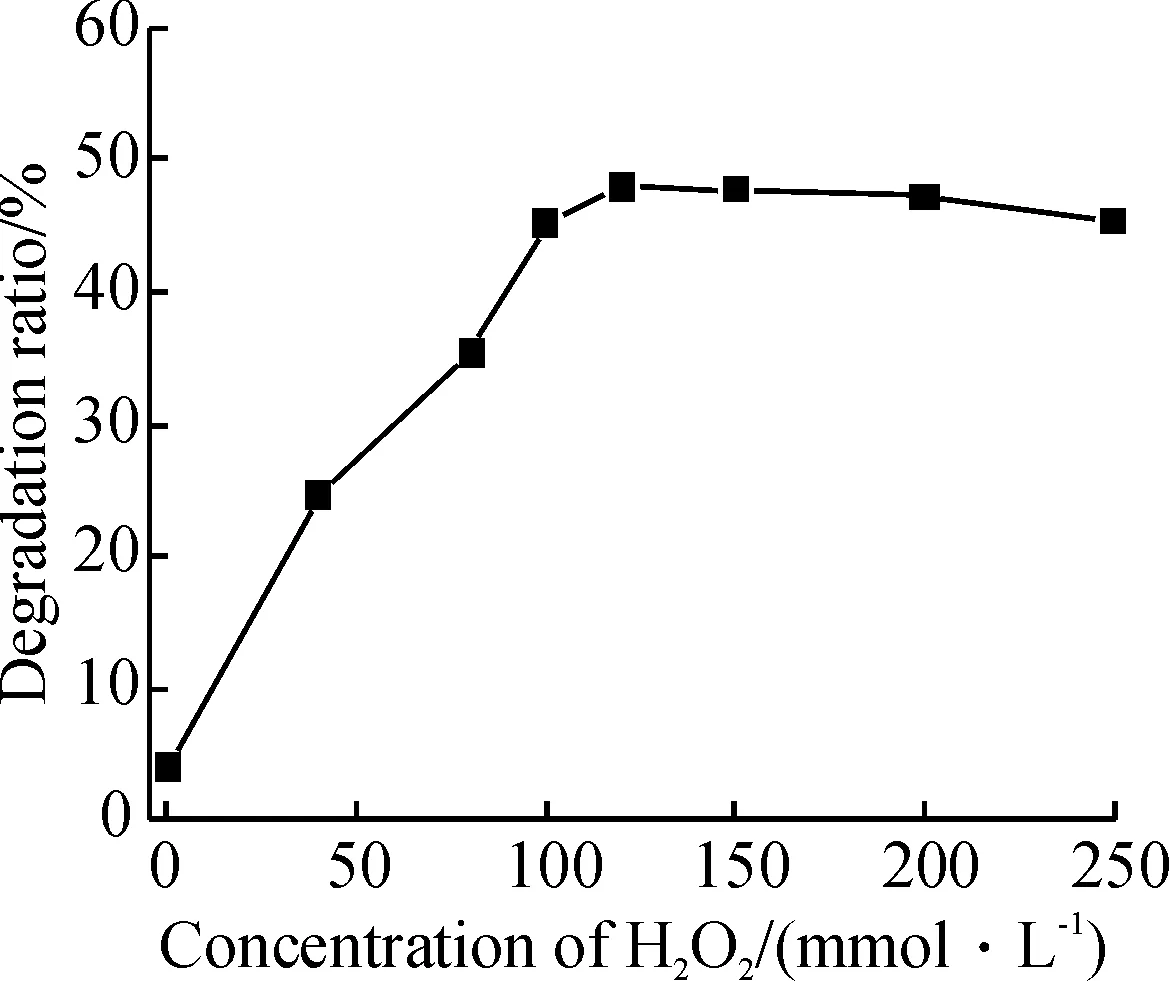
图4 双氧水浓度对亚甲基蓝降解率的影响
Figure 4 Variation of degradation ratio of MB as a function of H2O2concentration


图5 溶液初始pH值对亚甲基蓝降解率的影响
Figure 5 Effect of initial pH in solution variation of degradation ratio of MB
2.2.3 掺铝氧化锌投加量对MB降解率的影响 掺铝氧化锌加量低于1.0 g/L范围,MB的降解率随着投加量的增加显著提高(图6). 投入量超过1.0 g/L后,降解率缓慢增加.有文献[9]证明, 纳米ZnO的存在能够增加体系中OH·的数量. 在Zn(Al)O投加量低时, 其超声分散程度好, 活性表面积大, 催化效果好, 所以MB的降解率显著增加. 当投加量进一步增加时(超过1.0 g/L),由于氧化锌相互碰撞机会增加,容易重聚,导致活性表面减少,另外溶液中高浓度的羟自由基也会自身猝灭,导致降解率略有增加. 因此掺铝氧化锌的最佳投加量为1.0 g/L.
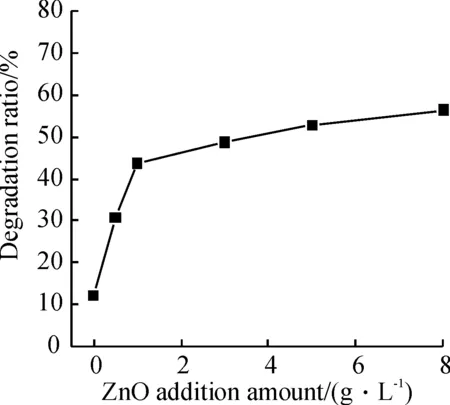
图6 掺铝氧化锌投加量对亚甲基蓝降解率的影响
Figure 6 Effect of degradation ratio of MB as a function of Zn(Al)O addition amount
2.2.4 亚甲基蓝初始浓度对MB降解率的影响 随着亚甲基蓝初始浓度的不断提高,MB降解率依次降低(图7). 因为需要更多的高活性OH·, 而体系在恒定H2O2浓度下产生的OH·量也是恒定的, 所以MB的降解率逐渐减弱,本实验选取适中的80 mg/L作为MB的初始降解浓度.

图7 亚甲基蓝初始质量浓度对MB降解率的影响
Figure 7 Variation of degradation ratio of MB as a function of MB concentrations
2.2.5 降解温度对MB降解率的影响 由于超声作用会使溶液温度升高, 整个反应温度有正负2 ℃的误差是允许的.图8结果显示, 温度从30 ℃上升到50 ℃时,MB降解率略增加, 由于超声产生的空化作用直接导致溶液局部出现非常高的高温, 因而抵消了直接升高反应温度对降解率的贡献. 当反应温度高于50 ℃时,MB降解率明显下降. 因为温度太高导致大量双氧水自身分解放出O2,降低了体系中羟自由基的含量,导致降解率下降, 因此反应温度控制在30~50 ℃之间比较好.
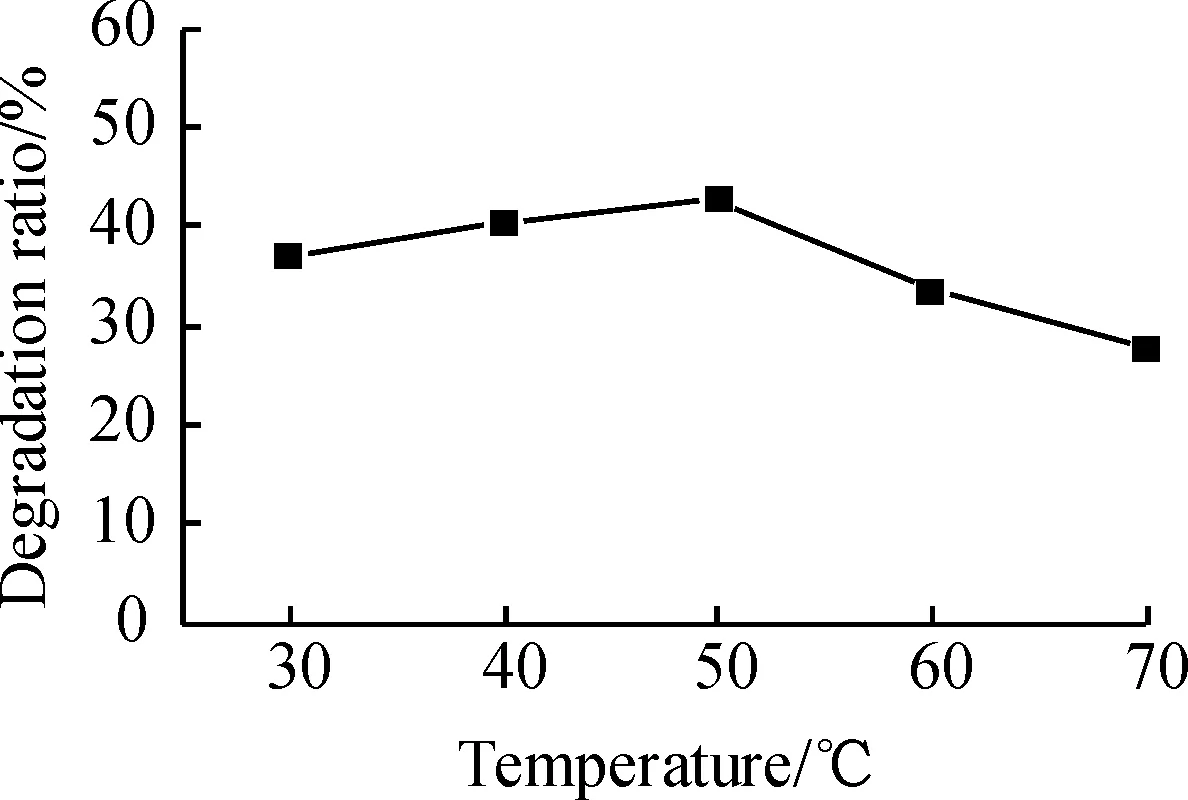
图8 降解温度对亚甲基蓝降解率的影响
Figure 8 Variation of degradation ratio of MB as a function of reactive temperature
2.3降解MB反应的速率常数
有研究[10]证明,H2O2降解MB的反应为一级反应,即ln(At/A0)=-kt,式中:A0为t=0时MB的初始质量浓度,At为经过t(min)时间降解后溶液中MB的浓度,k为反应的速率常数.以ln(At/A0)对t作图,其直线的斜率即为速率常数k值.
结果表明,在MB 80 mg/L, H2O2100 mmol/L, Co2+1.0 mmol/L, 50 ℃±2 ℃, pH 6.5条件下,降解反应在开始的60 min时间内呈直线关系(图9),证明降解反应确实为一级反应,其速率常数k为1.67×10-4s-1.

图9 ln(At/A0)与降解时间的关系
Figure 9 Relationship between ln(At/A0)and irradiation time(t)
2.4钴离子浓度与降解率的关系-降解机理的探讨
在亚甲基蓝 80 mg/L,H2O2100 mmol/L,pH 6.5,温度 50 ℃±2 ℃, 当Co2+的浓度低于0.1 mmol/L时,随着Co2+浓度的增加,降解率显著增大,超过0.3 mmol/L后,降解率又明显减小, 说明Co2+浓度的改变对降解率的影响较大(图10).由于Co2+的存在明显增大了MB的降解率,说明Co2+在体系中起到了与Fe2+相似的作用,即催化作用.
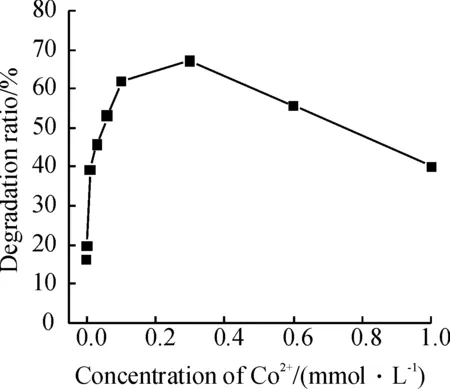
图10 Co2+浓度对MB降解率的影响
Figure 10 Variation of degradation percentage of MB as a function of Co2+concentration
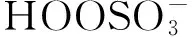
2.5不同降解方法MB降解率的比较
由4种降解方法的结果(图11)显示Fenton+超声+掺铝氧化锌体系(a曲线)降解亚甲基蓝的效果最好. 比较方法c和d发现, 超声作用可一定程度的增加MB的降解率. 因为超声空化作用会产生大量气泡,这些气泡破裂的同时产生瞬间高温高压,能够促进双氧水分解产生羟自由基, 所以超声能增加降解率. 方法b和d比较显示, 掺铝氧化锌的加入能显著提高MB的降解率. 这是因为文献[9]已经证明, 掺铝氧化锌表面可提供催化活性中心, 能使体系中的HO·数量明显增加, 所以MB的降解率显著增大. 如果同时使用超声和掺铝氧化锌, 会使a体系的降解率得到大幅提高. 结果显示,超声1 h后, 对于高质量浓度的MB溶液(80 mg/L), 其降解率高达72%, 说明方法a具有很好的应用前景.

a: Fenton-超声-Zn(Al)O; b: Fenton-Zn(Al)O; c: Fenton-超声; d: Fenton
图11 不同降解方法降解亚甲基蓝
Figure 11 The effects of different degradation methods on degradation percentage of MB
2.6掺铝氧化锌的循环使用
掺铝ZnO的降解率明显高于不掺杂的ZnO(图12),这是因为Zn(Al)O在紫外区的吸收明显好于ZnO, 另外, 掺杂会导致粒子表面引入更多的缺陷和空隙, 而这些缺陷和空隙可能成为活性中心, 导致HO·更容易产生, 从而增大MB的降解率. 循环使用1次的掺铝氧化锌,其降解率从72%降至68%,略有下降, 使用2次后的降解率为46%,下降较明显. 虽然前面的SEM图显示使用2次的掺铝氧化锌外观形状基本不变比, 实验发现使用2次的掺铝氧化锌表面变为蓝绿色, 明显吸附了MB, 导致活性表面减少而部分失活,则羟自由基含量减少,MB的降解率也减小. 值得注意的是, 本文合成的掺铝氧化锌的降解率明显高于二氧化钛P25(降解率约40%), 这是因为P25是一种常用的高效紫外光催化剂, 当有紫外光照射时, 其催化降解有机物的效率是非常高的, 文选用的降解体系适合于在自然光下降解MB.
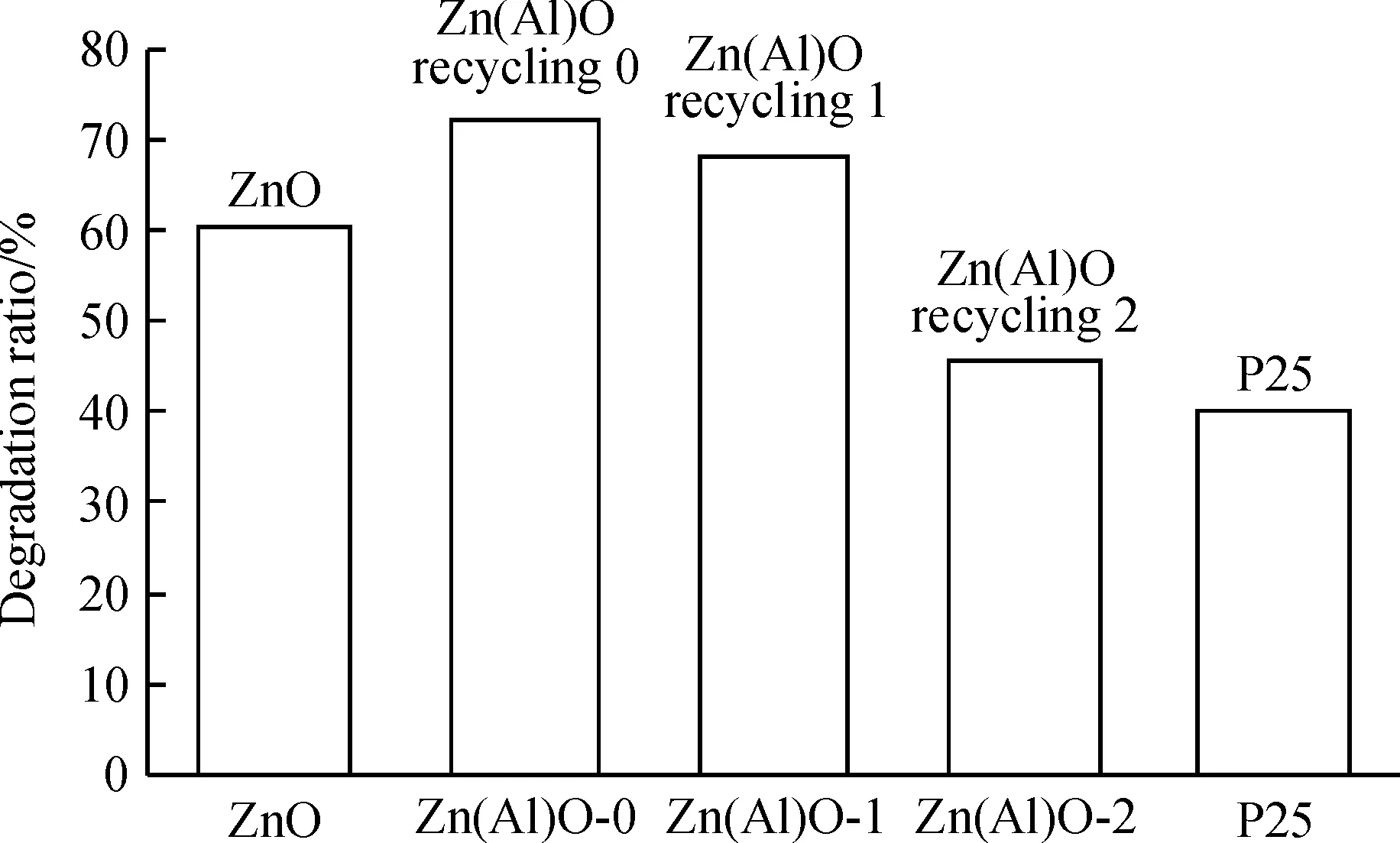
图12 循环使用掺铝氧化锌, ZnO和P25(TiO2)的MB降解率
Figure 12 The degradation percentage of MB of recycling Zn(Al)O, ZnO and P25(TiO2)
3 结论
(1)选择H2O2浓度100 mmol/L, Co2+为0.1~0.3 mmol/L, pH 5~9, 反应温度30~50 ℃, 超声时间60 min的实验条件下MB降解率高.
(2)采用Fenton/Co2++超声+掺铝氧化锌体系,在自然光下超声1 h,可使高质量浓度的MB溶液(80 mg/L)的降解率达72%,比同等条件下的P25高32%,说明该体系适合于在自然光、近常温下降解有机染料如亚甲基蓝.
(3)作为催化剂的掺铝氧化锌,循环使用1次其催化性能基本维持不变,循环使用2次后性能显著下降,主要是MB在表面吸附所致.
[1] SAKTHIVELA S, NEPPOLIANB B, SHANKARB M V, et al. Solar photocatalytic degradation of azo dye: Comparison of photocatalytic efficiency of ZnO and TiO2[J]. Sol Energy Mater Sol Cells, 2003, 77:65-82.
[2] KANEVA N, STAMBOLOVA I, BLASKOV V, et al. Photocatalytic activity of nanostructured ZnO films prepared by two different methods for the photoinitiated decolorization of malachite green[J]. J Alloys Compd, 2010, 500:252-258.
[3] PAUPORTE T, RATHOUSKY J. Growth mechanism and photocatalytic properties for dye degradation of hydrophobic mesoporous ZnO/SDS films prepared by electrodeposition[J]. Micropor Mesopor Mat, 2009, 117:380-385.
[4] ULLAH R, DUTTA J. Photocatalytic degradation of organic dyes with manganese-doped ZnO nanoparticles[J]. J Hazard Mater, 2008, 156:194-200.
[5] XU C, CAO L X, SU G, et al. Preparation, characterization and photocatalytic activity of Co-doped ZnO powders[J]. J Alloys Compd, 2010, 497:373-376.
[6] SUN J H, DONG S Y, FENG J L, et al. Enhanced sunlight photocatalytic performance of Sn-doped ZnO for Methylene Blue degradation[J]. J Mol Catal A: Chem, 2011, 335:145-150.
[7] LEONARD S, GANNETT P M, ROJANASAKUL Y, et al. Cobalt-mediated generation of reactive oxygen species and its possible mechanism[J]. J Inorg Biochem, 1998, 70:239-244.
[8] VERMA P, BALDRIAN P, NERUD F. Decolorization of structurally different synthetic dyes using cobalt(II)/ascorbic acid/hydrogen peroxide system[J]. Chemosphere, 2003, 50:975-979.
[9] YANG Q J, CHOI H, DIONYSLOU D D. Nanocrystalline cobalt oxide immobilized on titanium dioxide nanoparticles for the heterogeneous activation of peroxymonosulfate[J]. Appl Catal: B: Environ, 2007, 74:170-178.
[10] WANG J, JIANG Z, ZHANG Z H, et al. Sonocatalytic degradation of acid red B and rhodamine B catalyzed by nano-sized ZnO powder under ultrasonic irradiation[J]. Ultrason Sonochem, 2008, 15:768-774.
[11] YANG Q J, CHOI H, CHEN Y J, et al. Heterogeneous activation of peroxymonosulfate by supported cobalt catalysts for the degradation of 2,4-dichlorophenol in water: The effect of support, cobalt precursor, and UV radiation[J]. Appl Catal: B: Environ, 2008, 77:300-307.
[12] 褚进辉, 简子聪, 方建章, 等. CTAB微乳体系低温合成纳米TiO2及其光催化性能的研究[J]. 华南师范大学学报:自然科学版, 2010 (4):75-79.
Keywords: Al3+-doped ZnO; ultrasound; Fenton/Co2+system; degradation of methylene blue
UltrasoundAssistedDegradationofMethyleneBluebyFenton/Co2+SysteminthePresenceofZn(Al)O
CHEN Shanshan, WAN Xia*, TIE Shaolong
(School of Chemistry and Environment, South China Normal University, Guangzhou 510006, China)
Al3+-doped ZnO submicron rods were synthesized by one-step precipitation reaction in solution and characterized by X-ray diffraction (XRD) for crystal structure and scanning electron microscopy (SEM) for morphology. The effects of key operating parameters, such as initial pH value, concentrations of H2O2, Co2+and dyestuff, Zn(Al)O dosage, temperature and ultrasonic time on degradation of methylene blue (MB) were studied. Four different decoloring method were compared on the degradation ratio of MB. The optimal condition for degradation of MB was that under Co2+-Fenton process with ultrasound-assisted for 1 h, the most efficient removal ratio for 80 mg/L MB solution was 72% with the conditions of pH 5-9, [H2O2]=100 mmol/L, [Co2+]=0.1-0.3 mmol/L, [Zn(Al)O]=1.0 g/L, and reactive temperature 30-50 ℃. The degradation mechanism for the system of Fenton/Co2++Zn(Al)O+US was discussed. In addition, the recycling experiments of Zn(Al)O were performed three times and the degradation ratios were 72%, 68% and 46% for the 1st, 2nd and 3rd time, respectively. Under natural sunlight with ultrasound-assisted, the degradation ratio of MB in the presence of Zn(Al)O was 1.8 times as great as P25 (degradation ratio is 40%).
2011-04-09
广州市纳米专项(2007Z3-D2041)
*通讯作者,wanxia@scnu.edu.cn
1000-5463(2012)01-0076-06
0614.24
A
【责任编辑 成 文】
