一种Salen双肟类配体及其乙酸铜配合物的合成与表征
2012-11-13冯建华郑建东侯金松王俊海
冯建华,吴 刚,郑建东,侯金松,王俊海
(滁州学院 材料与化学工程学院,安徽 滁州 239000)
一种Salen双肟类配体及其乙酸铜配合物的合成与表征
冯建华,吴 刚,郑建东,侯金松,王俊海
(滁州学院 材料与化学工程学院,安徽 滁州 239000)
以1,2-二胺氧乙烷和4-羟基水杨醛为原料,在无水乙醇溶剂中合成了Salen双肟类配体5,5′-二羟基-2,2′-[乙二氧双(氮次甲基)]二酚(H4L)。以丙酮为溶剂,将H4L与一水合乙酸铜在室温下反应,制备了一种新的Salen双肟类乙酸铜配合物。通过元素分析、核磁共振氢谱、红外光谱、紫外光谱及差热-热重等表征方法得知配合物的可能结构式为[Cu(C16H14N2O6)]·2H2O。
Salen双肟类配体;铜(Ⅱ)配合物;合成;表征
近年来,金属有机Salen型化合物已被作为催化活性物质而用于开发表面改性电极材料,主要用于传感器[1]、非线性光学材料[2]、令人感 兴 趣 的 磁 性 质[3]、生 物 学[4]以及作为超分子体系单元结构等领域和过程[5]。Salen双肟类化合物是用双氧-烷基肟代替Salen类化合物中的双亚胺基而形成的一类新型的具有N2O2四齿配位环境的化合物,该类化合物易与过渡金属盐类形成各种功能型配合物,并通常具有许多与Salen型配合物不同的新的功能和性质[6]。
本文以1,2-二胺氧乙烷和4-羟基水杨醛为原料,在无水乙醇溶剂中合成了Salen双肟类配体5,5′-二羟基-2,2′-[乙二氧双(氮次甲基)]二酚(H4L)。以丙酮作为溶剂,将H4L与一水合乙酸铜在室温下反应,制备了一种新的Salen双肟类乙酸铜配合物。所合成的化合物通过元素分析、核磁共振氢谱、红外光谱、紫外光谱及差热-热重等测试技术得到了表征。测试结果表明,H4L是一种新型的具有六齿配位环境的Salen双肟类化合物,配合物的可能结构式为[Cu(C16H14N2O6)]·2H2O。
1 实验部分
1.1 试剂与仪器
丙酮、无水乙醇、正己烷、三乙胺、N,N-二甲基甲酰胺、4-羟基水杨醛、1,2-二溴乙烷均为分析纯;1,2-二胺氧乙烷参照文献[7]按类似方法合成。
X-4型数字显示显微熔点仪(北京凯维丰公司);Nicolet 6700型傅里叶变换红外光谱仪(美国Thermo公司),400-4000cm-1,KBr压片;Elementar Vario EL型元素分析仪(德国Elementar公司);Avance DRX-400型核磁共振波谱仪(德国Bruker公司),DMF为溶剂,TMS为内标;ZRY-1P型综合热分析仪(上海精密科学仪器公司),空气气氛,升温速率3℃·min-1,走纸速率3mm·min-1,参比物Al2O3;DF-101Z集热式磁力搅拌器(郑州长城科工贸有限公司)。
1.2 配体的合成
H4L(5,5′-二羟基-2,2′-[乙二氧双(氮次甲基)]二酚)参考文献[8]用类似方法合成。分子式:C16H16N2O6,浅粉色微晶,产率:76.0%,m.p.218~220℃。1H NMR(.δ)ppm:4.28(s,4H,-CH2-),6.29(d,J=8.6Hz,2H,ArH),7.28(d,J=2.5Hz,2H,ArH),7.33(dd,J=8.6,2.5Hz,2H,ArH),8.27(s,2H,-N=CH),9.82(d,J=2.5Hz,2H,Ar-OH),9.94(s,2H,Ar-OH)。
1.3 配合物的合成
室温、磁力搅拌下,将含 Cu(CH3COO)2· H2O 0.0401g(0.20mmol)的无水乙醇溶液(7mL)缓慢滴加入到含Salen双肟类配体 H4L0.0665g(0.20mmol)的无水乙醇溶液(7mL)中,溶液立即变为棕黑色,但无沉淀产生。室温,磁力搅拌下继续反应3h后仍无沉淀产生。45°C下,减压蒸发溶液至2~3ml,冷却至室温静置16h左右有大量黑色沉淀产生。抽滤,所得沉淀依次用乙醇∶乙醚(V∶V=1∶3)混合溶剂和乙醚洗涤,真空干燥至恒重得棕黑色固体配合物。
2 结果与讨论
2.1 元素分析
配体H4L及其配合物的元素分析数据见表1。由表1可知,H4L及其配合物的元素分析结果与理论值很接近,由此说明了H4L和其配合物的组成及结构。
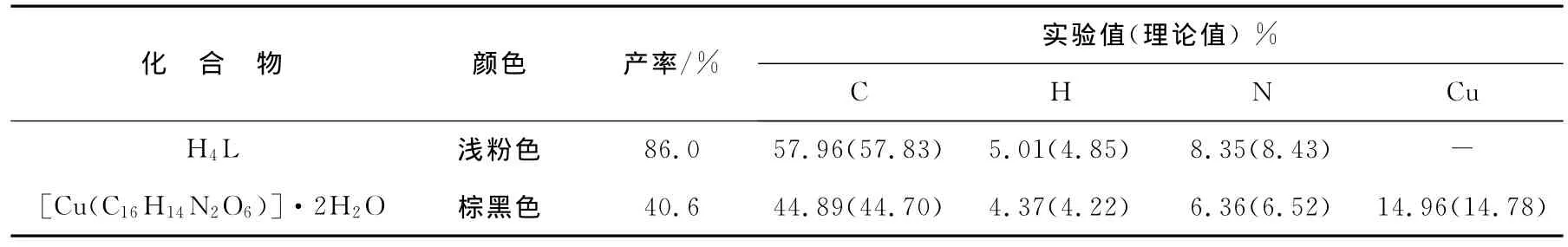
表1 配体H4L及其配合物的元素分析数据
2.2 红外光谱分析
从配体及配合物红外光谱中可以看出,二者的谱图有较大差别,表明铜已经与配体发生了配位,形成了新配合物。形成配合物后,配体在1631cm-1处的C=N伸缩振动带位移至1618cm-1,红移了13cm-1,说明配体中C=N键上的氮原子与Cu(Ⅱ)离子发生了配位作用,形成了Cu-N配位键。配体H4L苯环上的碳羟基伸缩振动带.v(Ar-OH)在 1209cm-1处,而 形 成 配 合 物 后 蓝 移 到1215cm-1附近。同时,配体中苯环上3356cm-1处的OH键的伸缩振动带在形成配合物后位移至3226cm-1,红移了130cm-1,且吸收带变得强而宽,可能是配合物中配体5位和5'位上的羟基分别与水分子形成了氢键的结果。另外,在 配合物 红外光 谱中也分别出现了.ν(Cu-O)和.v(Cu-N)的特征吸收峰[9],进一步说明了配体中 C=N键上的氮原子和Ar-OH上的氧原子确实与Cu(Ⅱ)离子发生了配位作用,同时也验证了配体及配合物的结构与组成。
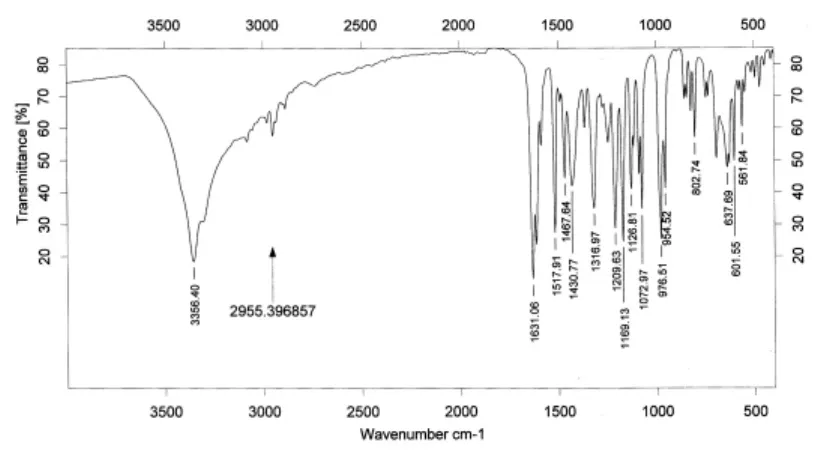
图1 配体H4L的红外光谱
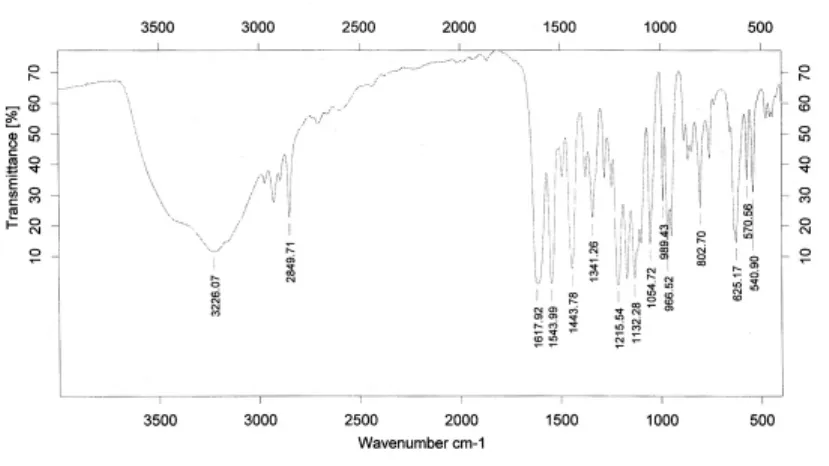
图2 配合物的红外光谱
2.3 紫外光谱分析
H4L及其配合物的紫外光谱分别见图3和图4。由紫外光谱图可以看出,配合物与H4L配体相比较,紫外吸收峰位置及摩尔吸光系数均改变较大,H4L配体中分别在276nm和311nm处出现了强吸收峰,而在配合物中较强吸收峰分别出现在296nm和356nm处,第一谱带的变化可能是由于C=N基团中π-π*电子跃迁产生的,而第二谱带的改变则是由于C=N基团中n-π*电子跃迁产生的[10],表明了Salen双肟类配体的紫外吸收特征,同时也说明Cu(Ⅱ)离子与H4L配体之间确实有键合作用。
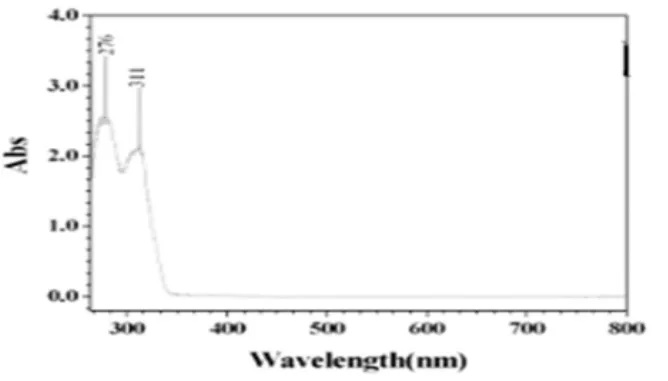
图3 配体H4L的紫外光谱
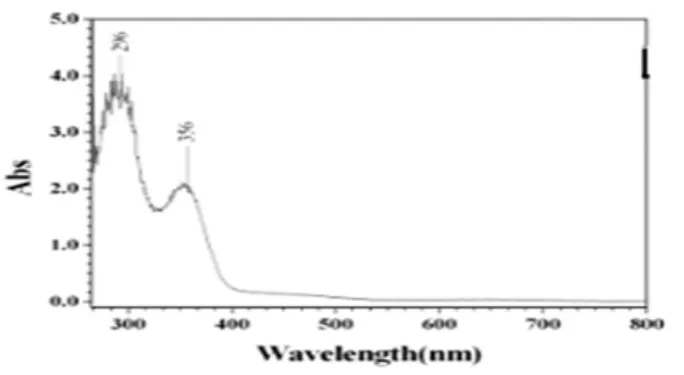
图4 配合物的紫外光谱
2.4 差热热重分析
配体H4L及其配合物的差热-热重分析数据见表2。测定了配体及配合物从50~700℃娣段?内的热性能,由其热性能分析显示,随着温度的不断升高,配体与配合物的热行为明显不同,配体H4L在DTA曲线219℃处有一小而尖锐的吸热峰,伴随TG曲线上没有失重,这是它的熔点,在239℃处有个放热峰,相应的TG曲线上在235℃处开始出现失重直至失重完全,表明配体经一步分解完全。H4L与乙酸铜所形成的配合物中,DTA曲线在121℃处出现一吸热峰,相应的TG曲线上有失重现象,失重率为8.62%,与理论计算失去2个水分子的百分率8.37%非常接近,由于失去水分子的温度不高,可以认为配合物中的2个水分子未参与配位,而是以结晶形式存在的;伴随温度的不断升高,放热峰温度则出现在284℃和342℃处,并伴有明显的失重现象,为配合物中有机部分的失去和不断氧化分解的过程,这一过程总的失重率为81.83%,与理论计算的失重率81.50%基本接近,最终分解产物为CuO,实际测得残重率为18.69%,与理论值18.50%基本吻合,进一步验证了Salen双肟类乙酸铜配合物的组成与结构。
3 结论
金属有机Salen型化合物中肟类化合物的反应速率常数小于该类化合物中亚胺类化合物的反应速率常数,但是前者的反应平衡常数要比后者大几个数量级。因此,肟类Salen型化合物在阻止碳氮双键单元的交换反应方面是具有足够的稳定性的,为了进一步研究Salen双肟类化合物与一水合乙酸铜之间的配位性能,在无水乙醇溶剂中以1,2-二胺氧乙烷和4-羟基水杨醛为原料,成功合成了一种Salen双肟类化合物;并以丙酮为溶剂,该Salen双肟类化合物与一水合乙酸铜反应制备了一种新的Salen双肟类乙酸铜配合物,采用元素分析、核磁共振氢谱、红外光谱、紫外光谱及差热-热重等手段对化合物的结构组成进行了表征,从目前对该类化合物的性质研究结果来看,Salen双肟类化合物有望在磁性、生物活性及功能材料等领域产生较好的应用前景。
[1]Houjou H Nagawa Y Hiratani K.Spontaneous macrocyclization via recombination of a Schiff-base linkage[J].Tetrahedron Lett 2001,42:3861-3863.
[2]Baseer MA,Jadhav V D,Phule R M.Synthesis and antibacterial activity of some new Schiff bases[J].Oriental Journal of Chemistry,2000,16(3):553-556.
[3]Costes J P,Dahan F,Dupuis A.Influence of anionic ligands(X)on the nature and magnetic properties of dinuclear LCuGdX3·nH2O Complexes(LH2standing for tetradentate Schiff base ligands deriving from 2-hydroxy-3-methoxybenzaldehyde and X being Cl,N3C2,and CF3COO)[J].Inorg Chem,2000,39(2):165-168.
[4]Akine S,Taniguchi T,Nabeshima T.Novel synthetic approach to trinuclear 3d-4fcomplexes:specific exchange of the central metal of a trinuclear zinc(II)complex of a tetraoxime ligand with a lanthanide(III)[J].Angew Chem Int Ed,2002,41:4670-4673.
[5]Sun S S,Stern C L,Nguyen S T,et al.Directed assembly of transition-metal-coordinated molecular loops and square from Salen-type components.Examples of metalationcontrolled structural conversion[J].J Am Chem Soc,2004,126:6314-6326.
[6]Dong Wen-kui,Feng Jian-hua,Yang Xiao-qing.Synthesis and crystal structure of a five-coordinated Cu(II)dimer with 4,4'-dibromo-2,2'-[ethylenedioxybis(nitrilomethylidyne)]diphenol[J].Synth.React.Inorg.Met-Org.Nano-Met.Chem,2007,37:189-192.
[7]Dong W K,Feng J H,Yang X Q.Crystal structure of 4,4'-dibromo-2,2'-[(1,3-propylene)dioxybis-(nitrilomethylidyne)]diphenol,C17H16Br2N2O4[J].Z Kristallogr NCS,2006,221:447-448.
[8]Wen-kui Dong,Jian-hua Feng,Li Wang,et al.Synthesis and structural characterization of a novel tetranuclear Cu(II)complex:[Cu4L2(pic)4(H2O)2]·2H2O[J].Trans Met Chem[J]2007,32:1101-1105.
[9]中本一雄.无机和配位化合物的红外和拉曼光谱[M].黄德如,汪仁庆,译.北京:化学工业出版社,1986:76.
[10]Akine S Takanori T Dong Wen-kui,et al.Oxime-based Salen-Type tetradentate ligands with high stability against imine metathesis reaction [J].J Org Chem 2005,70(5):1704-1711.
Synthesis and Characterization of a Salen-type Bisoxime Ligand and its Cupric Acetate Complex
Feng Jianhua, Wu Gang, Zheng Jiandong, Hou Jinsong, Wang Junhai
A Salen-type bisoxime ligand 5,5'-Dihydroxy-2,2'[ethylenedioxybis(nitrilomethylidyne)]diphenol(H4L)was synthesized in anhydrous ethanol solvent by the means of 1,2-bis(aminooxy)ethane with 2,4-dihydroxybenzaldehyde.A novel Salen-type bisoxime cupric acetate complex was also synthesized in acetone by the reaction of H4Land copper(II)acetate monohydrate at room temperature.The compounds were characterized by elemental analysis、1HNMR、IR、UV and TG-DTA.The results indicated that the structural formula of the complex was suggested as[Cu(C16H14N2O6)]·2H2O.
Salen-type bisoxime ligand;Cu(II)complex;synthesis;characterization
O614.3
A
1673-1794(2012)02-0050-03
冯建华(1981-),男,讲师,硕士,主要从事配位化学及精细化工的研究。
安徽省高等学校优秀青年人才基金项目(2010SQRL140);安徽省教育厅自然科学研究基金项目(KJ2010B420);安徽省应用化学省级重点学科建设项目(200802187C)。
2012-03-05
