聚乙烯吡咯烷酮-盐液-固体系分离Cu(II)、Pb(II)、Cd(II)、Cr(II)
2012-11-13刘玉玲张春丽
刘玉玲,卓 馨,张春丽
(宿州学院 自旋电子与纳米材料安徽省重点实验室培育基地,安徽 宿州 234000)
聚乙烯吡咯烷酮-盐液-固体系分离Cu(II)、Pb(II)、Cd(II)、Cr(II)
刘玉玲,卓 馨,张春丽
(宿州学院 自旋电子与纳米材料安徽省重点实验室培育基地,安徽 宿州 234000)
在一定浓度硫酸铵存在的条件下,聚乙烯吡咯烷酮(PVP)水溶液能形成盐水相与聚合物固相。实验研究了Cu(II)、Pb(II)、Cd(II)、Cr(II)与邻苯二酚紫(PV)形成的配合物在聚乙烯吡咯烷酮盐水萃取体系液固两相中的分配行为。探讨萃取酸度、硫酸铵浓度和萃取剂用量等条件对金属离子萃取率的影响,通过控制一定的条件实现Cr(II)与Cu(II)的定量萃取分离。
聚乙烯吡咯烷酮;液-固萃取;邻苯二酚紫;铜(II);铅(II);镉(II);铬(II)
已 有 文 献 报 道 聚 乙 烯 吡 咯 烷 酮 (PVP)[1],曲 通(Triton)X-100[2]和吐温80[3]等非有机溶剂液-固萃取体系,本文根据文献[1]的分相条件,研究在该体系中利用邻苯二酚紫(PV)作萃取剂(同时也是光度显色剂)与金属离子Cu(II)、Pb(II)、Cd(II)、Cr(II)形成的络合物在两相中的分配行为。使用该体系,用控制萃取酸度的方法,定量分离和测定了Cr(II)-Cu(II),该方法多次萃取,操作简便,两相分离后固相用水溶解就可直接用光度法测定,萃取结果较好,与传统有机溶剂液-液萃取体系[4]相比,该体系不使用易挥发的有机溶剂,安全无毒,分相迅速,为金属离子的定量萃取分离开发出了新的萃取体系[5]。
1 实验部分
1.1 仪器
TU-1201紫外可见分光光度计(北京通用仪器有限公司)pHS-3C型酸度计(上海雷磁仪器厂)。
1.2 药品及试剂
聚乙烯吡咯烷酮(PVP)溶液:质量浓度为10%;邻苯二酚紫 (PV)溶液:1.0×10-4molL;Cu2+、Pb2+、Cd2+、Cr2+标准溶液:1.0g·L,按文献[6]方法配制。缓冲溶液:pH1.0~2.5(用 HCl配制),pH3.0~6.5(用 HAc-NaAc配制),pH7.5~13.0(用氨水-NH4Cl配制)。所用试剂皆为分析纯,试验用水为高纯水。
1.3 实验方法
在25mL的比色管中依次加入2g固体(NH4)2SO4,加入少许水溶解,再依次加入5mL聚乙烯吡咯烷酮,1 mLPV(邻苯二酚紫)和无水乙醇(体积1:1)、一定量的缓冲溶液和一定量的金属离子溶液,加水至10mL,振荡2~5min,静置一段时间,有沉淀生成后再放入离心机分离后,将上层的液体倒出然后再将加入一定量的水溶解固体,转入烧杯后用缓冲溶液调节其pH值,转入25ml容量瓶以二次蒸馏水定容,测定吸光度。同时按上述方法用同样体积的蒸馏水替代金属离子的标准液作为试剂参比溶液。按测定金属离子的方法,测定金属离子的质量,进而计算金属离子萃取率E%;以水做参比,用紫外可见光度计测定吸收曲线。
2 结果及讨论
2.1 酸度对金属离子萃取率的影响
根据实验方法,固定其它条件,改变溶液酸度,分别测定酸度对Cu(II)、Pb(II)、Cd(II)、Cr(II)萃取率的影响,结果如图1。
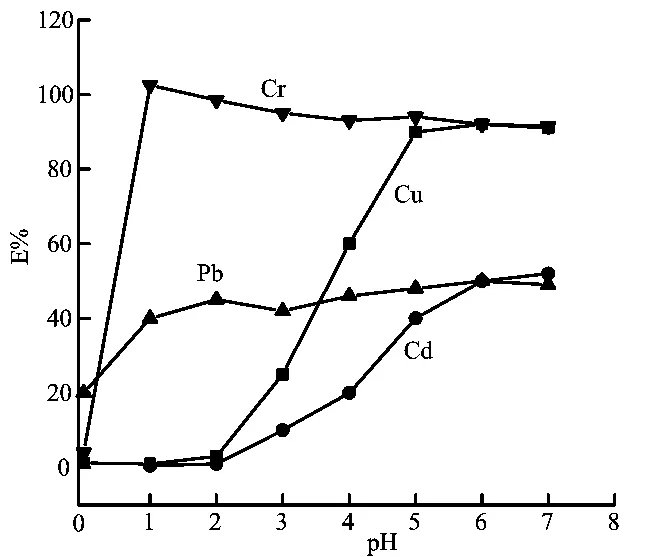
图1 酸度对金属离子萃取率的影响
由图1可知,酸度对金属离子萃取率影响较大,但溶液酸度对不同金属离子的萃取情况影响不同。主要是一方面与它们自身结构有关;另一方面与溶液酸度影响它们的稳定性也有关。在PH>1.00时,Cr(II)有较高的萃取率,而在PH=1.00~2.00时,Cu(II)的萃取率很低,因此控制萃取酸度为1.50,可以实现Cr(II)-Cu(II)的分离。对与Pb(II)-Cd(II),由于在PH=1.00~3.00时,Cd(II)的萃取率较低,但是Pb(II)的萃取率不是很高,所以分离不完全。
同一金属离子,溶液的酸度不同可影响其与萃取剂形成的络合物形态、稳定性及表面电荷等,从而影响高聚物相对金属离子的萃取,因此可借控制溶液酸度,实现金属离子之间的定量分离。
2.2 盐用量对金属离子萃取率的影响
按实验方法,固定溶液酸度(萃取率最大时的pH值)和PV用量,其它条件不变,改变硫酸铵用量,分别测定盐的用量对金属离子萃取率的影响,数据如表1。从表中可以看出,在加入0.5g、1g、1.5g盐时较难有沉淀析出;在2.5~3.0g时萃取率有所下降;而在1.5~2.5之间萃取率较高。在此体系中适量的盐可以与聚乙烯吡咯烷酮形成沉淀,但盐量过多时会产生盐效应影响实验结果,使络合物的稳定性降低,萃取率下降,所以本实验选择盐的加入量为2g。
图2 盐用量对金属离子萃取率的影响
2.3 萃取剂用量对金属离子萃取率的影响
按实验方法,固定其它条件,改变PV(邻苯二酚紫)的加入量,分别测定3种金属离子萃取率结果如表2。由表2可以看出,不加入萃取剂PV(邻苯二酚紫),4种金属离子萃取率几乎都为零,说明简单金属离子本身难被PVP萃取;PV(邻苯二酚紫)溶液用量在0.5~2.5mL时萃取率达最大,且变化不太大,说明金属离子只有与萃取剂形成络合物才有可能被PVP萃取,萃取剂PV(邻苯二酚紫)在此用量范围内与金属离子有较合适的配位比,易与金属离子形成较稳定的配合物而被萃取,所以形成的固相易萃取金属离子配合物,难以萃取简单金属离子。因此在此体系中,PV(邻苯二酚紫)既是配合剂,又是萃取剂。萃取剂PV量少使金属离子络合不完全,而萃取剂PV过量会使金属络合物稳定性降低,都会减少金属离子萃取率,所以本实验选择萃取剂用量为1.0mL。
图3 PV用量对金属离子萃取率的影响
2.4 混合离子的分离
按实验方法,在各种离子萃取率最高时的pH(Cu的萃取酸度为pH=5.50,Cr的萃取酸度为pH=3.00)时,其他条件不变。得到如表1的实验数据:

表1 Cu与Cr分离萃取结果
按实验方法,在各种离子萃取率最高时的pH(Pb的萃取酸度为pH=5.00,Cd的萃取酸度为pH=4.00)时,其他条件不变。得到如表2的实验数据:
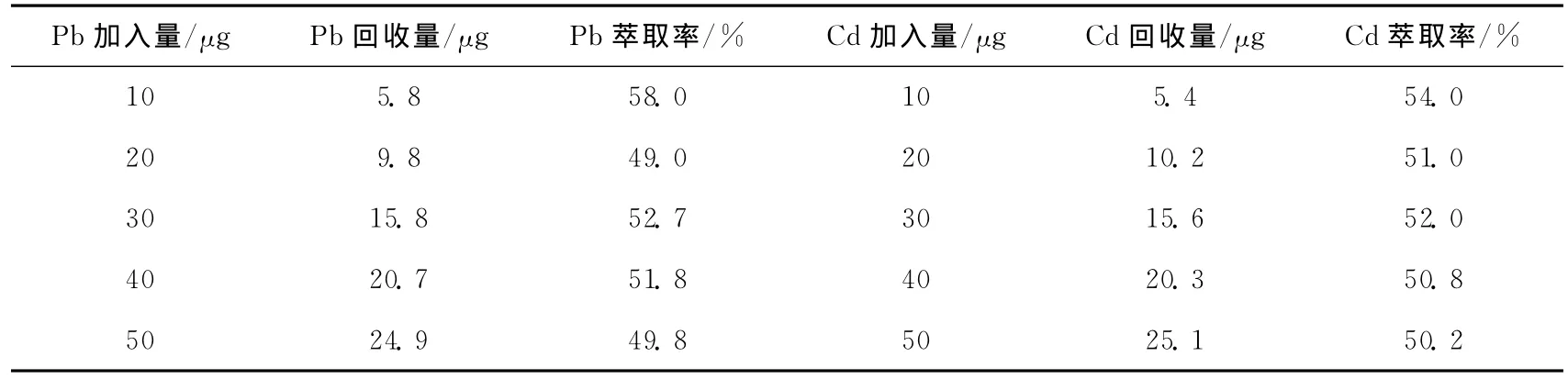
表2 Pb与Cd分离萃取结果
由上述实验得出:控制好条件Cu(II)-Cr(II)能够很好的分离,但是由于在pH=1.00~7.00时,Pb(II)-Cd(II)的萃取率不是很明显,难以得到较好的分离。
[1]李步海,王克富.聚乙烯吡咯烷酮-(NH4)2SO4-H2O液-液、液- 固萃取体系 [J].高等学校化学学报,1990,11(4):336.
[2]孙小梅,莫国明,沈静茹.TritonX-100-盐-水液-固萃取体系分离Co,Cd,Zn[J].化学研究与应用,1998,10(3):253.
[3]李步海,杨波.吐温80-盐-水液-固萃取体系[J].科学通报,1990,3:193.
[4]练 萍,李 蕾.PEG-PVP组合表面活性剂-(NH4)2SO4-H2O 双水相体系萃取 Eu3+的研究[J].稀土,2003,24(3):71-73.
[5]李步海,邹 群,孙小梅.聚合物-盐-水液-固萃取新体系的研究现状与前景[J].分析化学,1998,26(8):1022-1028.
[6]杭州大学化学系分析化学教研室.分析化学手册(第二分册)[M]北京:化学工业出版社,1983:7-10.
Separation of Cu(II),Pb(II),Cd(II)and Cr(II)by Polyvinyl Pyrrolidone/Salt Liquid-Solid System
Liu Yuling, Zhou Xin, Zhang Chunli
In the presence of(NH4)2SO4,the aqueous solution of Polyvinyl Pyrrolidone can form a polymeric solid phase and a salt aqueous phase.The distribution of Cu(II),Pb(II),Cd(II)and Cr(II)between the two phases is examined with pyrocatechol violet as extractant.The effect of the solution acidity,the amount of the extractant and the(NH4)2SO4concentration on the degree of extraction rate of metal ions is investigated.The quantitative extraction separation and determination of Cu(II)-Cr(II)is accomplished by properly adjusting the acidity of the solution.
Polyvinyl Pyrrolidone;Solid-liquid extraction;Pyrocatechol violet;Cu(II),Pb(II),Cd(II)and Cr(II)
TQ322
A
1673-1794(2012)02-0047-03
刘玉玲(1967-),女,安徽宿州人,实验师,研究方向:分析化学。
安徽省教育厅自然科学重点项目(KJ2011Z369);宿州学院科研平台开放课题(2011YKF04);高校省级自然科学研究项目(KJ2011B174)
2012-12-15
