生物以及手术参数对白内障超声乳化术后黄斑中心凹厚度的影响△
2012-11-13陈月芹薛春燕胡钦瑞黄振平
陈月芹 薛春燕 陈 银 朱 婷 叶 芬 胡钦瑞 黄振平
自从1967年开展白内障超声乳化术联合人工晶状体植入术以来,该手术以对组织损伤小、术后恢复快等优点[1],而得到临床医生的广泛欢迎。并随着手术技巧的不断提高以及手术设备的不断完善,术中以及术后并发症相对以往明显减少,术后效果得到显著提高。然而有些患者术后视力存在波动,术后短期内视力较好,但随着时间的延长,特别是术后4~8周[2],视力有所下降,一些研究者推测这可能与术后黄斑厚度增加发生黄斑囊样水肿(cystoid macular edema,CME)有关[3]。白内障术后发生 CME可能与玻璃体对黄斑部的机械牵拉、炎症介质的释放、后囊膜破裂、玻璃体脱失、紫外线损伤等因素有关[4]。光学相干断层扫描(optical coherence tomography,OCT)可以定量测定黄斑部厚度,是观察黄斑部情况的一种简单有效的方法。本研究利用OCT仪测量白内障超声乳化术前以及术后1个月黄斑中心凹厚度的变化情况,并对其可能的影响因素进行相关分析。
1 资料与方法
1.1 一般资料 采集2011年3月至5月于我院行白内障超声乳化联合人工晶状体植入术的单纯白内障患者85例(100眼)。其中男43例(52眼),女42例(48眼),年龄 24~86(70.5±16.6)岁。根据LOCSⅡ分级标准,白内障晶状体核分级平均为2.4±0.9。入选标准:术中、术后无并发症的白内障超声乳化联合人工晶状体植入的单纯白内障患者。排除青光眼、虹膜睫状体炎、老年黄斑变性、视网膜色素变性以及高血压病、糖尿病、全身血管性疾病等影响到视网膜的患者。
1.2 手术方法 使用Infiniti超声乳化仪(Alcon公司),由同一位手术技巧熟练的医师完成。采用透明角膜切口、双手法摘出白内障并植入人工晶状体。
1.3 观察项目 术前以A超测量患者的眼轴长度,记录患者年龄和晶状体核分级情况(LOCSⅡ分级标准)。手术过程中记录所使用的切口累积消散能量(cumulative dissipated energy,CDE)以及超声时间(Infiniti超乳仪上的显示)。记录患者术前、术后的裸眼视力(uncorrected visual acuity,UCVA)以及最佳矫正视力(best corrected visual acuity,BCVA),并由同一位医师采用Zeiss-Humphery公司生产的OCT仪测量术前以及术后1个月的黄斑中心凹厚度。
1.4 统计学方法 本研究使用SPSS 17.0软件进行统计分析,采用t检验、多元线性回归分析,以P<0.05为差异有统计学意义。
2 结果
本次研究85例患者均成功行白内障超声乳化联合人工晶状体植入术,术中未发现有发生后囊破裂、玻璃体脱失、悬韧带断裂、晶状体脱位,亦未发现有发生眼压高、视网膜脱离、眼底出血、眼内炎等并发症的患者。
2.1 视力(LogMAR) 患者术后的 UCVA、BCVA较术前均有明显提高(P<0.001),见表1。
2.2 黄斑中心凹厚度 患者术前黄斑中心凹厚度(154.43±17.43)μm,术后 1 个月黄斑中心凹厚度(182.28 ±30.78)μm,术后比术前平均增加(22.85 ±25.57)μm,差异有统计学意义(t=10.89,P<0.001)。术后1眼(1%)术后2周发生 CME(OCT图像上有明显的低反射)。
2.3 各参数与黄斑中心凹厚度改变的相关性 术后1个月晶状体核分级、超声时间、CDE、眼轴长度分别为 2.40 ±0.90、(42.1 ±37.7)s、10.10 ±12.63、(23.78±1.85)mm,与术后黄斑中心凹增加量均呈正相关(r=0.313、0.256、0.189、0.127,均为 P <0.05),而年龄(70.50 ±16.60)岁与黄斑中心凹增加量无明显相关性(r= -0.038,P=0.386)。
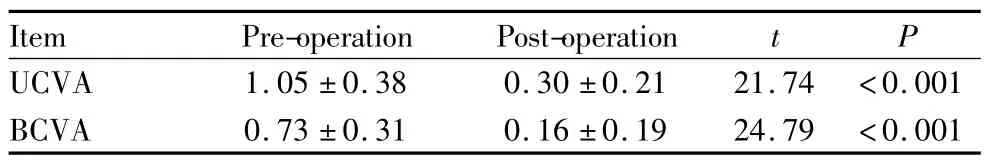
表1 患者术前以及术后1个月的UCVA、BCVATable 1 Comparison of UCVA and BCVA before and 1 month after operation
2.4 黄斑中心凹厚度的改变量与 BCVA(Log-MAR)的相关性 术后1个月,BCVA的负对数BCVA(LogMAR)与黄斑中心凹的增加量呈正相关(r=0.884,P <0.001),即中心凹厚度增加越明显,视力越低。
3 讨论
随着白内障手术从囊内摘出术发展到微切口白内障超声乳化术,其手术方法以及手术设备不断完善,术中以及术后的一些严重并发症明显减少,术后效果显著提高,但CME的发生仍是影响术后视力的一个重要因素[5]。CME可分为亚临床型和临床型[6]。临床型是指眼底镜下、眼底荧光血管造影(fundus fluorescein angiography,FFA)、OCT 均能观察到CME并伴有患者不同程度的视力下降;亚临床型是指FFA或者OCT能观察到黄斑部的改变,但眼底镜下黄斑部无明显改变,不伴有患者视力的下降,或仅表现为对比敏感度的下降。术后发生CME的患者中,一般50%~70%术后6个月内可自行消退,视力得以恢复,但若水肿持续超过6个月,则可能损伤光感受器细胞以及视网膜色素上皮细胞,对视力产生永久性伤害。本研究对行白内障超声乳化术的单纯白内障患者术后1个月黄斑改变情况进行观察,发现术后1个月患者的黄斑中心凹厚度较术前有所增加,1眼术后2周发生CME,予以局部典必殊眼液联合普拉洛芬眼液频繁滴眼,1.5个月后视力恢复至0.6。
白内障术后发生 CME首先是由 Irvine[7]提出的,又称Irvine-Gass综合征。虽然提出至今已有50余年历史,但其发病机制仍未完全清楚。其可能机制为:(1)机械牵拉理论[7]:Irvine认为玻璃体前界膜破裂和后玻璃体对黄斑部的牵拉是产生CME的主要原因。手术过程中玻璃体对黄斑部造成牵拉,局部炎症介质释放作用于黄斑部毛细血管,导致CME的形成。Gulkilik等[6]研究发现不完全玻璃体后脱离患者超声乳化术后发生CME的几率高于完全玻璃体后脱离患者,这一研究发现也证实了玻璃体牵拉理论。本研究发现术后黄斑中心凹增加与眼轴长度呈正相关,可能与眼轴越长,对黄斑部牵拉越强有关。(2)血-视网膜屏障的破坏:手术对虹膜产生刺激,释放炎症介质,以及残存的晶状体上皮细胞合成前列腺素等炎症介质,进入眼后节作用于视网膜毛细血管,破坏血-视网膜屏障,使血管通透性增加,液体积聚于黄斑部而导致CME的发生[8]。术中后囊膜破裂[9]使玻璃体前移,牵拉黄斑部使炎症介质更易进入眼后节,进一步加重了血-视网膜屏障的破坏,从而发生CME。由于本研究术中未有发生后囊膜破裂者,因此未对该因素进行相关分析。(3)术中光、药物等对视网膜的损伤造成血-视网膜屏障的破坏[6]。
OCT仪可以定量测量黄斑中心凹厚度,直观地观察白内障术后黄斑部的变化,无需接触患者,无特殊禁忌,克服了三面镜、FFA等检查方法的弊端,且分辨率高,是诊断黄斑部有无病变的重要仪器。本研究采用OCT仪测量患者术前以及术后1个月黄斑中心凹厚度,并对其可能影响因素进行相关分析。本研究发现患者眼轴长度与术后黄斑中心凹厚度增加存在一定正相关,这可能与眼轴越长,特别是高度近视患者,越易发生前房涌动、眼压不稳,从而越易造成对黄斑部的牵拉有关;并且本研究发现晶状体核硬度越高,术后黄斑中心凹厚度增加越明显,因为晶状体核硬度越高,所需超声时间越长、超声能量越大,对前房扰动越大,从而加重了血-房水屏障的破坏使更多的炎症介质进入眼后节进一步加重了血-视网膜屏障的破坏。此外,本研究并没有发现术后黄斑部的变化与年龄有明显相关性。
许多白内障患者术后短期内视力恢复较好,但随着时间的延长,特别是术后4~8周,BCVA以及对比敏感度会有所下降[9],有研究发现这种视力伴对比敏感度的下降与黄斑中心凹厚度的增加有关[10]。本研究发现术后1个月患者BCVA的负对数与黄斑中心凹厚度的增加呈正相关,即术后黄斑中心凹厚度增加越明显,BCVA越低,这与Otani等[11]人研究结果相似。
综上所述,虽然白内障术后CME发生很少,但中心凹厚度会有所增加,并会对视力产生影响,黄斑厚度增加的程度与核硬度、眼轴长度、超声能量等因素相关。因此在行白内障超声乳化术中,应尽量减少能量的使用,尽量避免前房涌动的发生,减少对眼前节的影响以及对视网膜的牵拉,从而减轻对血-视网膜屏障的破坏,提高术后效果。并且术后应密切观察黄斑中心凹情况,及早发现并预防CME的发生。
1 Kelman CD.Phacoemulsification and aspiration.A new technique of cataract removal.A preliminary report[J].Am J Ophthalmol,1967,64(1):23-35.
2 Von Jagow B,Ohrloff C,Kohnen T.Macular thickness after uneventful cataract surgery determined by optical coherence tomography[J].Graefes Arch Clin Exp Ophthalmol,2007,245(12):1765-1771.
3 Nicholas S,Riley A,Patel H,Neveldson B,Purdie G,Wells AP.Correlations between optical coherence tomography measurement of macular thickness and visual acuity after cataract extraction[J].Clin Experiment Ophthalmol,2006,34(2):124-129.
4 Mathys KC,Cohen KL.Impact of nepafenac 0.1%on macular thickness and postoperative visual acuity after cataract surgery in patients at low risk for cystoid macular oedema[J].Eye,2010,24(1):90-96.
5 Kim A,Stark WJ.Are topical NSAIDs needed for routine cataract surgery[J]?Am J Ophthalmol,2008,146(4):483-485.
6 Gulkilik G,Kocabora S,Taskapili M,Engin G.Cystoid macular edema after phacoemulsification:risk factors and effect on visual acuity[J].Can J Ophthalmol,2006,41(6):699-703.
7 Irvine SR.A newly defined vitreous syndrome following cataract surgery[J].Am J Ophthalmol,1953,36(5):499-619.
8 Asano S,Miyake K,Ota I,Suqita G,Kimura W,Sakka Y.Reducing angiographic cystoid macular edema and blood-aqueous barrier disruption after small-incision phacoemulsification and foldable intraocular lens implantation:Multicenter prospective randomized comparison of topical diclofenac 0.1%and betamethasone 0.1%[J].J Cataract Refract Surg,2008,34(1):57-63.
9 Nagpal M,Nagpal K,Nagpal PN.Postcataract cystoid macular edema[J].Ophthalmol Clin North Am ,2001,14(4):651-659.
10 Hee MR,Puliafito CA,Wong C,Duker JS,Reichel E,Rutledge B.Quantitative assessment of macular edema with optical coherence tomography[J].Arch Ophthalmol,1995,113(8):1019-1029.
11 Otani T,Kishi S,Maruyama Y.Patterns of diabetic macular edema with optical coherence tomography[J].Am J Ophthalmol,1999,127(6):688-693.
