壳聚糖凝胶的制备及应用研究进展
2012-11-10陈世兰周小涛重庆科技学院化学与生物工程学院重庆401331
陈世兰,陈 勇,周小涛,吴 瑶 (重庆科技学院化学与生物工程学院,重庆 401331)
壳聚糖凝胶的制备及应用研究进展
陈世兰,陈 勇,周小涛,吴 瑶 (重庆科技学院化学与生物工程学院,重庆 401331)
介绍了壳聚糖凝胶的制备方法,阐述了壳聚糖微凝胶和壳聚大块凝胶的类型及其性能研究进展,并对相关研究进行了评价。
壳聚糖;微凝胶;复合凝胶;药物释放
壳聚糖具有生物相容性、生物降解性,且降解产物无毒等特性,使其在生物医学研究领域备受关注,其中有关药物控制释放体系的研究较多,根据不同功能需求,研究者们采用不同的方法制备了不同尺寸的壳聚糖凝胶和壳聚糖复合凝胶。在用作药物控制释放载体材料的研究早期,主要制备仅以壳聚糖为原料对环境pH值响应的凝胶体系,随着生物医学对载体材料的功能化要求的提高及研究者对载体材料的深入研究,壳聚糖复合凝胶应运而生,随之产生的还有对环境pH值、温度、盐(或盐浓度)、磁场、光等产生响应的多功能壳聚糖复合凝胶。为此,笔者阐述了壳聚糖凝胶的制备方法,总结分析研究现状,为壳聚糖凝胶的研究提供参考。
1 壳聚糖凝胶的制备方法
1.1化学交联法
用化学交联法合成凝胶通常需要加入化学交联剂,而壳聚糖的化学交联是利用其分子骨架上的C2位氨基和C6位羟基(见图1),因而壳聚糖的化学交联剂有醛类(如甲醛,戊二醛,乙二醛等)、京尼平(一种中药成分,见图2)[1]、乙二醇缩水甘油醚、聚乙二醇、异氰酸酯类[2]及环氧氯丙烷等。此外,还可将壳聚糖改性,使其带有不饱和双键,再与其他物质发生化学反应生成交联型聚合物。

图1 壳聚糖结构式
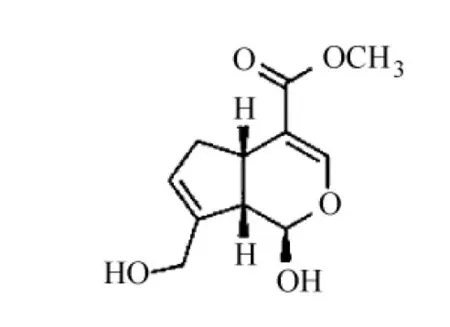
图2 京尼平结构式
壳聚糖衍生物大多是利用壳聚糖分子骨架上的活性基团经过化学改性后的产物,由于改性过程中活性基团不可能完全参与反应,因而制备壳聚糖衍生物凝胶也可选用相应交联剂,如N-羟丙基十二烷基二甲基氯化铵改性壳聚糖可用环氧氯丙烷交联,羧甲基化壳聚糖、羟丙基化壳聚糖等可用戊二醛交联。此外,还可以根据改性时新引入基团的性质选择相应的交联剂。迄今,大多壳聚糖的化学交联剂为毒性较高的醛类,若壳聚糖用作生物医用材料,需探索交联性能较好且无毒或低毒副作用的新型化学交联剂。
1.2物理交联法
物理交联法主要包括离子交联法和辐射交联法。离子交联法形成的凝胶中无共价交联键桥,而辐射交联法形成的凝胶中大多是共价交联键桥。离子交联型壳聚糖凝胶仅在极酸或极碱的条件下才解离,表现出更显著的pH值响应性。常见离子交联剂有多元酐、多元酸和多元酸盐等。易文清等[3]采用三聚磷酸钠和六偏磷酸钠为复合交联剂,制备了离子交联的壳聚糖微球,其对环境离子强度和pH值的改变产生响应,在酸性介质中溶胀度可达到357%,且凝胶没有任何破碎。Dambies等[4]以钼酸盐为交联剂, 制备出具有薄的外层和含有小孔内层的微球结构,为核壳结构壳聚糖微球的合成提供了新的思路。笔者[5]曾采用柠檬酸三钠为离子型交联剂制备了具有核-壳结构的壳聚糖凝胶粒。
壳聚糖为阳离子型聚电解质,可与阴离子聚电解质通过静电作用形成物理交联型凝胶。笔者[6]考察了水溶液中壳聚糖与聚甲基丙烯酸的复合作用,发现两者之间的作用本质主要为库伦引力,并初步确定了大分子间的复合结构模型。利用2种聚电解质间的静电作用合成酸性或碱性条件下均能溶胀的凝胶,有望拓展凝胶的应用范围。
辐射交联法是从聚合物或单体出发合成凝胶的方法,该方法无需添加化学引发剂或其他助交联的化学物质,辐射能量高且辐射剂量可控,因而该方法具有产物纯净、反应易激发、反应温度低、反应易控、操作简便的优点。常用的辐射方法有60Co衰变产生的γ-射线、高能电子束及紫外光等。
2 壳聚糖微凝胶的类型
2.1仅以壳聚糖为基质的微凝胶
随着壳聚糖在生物医药领域的广泛应用,越来越多的人进行微胶囊及纳米微球的研究,发明了许多制备壳聚糖微球的方法。何强芳等[7]以壳聚糖为载体, 以真空泵油和石蜡油相混合为油相,以span-80和硬脂酸镁为复合乳化剂,通过乳液-化学交联法制备了5-氟脲嘧啶(5-Fu)壳聚糖微球,所得微球的药物包封率达43.6%~84.8%。在pH分别为7.4和3.9的缓冲溶液中进行的药物释放试验表明,5-Fu与壳聚糖质量比、交联剂用量及释药介质的pH值均对微球的释药速率产生影响,且壳聚糖与5-Fu之间有较强的分子间作用力,微球球形规整,分散性好。药物分子除在合成时包埋于材料中,还可以通过被动吸附方式担载,避免药物接触有机试剂引起活性损失。Filipovic等[8]采用喷雾干燥法制备了卡马西平/壳聚糖-羟丙基纤维素聚合物微球,发现微球对药物的包封率和释放特征依赖于所制备微球的聚合物组成、聚合物分子量和药物与聚合物的比例,药物包封率低的微球较包封率高的微球能更好地控制药物释放。但喷雾干燥时温度较高,不宜用于制备载药体系。施晓文等[9]用反相悬浮交联法制得了多孔改性壳聚糖微球,发现交联剂浓度、壳聚糖与聚乙二醇(PEG2000)的重量比对微球的粒径和孔径有明显影响,PEG2000用量越大则微球的粒径和孔径越大,但对阴离子交换容量影响不大。与牛血清蛋白(BSA)的吸附表明,交联密度对吸附率有较大影响。Fujita等[10]将不同的肝磷脂(非抗凝血剂,HA)加入含有乳糖的壳聚糖(壳聚糖-LA)水溶液中制得注射型壳聚糖-LA/HA微凝胶,研究了壳聚糖-LA/ HA对纤维原细胞增长素(FGF-2)的固定作用,发现该微凝胶在皮下(老鼠体内)注射后20d后可生物降解,且在注射部位附近有新血管和含纤维组织形成。
2.2壳聚糖复合微凝胶
为改善壳聚糖微凝胶的性能(如强度、载药性、响应性等),可将其他物质引入壳聚糖微凝胶形成壳聚糖复合微凝胶。王宏丽等[11]利用海藻酸钠(SA)聚阴离子及壳聚糖聚阳离子电解质的性质,以顺铂(DDP)为模型药,采用乳化交联法制备SA-DDP缓释微凝胶,根据静电吸附原理合成SA/DDP/壳聚糖复合载药微凝胶,微凝胶圆整,载药微凝胶表面致密且分散性好,微凝胶粒径在11.0~58.8μm之间,采用原子吸收分光光度计对载药微凝胶的载药率、药物包封率和药物体外释放性质进行测试,发现使用该载药微凝胶可减少药物的投放量和投放次数,降低了毒副作用。谢宇等[12]采用磁性Fe3O4纳米颗粒为磁核,用反相悬浮聚合法制备了磁性壳聚糖复合微凝胶,考察了壳聚糖浓度、乳化剂用量、交联剂浓度、搅拌速度等参数对壳聚糖成球的影响,并在特定试验条件下制得形貌光滑、粒径为0.5~2μm的磁性壳聚糖复合微凝胶。Yan等[13]利用带有相反电荷的壳聚糖和聚L-谷氨酸,通过层层自组装制备聚电解质中空微胶囊,其对疏水抗癌药物的负载率较高且对药物持续缓慢释放,因而在生物医药领域具有较好的应用前景。Chellat等[14]合成了壳聚糖/黄原胶聚电解质微凝胶,在模拟生理介质中考察了该微凝胶的降解行为,用高精密液相色谱以氨基葡萄糖和N-乙基-氨基葡萄糖为参比测定壳聚糖的降解程度,发现在培养时间(15d)内降解产物为壳聚糖低聚物。
3 壳聚糖大块凝胶的类型
壳聚糖微凝胶可包覆药剂,用于特定区域的药物释放,但大多药物释放速率较快,而壳聚糖大块凝胶则主要用于药物的长效释放,可避免药物快速释放对人体造成伤害。
3.1壳聚糖/合成大分子复合凝胶
天然高分子组成的凝胶在生物相容性、细胞控制降解、应用安全上有潜在优势,然而该材料稳定性较差,而合成大分子凝胶能精确控制其功能,可供选择的品种较多。与天然材料相比,合成材料必须严格控制材料中混杂的未反应单体、小分子副产物等,以避免可能由此产生的生物不相容性和药物的不良相互作用等问题。Torre等[15]研究了羟氨苄青霉素三水化合物及羟氨苄青霉素钠从壳聚糖/聚丙烯酸(PAA)凝胶中释放的释放行为,发现壳聚糖与PAA间的相互作用以及聚合物与药物间的相互作用影响了药物的释放,且羟氨苄青霉素三水化合物仅随凝胶的溶胀和消溶胀而释放,而羟氨苄青霉素钠与聚合物间存在离子键相互作用,延缓了药物的释放。Swami等[16]用光聚合技术(不含任何光引发剂和交联剂)合成了壳聚糖/聚N-乙烯基吡咯烷酮(PVP)及壳聚糖/聚(N-乙烯基吡咯烷酮-co-甲基丙烯酸羟乙酯)(P(NVP-co-HEMA))的IPN凝胶,研究发现壳聚糖/PVP凝胶较壳聚糖/P(NVP-co-HEMA)凝胶表现出较高的溶胀能力及较快的药物(茶碱)释放速率。通过细胞增殖试验可知,上述凝胶具有良好的生物相容性。El-Sherbiny等[17]以2,2-二甲氧基-2-苯基苯乙酮为光引发剂,通过辐射N-丙烯酰甘氨酸和壳聚糖的混合物制备温度/pH双重敏感的IPN凝胶,考察了凝胶在pH值为2.1和7.4的缓冲溶液中的溶胀行为(不同温度下),并以5-Fu为模型药物,测定上述pH环境中的释放行为,结果显示酸性介质中药物释放速率较快。壳聚糖与合成大分子复合凝胶的性能较好,但其生物相容性及相容本质、降解性及降解本质商待明确。
3.2壳聚糖/天然高分子复合凝胶
用天然多糖作为药物载体,具有生物相容性好、制备条件温和及免疫原性低等优点,因而备受关注。刘群等[18]以乳化内部凝胶化法制备了海藻酸钠-壳聚糖微胶囊(ACM微胶囊),考察了成膜反应过程中影响微胶囊膜强度的几个主要参数,初步探讨了海藻酸钠与壳聚糖2种高分子间发生聚电解质络合反应的机制。李沙等[19]采用乳化胶凝法制备ACM微胶囊,通过差示扫描量热法探讨其成型机理,并以BSA为模型药来研究微胶囊对大分子药物的包载能力及释药特性,发现随药载比增加、壳聚糖浓度升高,微囊中载药量也明显增加。Das等[20]利用天然大分子果胶与壳聚糖形成凝胶,研究发现当交联环境pH值为1.5、壳聚糖浓度为1%、果胶与药物用量比为3∶1时,壳聚糖/果胶中药物可于肠部定位释放。尽管由天然高分子化合物制得的载药体系无毒副作用,但载药体系的强度还有待改善。
4 结 语
壳聚糖凝胶的制备方法中,化学交联法和物理交联法各有优缺点,因此,可开发能结合2种交联方法优势的新型交联体系。壳聚糖微凝胶用于载药体系的前景较好,但其载药量及载药效率较低,对药物的缓慢控制释放能力较差,而壳聚糖与合成大分子形成载体材料的性能较好,但需明确其生物相容性及降解本质。同时,壳聚糖与天然高分子形成的载药体系强度还需提高。此外,对控制药物释放的载体材料的多功能化、生理毒副作用等相关问题是今后需要重点研究的内容。
[1]Harris R, Lecumberri E, Heras A. Chitosan-Genipin Microspheres for the Controlled Release of Drugs: Clarithromycin, Tramadol and Heparin[J].Marine Drugs 2010,8(6):1750-1762.
[2] 杨媛,李立华,容建华,等. 新型生物降解交联剂的制备及其在壳聚糖交联膜中的应用[J].材料科学与工程学报,2004,22(2):292-295.
[3]易文清,李新法,陈金周,等.壳聚糖水凝胶微球的制备与溶胀性能[J].功能高分子学报,2010, 23(4): 396-399.
[4]Dambies L, Vincent T, Domard A, et al. Preparation of chitosan gel beads by ionotropic molybdate gelation [J].Biomacromolecules, 2001,2(4):1198-1112.
[5]Chen S L, Liu M Z, Jin S P, et al. Preparation of ionic-crosslinked chitosan-based gel beads and effect of reaction conditions on drug release behaviors[J]. Int J Pharm, 2008, 308:180-187.
[6]Chen S L, Liu M Z, Jin S P, et al. Structure and properties of the polyelectrolyte complex of chitosan with poly(methacrylic acid) [J]. Polym Int, 2007, 56: 1305-1312.
[7]何强芳,李国明,巫海珍,等. 5-氟尿嘧啶壳聚糖微球的制备及其释药性能[J].应用化学,2004,21(2):192-196.
[8]Filipovi-Grci J,Perissutti B,Moneghini M,et al. Spray-dried carbamazepine-loaded chitosan and HPMC microspheres: preparation and characterisation[J].J Pharm Pharmacol,2003,55(7): 921-931.
[9]施晓文,肖玲,杜予民,等.球形改性壳聚糖的制备及吸附牛血清蛋白性能的研究[J].武汉大学学报(理学版), 2002,48(2):188-192.
[10] Fujita M,Ishihara M,Simizu M, et al. Vascularization in vivo caused by the controlled release of fibroblast growth factor-2 from an injectable chitosan/non-anticoagulant heparin hydrogel[J].Biomaterials 2004, 25:699-706.
[11]王宏丽,陈风雷,陈涛,等.海藻酸钠/壳聚糖缓释微球的制备及性能[J].云南大学学报(自然科学版),2010,32 (4): 469-472.
[12]谢宇,魏娅,李明俊,等.磁性壳聚糖复合微球的制备及表征[J].机械工程材料, 2009(12):59-62.
[13]Yan S,Zhu J,Wang Z,et al. Layer-by-layer assembly of poly(L-glutamic acid)/chitosan microcapsules for high loading and sustained release of 5-fluorouracil[J]. Eur J Pharm Biopharm, 2011,78(3): 336-345.
[14]Chellat F, Tabrizian M, Dumitriu S, et al. Study of biodegradation behavior of chitosan-xanthan microspheres in simulated physiological media[J]. J Biomed Mater Res 2000, 53:592-599.
[15] Torre P M, Enobakhare Y, Torrado G, et al. Release of amoxicillin from polyionic complexes of chitosan and poly(acrylic acid). Study of polymer/polymer and polymer/drug interactions within the network structure[J]. Biomaterials, 2003,24:1499-1506.
[16] Ng L T, Swami S. IPNs based on chitosan with NVP and NVP/HEMA synthesized through photoinitiator-free photopolymerisation technique for biomedical applications[J].Carbohyd Polym, 2005,60:523-528.
[17]El-Sherbiny I M, Lins R J, Abdel-Bary E M, et al. Preparation, characterization, swelling and in vitro drug release behaviour of poly[N-acryloylglycine-chitosan] nterpolymeric pH and thermally-responsive hydrogels[J]. Eur Polym J,2005,41:2584-2591.
[18]刘群,薛伟明,于炜婷,等. 海藻酸钠-壳聚糖微胶囊膜强度的研究[J].高等学校化学学报,2002, 23(7):1417-1420.
[19]李沙,侯新朴. 海藻酸钠-壳聚糖微囊成型机理及其对大分子药物的载药、释药研究[J].药学学报 2003, 38(5):380-383.
[20] Das S, Chaudhury A, Ng K Y. Preparation and evaluation of zinc-pectin-chitosan composite particles for drug delivery to the colon: Role of chitosan in modifying in vitro and in vivo drug release[J].Int J Pharm, 2011, 406:11-20.
[编辑] 李启栋
10.3969/j.issn.1673-1409(N).2012.04.005
O636.1
A
1673-1409(2012)04-N013-04
2012-02-16
重庆市教委科学技术研究项目(KJ111412);重庆市自然科学基金项目(CSTC,2008BB4358)。
陈世兰(1980-),女,2003年大学毕业,博士,讲师,现主要从事智能高分子材料方面的教学与研究工作。
