流场流分离技术在聚合物相对分子质量分布及微粒分布测定中的应用
2012-11-09罗春霞侯家祥张龙贵郭梅芳乔金樑
罗春霞,侯家祥,张龙贵,郭梅芳,乔金樑
(中国石化 北京化工研究院,北京 100013)
流场流分离技术在聚合物相对分子质量分布及微粒分布测定中的应用
罗春霞,侯家祥,张龙贵,郭梅芳,乔金樑
(中国石化 北京化工研究院,北京 100013)
场流分离作为一种新的分析技术,逐渐被用来分离和表征聚合物、生物大分子和聚合物微粒。介绍了作为场流分离技术之一的流场流分离(FlFFF)技术的原理。重点综述了常温 FlFFF 技术在聚电解质等水溶性聚合物及聚合物乳胶粒水分散体系的分离和表征中的应用,以及高温 FlFFF 技术在高相对分子质量聚烯烃的分离和表征中的应用。讨论了 FlFFF 技术相对于GPC 技术的优势及目前存在的问题,指出了 FlFFF 技术在高相对分子质量聚合物分析中的应用前景。
场流分离;流场流分离;相对分子质量分布;聚合物;微粒
聚合物相对分子质量的多分散性是其最基本特征之一,聚合物材料的机械性能、加工性能及它们在溶液中的特性等都与其相对分子质量及其分布密切相关。很多类型的色谱技术可用于分离聚合物,使用最普遍的是依据分子尺寸进行分离的GPC 技术[1],但凝胶固定相的渗透极限和排阻极限、对试样的剪切降解和吸附均限制了 GPC 技术的分离能力和应用范围。随聚合物新材料合成技术的飞速发展,迫切需要具有更高分辨率和灵敏度、更广应用范围的新的分析型分离技术来分析高分子材料的相对分子质量、化学组成和分子结构等详尽信息。
场流分离技术能以多种方式克服传统色谱技术的局限性[2-9]。场流分离技术是一种不使用固定相就能快速而温和地分离分子(或微粒)尺寸为1 nm~100 μm 的聚合物[10-31]、生物大分子[32-35]、微凝胶和纳米粒子[36-41]的技术[3-4,42-43]。根据分离场类型的不同,场流分离技术通常分为流场流分离(FlFFF)、热场流分离、沉降场流分离、电场流分离和重力场流分离技术等。其中,FlFFF 技术是最常用、最适于分析聚合物的技术,可测试聚合物的相对分子质量及其分布和分子链尺寸等参数。
本文介绍了作为场流分离技术之一的 FlFFF技术的原理,并阐述了常温 FlFFF 技术及高温FlFFF 技术在聚合物的分离和表征中的应用。
1 场流分离技术的原理
1.1 场流分离模式
场流分离技术是美国 Giddings[44]于1966 年提出的,是一种基于洗脱的色谱分离方法。不同类型的场流分离技术的基本工作原理相同。根据试样的分子(或微粒)尺寸大小,场流分离技术的分离模式分为正常分离模式(Normal mode)和空间位阻模式(Steric mode)(见图1)。
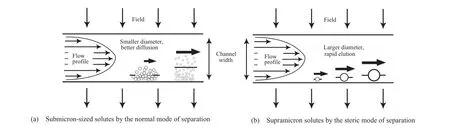
图 1 场流分离机理Fig.1 The mechanisms of fi eld- fl ow fractionation separation[22].
分子(或微粒)尺寸小于 1 μm 的试样的分离模式为正常分离模式,工作原理如图1(a)所示:试样的分离在一个很窄的带状微通道(宽高比大于100)即分离流道中进行,试样在分离流道中由于毛细管力而产生呈抛物线型的层流,中心线上流速最大;同时从外侧面施加的、垂直于层流方向的场力驱使试样向分离流道的下壁(多孔选择性的渗透膜,仅溶剂分子能透过)运动和聚集;而且由于布朗运动,试样向分离流道的中心线方向扩散,扩散速率主要取决于试样分子(或微粒)的尺寸;试样被分布在距分离流道下壁不同距离的位置,从而产生不同的移动速率,分子(或微粒)尺寸越小的试样越靠近分离流道的中心线,从而越先被洗脱出来而到达检测器。
分子(或微粒)尺寸大于 1 μm 的试样的分离模式为空间位阻模式,工作原理如图 1(b)所示:忽略试样的扩散运动,因此分子(或微粒)尺寸小的试样更靠近分离流道的下壁,从而较晚到达检测器。
由于现有聚合物的分子(或微粒)尺寸通常小于 1 μm ,故按照正常分离模式(扩散起主要作用)对聚合物进行分离。本文只讨论正常分离模式下FlFFF 技术的基本原理及该模式在聚合物分析中的应用。
1.2 FlFFF原理
FlFFF 技术是众多场流分离技术中适用性最广的一种,最适于表征聚合物。FlFFF 技术中使用的分离场是一股独立的交叉液流,该液流以适当的角度横穿分离流道,使分子(或微粒)尺寸不同的试样处于流道中不同的流速层面上,从而实现分子(或微粒)尺寸不同的试样在不同的时间到达分离流道出口而被分离。FlFFF 技术可分离的试样分子(或微粒)的尺寸为 1 nm~100 μm。
最初的 FlFFF 装置是 1976 年 Giddings 等[45]提出的对称流场流分离(sFlFFF)装置,其分离流道结构如图 2(a)所示。sFlFFF 装置的分离流道是由两个半渗透膜构成其上下壁面[5];作为分离场的交叉流垂直于分离流道的轴向,从分离流道的上壁面流入再从下壁面流出,使试样富集在下壁的半渗透膜上;试样由于布朗运动向分离流道的中间扩散,分子(或微粒)尺寸不同的试样处于流道中不同的流速层面上,可在不同的时间被分离。
1987年 Giddings 等[46]又设计了非对称流场流分离(AsFlFFF)装置,其分离流道结构如图 2(b)示。与 sFlFFF 装置相比,AsFlFFF 装置的分离流道下壁由半渗透膜构成,上壁则由载流液无法通过的刚性玻璃板构成,单通道液流被分成作为载流液的通道流和作为分离场的交叉流两部分,二者的比例可自由调节。
与 sFlFFF 装置相比,AsFlFFF 装置具有结构简单、成本低、易于观测实验进展和易于分离检测等优点[47-48];AsFlFFF 技术不仅包括试样在交叉测得试样的相对分子质量,能有效克服常规分离技术中的很多限制。

2.1.1 常温 FlFFF 技术在水溶性聚合物分析中的应用
FlFFF 过程温和,能保持聚电解质及其聚集体在分离通道中的完整性[11]。由于 FlFFF 技术无需使用固定相,对试样吸附作用弱,因此到达检测器的试样量多。
Duval 等[12]利用 sFlFFF - MALLS - RI 联用技术测试疏水改性的普鲁兰多糖(一种支链淀粉),得到了摩尔质量分布的信息(见图3),约90%的普鲁兰多糖能被有效分析。
Glinel 等[13]利用 GPC 技术分析该类疏水改性的普鲁兰多糖时发现,仅60%的普鲁兰多糖能到达检测器,这是由于疏水链段与 GPC 固定相之间的相互作用导致一部分试样不能到达检测器所致。由此可见,利用 FlFFF 技术能得到更好的测试结果和更多的信息。
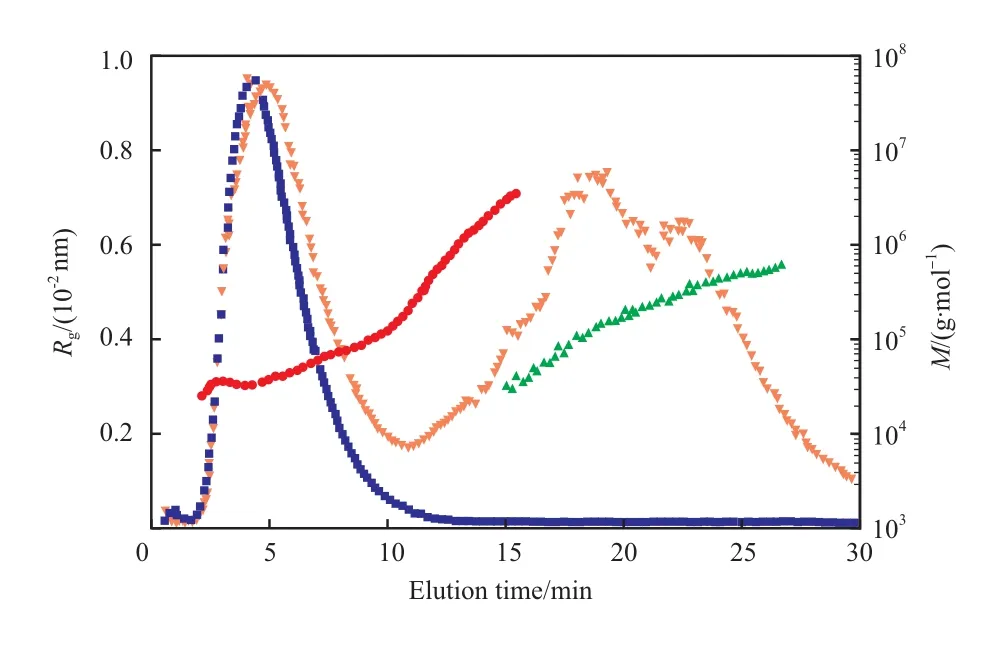
图 3 sFlFFF - MALLS - RI 联用技术测试疏水改性的普鲁兰多糖(溶剂为氨基丁三醇)的摩尔质量和回转半径的分布、RI 信号和 MALLS 信号[12]Fig.3 Molar mass(M) and gyration radius(Rg) distributions, RI and MALLS signals versus elution time of hydrophobically modi fi ed pullulans in tris-hydroxy-methylaminomethane by means of sFlFFF- MALLS-RI[12].

FlFFF 技术无需使用固定相,对试样的剪切作用小。Yohannes等[14]利用 AsFlFFF、GPC 和动态光散射技术分析了水溶性聚异丙基丙烯酰胺均聚物(PNIPAM)及其与聚氧乙烯(PEO)的嵌段共聚物(PNIPAM -b- PEO)体系。对于重均相对分子质量(Mw)为 6 000 的低相对分子质量的试样,AsFlFFF 与 GPC 技术测得的结果吻合得很好(见图4);对于Mw=160 000 的高相对分子质量的PNIPAM,AsFlFFF 技术测得分子尺寸分布与光散射技术测得的结果相近,而 GPC 技术测得的Mw偏低(为33 000)(见图5),这是由于聚合物在色谱柱中剪切降解所致。
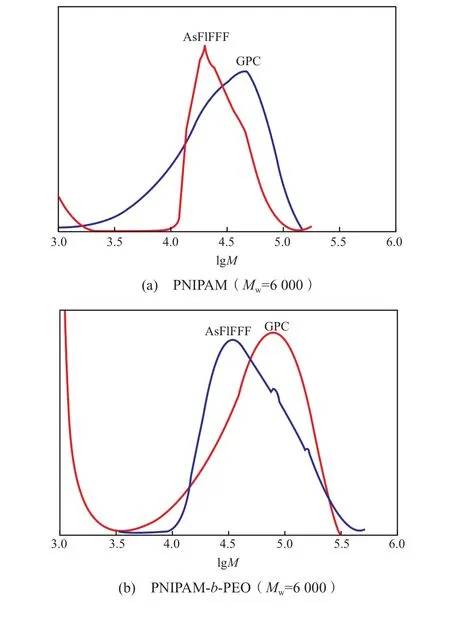
图 4 分别利用AsFlFFF和GPC技术测得的 PNIPAM 及 PNIPAM -b - PEO的摩尔质量分布[14]Fig.4 Molar mass distributions of PNIPAM and PNIPAM-b-PEO by means of AsFlFFF and GPC respectively[14].
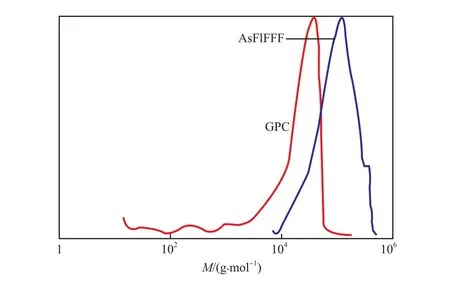
图5 分别利用 AsFlFFF 和 GPC 技术测得的 PNIPAM(Mw =160 000)的摩尔质量分布[14]Fig.5 Molar mass distributions of PNIPAM (Mw =160 000) by means of AsFlFFF and GPC respectively[14].
2.1.2 常温 FlFFF 技术对分子尺寸大的聚合物的分析
FlFFF 技术可程序控制分离场的交叉流的流速,以实现对不同性质的试样进行完全分离。Thielking等[16]利用 sFlFFF - MALLS - IR 联用技术成功地分离了摩尔质量大且分布很宽((1.8 ~300)×104g/mol)的磺化聚苯乙烯(PS)标样的混合物(见图6)。通过控制交叉流的流速,改善了FlFFF技术对聚合物的分离效率和检测质量,优化了分离效果。
Leeman 等[17]利用程序控制交叉流的流速,分析了普鲁兰多糖标样的混合物。研究结果表明,当交叉流的流速按指数衰减时,sFlFFF - MALLS -IR 联用技术对较高相对分子质量的试样具有更好的分离效果。
Lee 等[18]通过考虑优化场程序(即交叉流速率的变化方式)和实验条件(如载流液的盐离子强度、试样浓度和进样量)实现了对透明质酸钠体系的分离。
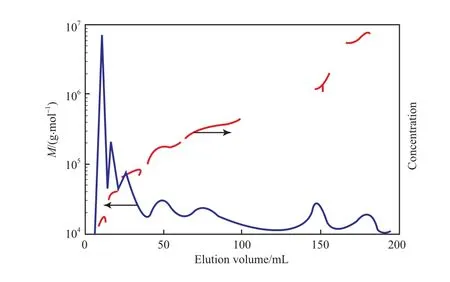
图 6 sFlFFF-MALLS - IR 联用技术测得的7个磺化PS标样混合物的摩尔质量分布[16]Fig.6 Molar mass distributions of the mixture of seven sulfonated polystyrene standard samples by means of sFlFFF-MALLS-IR[16].
由于 AsFlFFF 技术所需的时间较短以及试样受到的作用小,因此 AsFlFFF 技术适于对分子(或微粒)尺寸很大的试样进行分析;另外,AsFlFFF技术的分辨率高且它与 MALLS 联用时具有更强的信号,使得 AsFlFFF 技术普遍应用于水溶性聚合物的分析。利用 AsFlFFF 技术对淀粉、纤维素、支链淀粉和透明质酸钠等各种聚多糖的分析已发展得较成熟。如用AsFlFFF - MALLS - RI 联用技术分析摩尔质量为 107~109g/mol 的支链淀粉时发现[19-20],试样与分离膜之间的电荷作用力随交叉流的流速和试样浓度的增加而增大,这将导致试样因吸附在分离膜表面而损失,以至于分离不可重复。通过在载流液中加入表面活性剂或调节载流液的离子强度,不仅可屏蔽分离膜与试样之间的电荷作用力,还可屏蔽聚电解质分子链之间的电荷作用力以抑制其聚集[11]。此外,sFlFFF - MALLS - RI 联用技术由于分离效果好和试样的回收量高,还可用于评价支链淀粉和糖苷的支化结构[21]。
Anderson 等[15]利用sFlFFF - MALLS - RI 联用技术,在不同的交叉流流速下测定了乙基羟乙基纤维素的摩尔质量分布(见图 7)。由此可见,该技术可分离和表征摩尔质量高达 9.9×109g/mol 的试样,这正是FlFFF技术优于 GPC 技术的一个最大的优势。
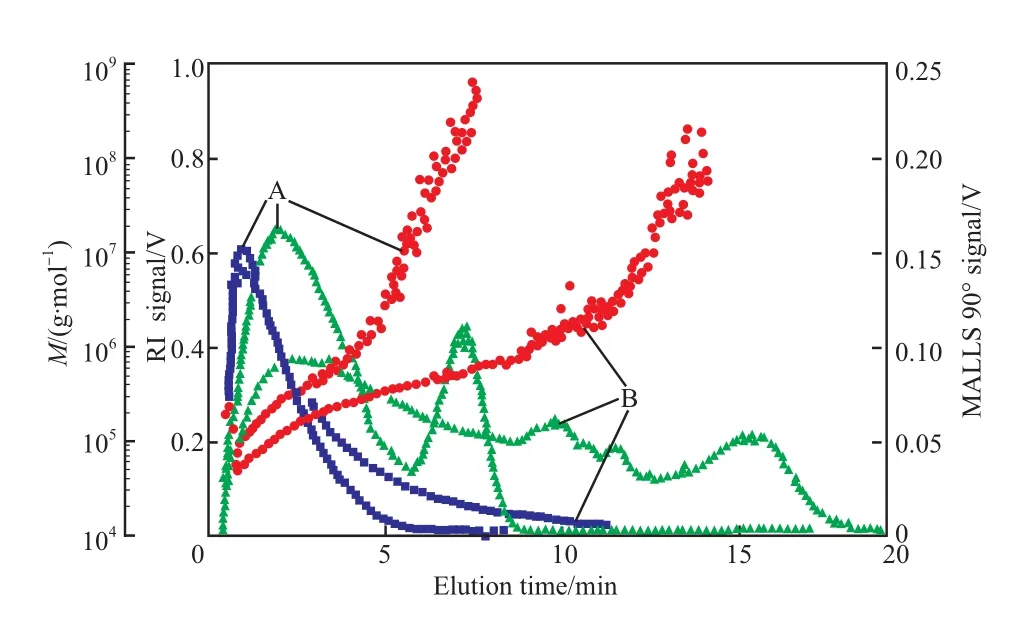
图 7 利用 AsFlFFF - MALLS - RI 联用技术在两种交叉流流速下测得的乙基羟乙基纤维素的摩尔质量分布、MALLS 90°和 RI 的信号[15]Fig.7 Molar mass distribution,RI and MALLS signals versus elution time of ethylhydroxyethyl cellulose at two different cross- fl ow rates by means of AsFlFFF-MALLS-RI[15].

部分水解聚丙烯酰胺(HPAM)是目前国内外产量最大的合成水溶性聚合物之一,被广泛应用于石油开采。我国聚合物驱油技术主要采用的聚合物是 HPAM,其Mw通常大于1.0×107,分子链上有极性较强的离子基团,并且其相对分子质量具有多分散性的特点,因此准确测定其相对分子质量及其分布的难度很大。而相对分子质量及其分布是评价 HPAM 的重要参数,直接影响 HPAM 在溶液中的分子链尺寸和溶液的物化特性,因此准确测定驱油用超高相对分子质量 HPAM 的相对分子质量及其分布是十分重要的。
高相对分子质量 HPAM 的黏度大且对剪切敏感,不适于用填充柱式的 GPC 方法测试。研究者初步探索了利用AsFlFFF 技术测定 HPAM 的摩尔质量及其分布[22-24]。Hecker 等[22]利用 AsFlFFF -MALLS - RI 联用技术分别对 HPAM 的标样和商品进行了分析,能够在 2h 内测出试样的摩尔质量分布数据。大部分商品化 HPAM 溶液与标样的分离谱图相近,但有一些 HPAM 溶液会形成亚微米缠结线团和粒径可达 20 μm 的超微米聚集体(见图8)。由于空间位阻分离模式的机理不同于正常分离模式,超微米聚集体与按正常模式分离的小尺寸(小于1 μm)分子链发生共洗脱,无法正确分辨和表征。
商品化 HPAM 溶液(见图9)与 HPAM 标样溶液的测试结果[23]对比表明,商品化 HPAM 溶液放置 2 d 后未出现超微米的聚集结构;随放置时间的延长,聚集现象加重,但聚集程度随 HPAM 浓度的降低及无机盐的加入而降低。由此可见,HPAM的进样浓度不能太高;但浓度过低时,由于光散射信号弱而无法检测。因此,现有的 AsFlFFF 技术还有待进一步优化,以提高超高相对分子质量 HPAM试样到达检测器的量和增强光散射信号。
2.1.3 FlFFF 技术在聚合物微粒分离中的应用
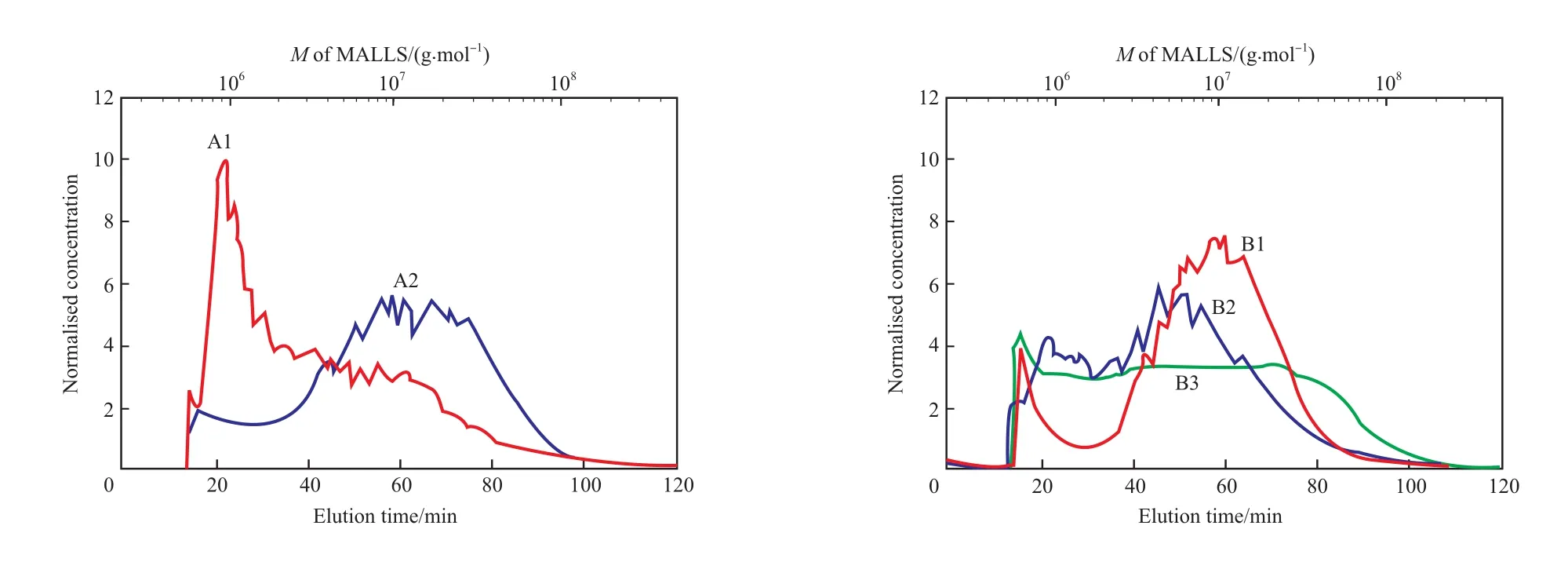
图 9 商品化 HPAM 在标准条件下放置 2 d 后的 AsFlFFF 分离[22]Fig.9 AsFlFFF separations of commercial HPAM samples aged for 2 d under the standard conditions[22].
AsFlFFF 技术还可用于表征聚合物乳胶粒水分散体系的粒径分布。Moon 等[25]利用 AsFlFFF 技术分离 5 种不同直径(0.050,0.135,0.222,0.300,0.426 μm)的PS乳胶粒标样的混合物(见图10)时发现,AsFlFFF 技术能快速分离PS乳胶粒,并能在较宽的粒径范围内保持高的分辨率。
图 8 HPAM 水溶液的 3“相”洗脱[22]Fig.8 Generalized elution of the three "phases" of HPAM in aqueous solution[22].
Othegraven 等[26]采用无表面活性剂的乳液聚合法合成了核为多晶氟碳化合物(MFA)、壳为高度交联PS的 MFA - PS 核 - 壳乳胶粒。AsFlFFF - UV联用技术分析结果显示,MFA-PS 乳胶粒为核-壳结构,且乳胶粒的平均半径为103.4 nm,粒径的分散度为 8.4%,即粒径呈窄的单峰分布(见图11),说明体系中没有二级成核的均聚物 PS。该结论与其他表征手段的结果相符。
由于聚乙二醇化能延长明胶纳米粒子在生物体内的寿命,使明胶纳米粒子按生物体需要释放一定的药剂量,因此聚乙二醇化是明胶纳米粒子在生物应用中的重要的表面修饰法。
Zillies 等[27]利用AsFlFFF - RI 联用技术评价了聚乙二醇化的明胶纳米粒子,并通过对比 RI 测得的峰面积测量了聚乙二醇化的明胶纳米粒子的数量。
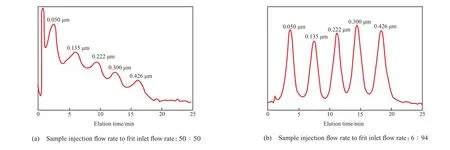
图 10 多孔入口的 AsFlFFF 对 5 种不同直径(0.050,0.135,0.222,0.300,0.426 μm)的乳胶粒标样混合物的分离[25]Fig.10 Separation of the mixture of fi ve latex standards with different diameters(0.050,0.135,0.222,0.300,0.426 μm) by stopless fl ow injection in a frit inlet AsFlFFF[25].
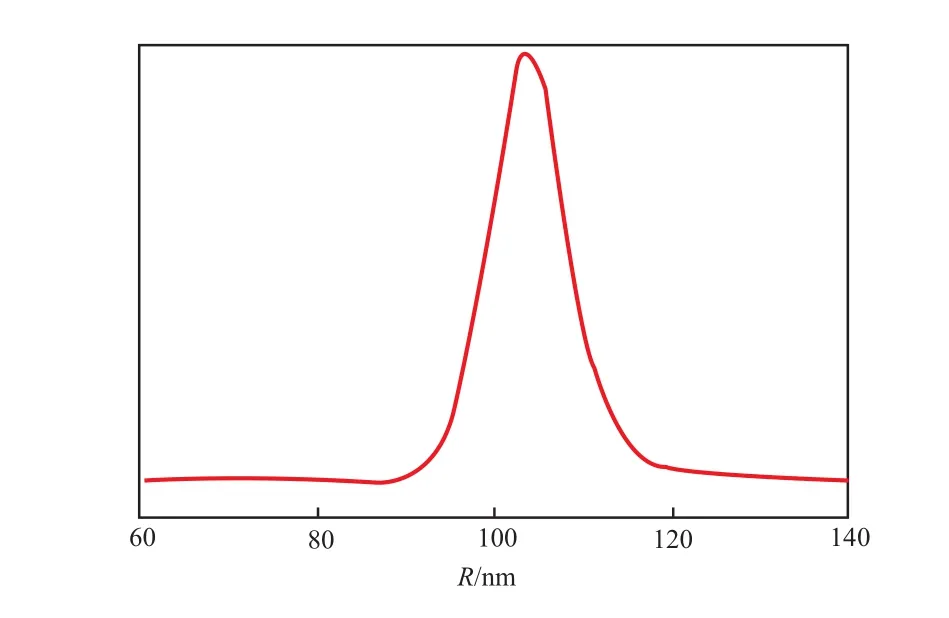
图 11 AsFlFFF-UV 联用技术测得的 MFA-PS 核-壳乳胶的粒径及其分布[26]Fig.11 Particle radius(R) and its distribution of MFA-PS core-shell latex by means of AsFlFFF-UV[26].
2.2 高温 AsFlFFF 技术在聚合物分析中的应用
升高测试温度一方面可提高场流的分离能力和缩短测试时间[5,28],另一方面可增强聚合物的溶解性、提高分子的扩散速率及减小峰宽。在过去很长一段时间内,FlFFF 技术的应用仅限于水溶性体系。
目前高温 AsFlFFF 技术是高温 GPC 技术的有力补充。高温 AsFlFFF 技术对高相对分子质量的试样具有更好的分离效果,而高温 GPC 技术对低相对分子质量的试样具有更好的分离效果[29]。因为高温 AsFlFFF 技术的流道下壁面的半渗透膜为多孔陶瓷材料,聚合物中低相对分子质量的部分会随载流液一起透过该膜而流失,导致测得的摩尔质量分布偏窄。对于 PS,高温 AsFlFFF 技术能有效分离摩尔质量最小为 50 000 g/mol 的试样部分[30]。
结合高温 GPC 技术[29],基本可解决高温AsFlFFF 技术在测量过程中低相对分子质量部分的流失问题。对此,迫切需要发展新的膜材料和膜结构以从根本上解决此问题。
高温 GPC 技术由于存在对试样的剪切降解和色谱柱的排斥极限,无法分离和检测聚烯烃试样中的超高相对分子质量的部分。
Mes 等[30-31]采用了高温 AsFlFFF 技术与MALLS、IR、黏度联用,成功地分析了超高相对分子质量的高密度聚乙烯(HDPE)以及低密度聚乙烯(LDPE)试样,并将分析结果与高温GPC 技术的测试结果进行了对比(见图12)。对于LDPE,高温 GPC 技术洗脱的曲线上出现了高摩尔质量对应的肩峰(由于色谱柱的排斥极限所致),由于色谱柱不能分离试样中高相对分子质量的部分,从而无法准确计算平均相对分子质量以及长链的支化度。高温 AsFlFFF 的分离曲线上则未出现异常的分离峰,能成功分离和表征摩尔质量高达 9.9×108g/mol的各部分。
利用高温 GPC 技术测试 LDPE 时(如图13(b)所示),回转半径与摩尔质量的对数曲线会轻度向上弯曲,这是由于高相对分子质量的部分与正常洗脱的低相对分子质量的部分同时到达检测器(即共洗脱)所致;而从图 13(a)可知,高温 AsFlFFF 技术则能分离更高相对分子质量的部分,并给出更多的信息。
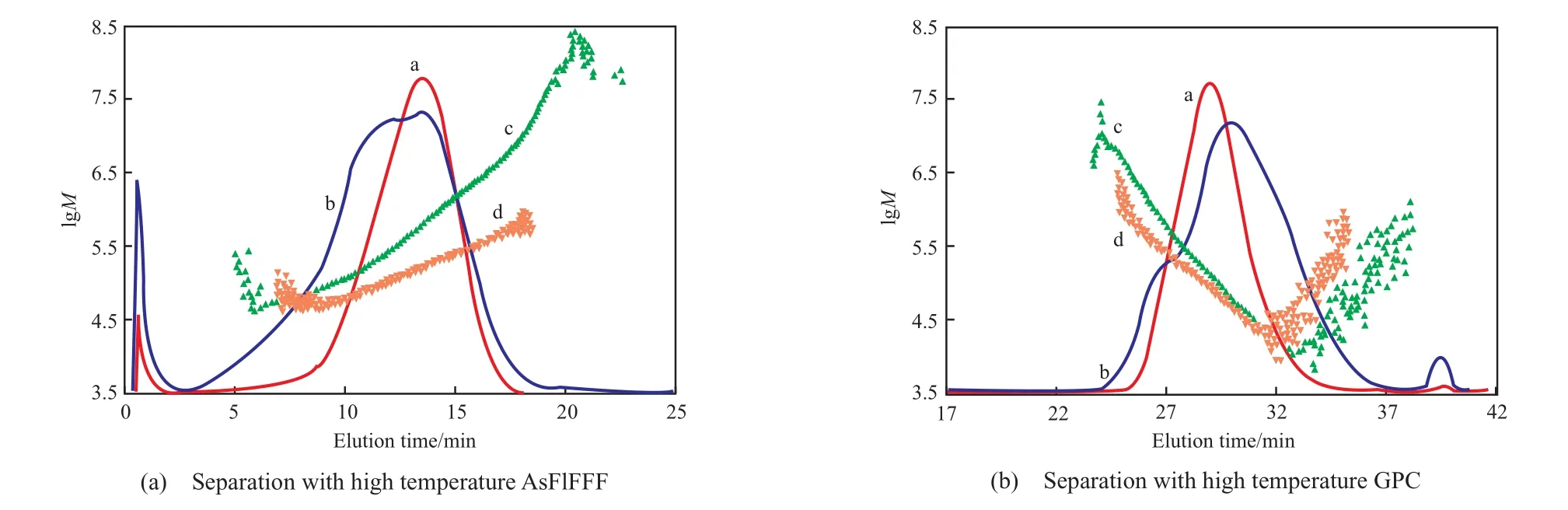
图 12 HDPE 和 LDPE 的洗脱曲线和摩尔质量分布[30]Fig.12 IR signals and molar mass distributions of LDPE and HDPE samples[30].
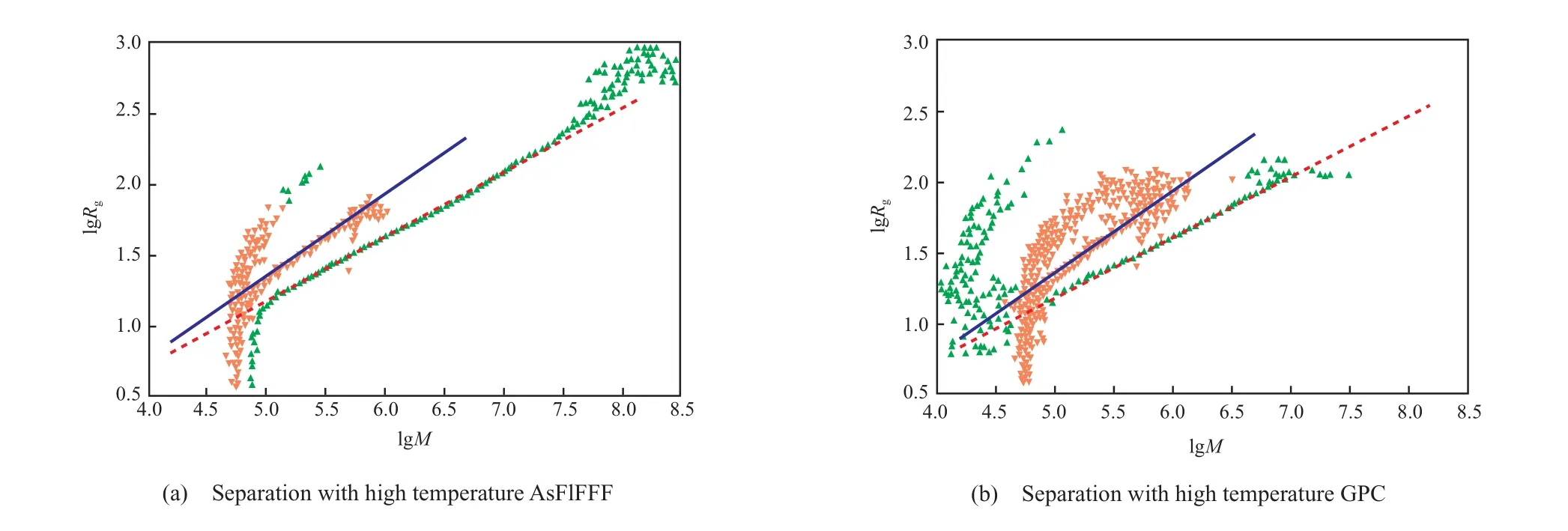
图 13 HDPE 和 LDPE 的构造图对比[30]Fig.13 Comparison between the conformation plots of HDPE and LDPE[30].
3 结语
FlFFF 技术与各种检测器联用时,可提供一种先进的分离和表征聚合物摩尔质量分布、微粒尺寸分布的方法,这种方法具有分离上限高、检测范围宽、分离条件温和、无需使用固定相、对试样无剪切和无需过滤即可直接进样等优点,克服了传统分离技术中的很多缺陷,能表征超高相对分子质量的聚合物试样以及聚合物乳胶体系。
但就仪器型号、生产商及已发表的相关文献数量而言,FlFFF 技术目前并不成熟。随该技术的进一步发展和完善,它将成为现有分离方法的有力补充,能提供更多有价值的信息,从而使人们能够更全面地分析目前存在争论的试样体系。例如,一旦建立了超高相对分子质量驱油 HPAM 溶液摩尔质量分布的常温 FlFFF 技术测试方法,将对驱油聚合物的性能评价具有极其重要的作用。高温 FlFFF技术克服了高温 GPC 技术中存在的剪切降解和体积排斥极限等缺陷,若能研制出性能更好的半透膜以解决相对分子质量小的试样部分的流失问题以及膜的高温恢复问题,则高温 FlFFF 技术将会成为继 GPC 技术之后,分析高相对分子质量聚烯烃材料多分散性的通用工具。
[1]Barth H G,Boyes B E,Jackson C. Size Exclusion Chromatography and Related Separation Techniques[J].Anal Chem,1998,70(12):251 - 278.
[2]Giddings J C. A New Separation Concept Based on a Coupling of Concentration and Flow Nonuniformities [J].J Sep Sci,1966,1(1):123 - 125.
[3]Myers M N. Overview of Field-Flow Fractionation[J].J Microcolumn Sep,1997,9(3):151 - 162.
[4]Giddings J C. Field-Flow Fractionation:Analysis of Macromolecular,Colloidal,and Particulate Materials [J].Science,1993,260(5113):1456 - 1466.
[5]Schimpf M E,Caldwell K D,Giddings J C. Field-Flow Fractionation Handbook [M]. New York:Wiley,2000:71 - 78.
[6]Chmelik J. Different Elution Modes and Field Programming in Gravitational Field-Flow Fractionation:A Theoretical Approach[J].J Chromatogr A,1999,845(1/2):285 - 291.
[7]Beckett R,Sharma R,Andric G,et al. Illustrating Some Principles of Separation Science Through Gravitational Field-Flow Fractionation [J].J Chem Educ,2007,84(12):1955 - 1962.
[8]Carpino F,Moore L R,Zborowski M,et al. Analysis of Magnetic Nanoparticles Using Quadrupole Magnetic Field-Flow Fractionation[J].J Magn Magn Mater,2005,293(1):546 - 552.
[9]Semyonov S N,Maslow K I. Acoustic Field-Flow Fractionation[J].J Chromatogr A,1988,446(27):151 - 156.
[10]Messauda F A,Sandersona R D,Runyonb J R,et al. An Overview on Field-Flow Fractionation Techniques and Their Applications in the Separation and Characterization of Polymers [J].Prog Polym Sci,2009,34(4):351 - 368.
[11]Yohannes G,Holappa S,Wiedmer S K,et al. Polyelectrolyte Complexes of Poly-(Methacryloxyethyl Trimethylammonium Chloride) and Poly(Ethylene Oxide)-Block-Poly(Sodium Methacrylate)Studied by Asymmetrical Flow Field Flow Fractionation and Dynamic Light Scattering [J].Anal Chim Acta,2005,542(2):222 - 229.
[12]Duval C,Le Cerf D,Picton L,et al. Aggregation of Amphiphilic Pullulan Derivatives Evidenced by On-Line Flow Field-Flow Fractionation/Multi-Angle Laser Light Scattering[J].J Chromatogr B,2001,753(1):115 - 122.
[13]Glinel K,Huguet J,Muller G. Comparison of the Associating Behaviour Between Neutral and Anionic Alkylperfluorinated Pullulan Derivatives [J].Polymer,1999,40(25):7071 -7081.
[14]Yohannes G,Shan J,Jussila M,et al. Characterization of Poly(N-Isopropylacrylamide) by Asymmetrical Flow Field-Flow Fractionation,Dynamic Light Scattering,and Size Exclusion Chromatography[J].J Sep Sci,2005,28(5):435 - 442.
[15]Anderson M,Wittgren B,Wahlund K G. Ultrahigh Molar Mass Component Detected in Ethylhydroxyethyl Cellulose by Asymmetrical Field-Flow Fractionation Coupled to Multiangle Light Scattering [J].Anal Chem,2001,73(20):4852 - 4861.
[16]Thielking H,Clicked W M. On-Line Coupling of Flow Field-Flow Fractionation and Multiangle Laser Light Scattering for the Characterization of Macromolecules in Aqueous Solution as Illustrated by Sulfonated Polystyrene Samples [J].Anal Chem,1996,68(7):1169 - 1173.
[17]Leeman M,Wahlund K G,Wittgren B. Programmed Cross Flow Asymmetrical Flow Field-Flow Fractionation for the Size Separation of Pullulans and Hydroxypropyl Cellulose [J].JChromatogr A,2006,1134(1/2):236 - 245.
[18]Lee H,Kim H,Moon M H. Field Programming in Frit-Inlet Asymmetrical Flow Field-Flow Fractionation/Multiangle Light Scattering:Application to Sodium Hyaluronate [J].J Chromatogr A,2005,1089(1/2):203 - 210.
[19]van Bruijnsvoort M,Wahlund K G,Nilsson G,et al. Retention Behavior of Amylopectins in Asymmetric Flow Field-Flow Fractionation Studied by Multiangle Light Scattering Detection[J].J Chromatogr A,2001,925(1/2):171 - 182.
[20]Lee S,Nilsson P O,Nilson G S,et al. Development of Asymmetrical Flow Field-Flow Fractionation-Multi Angle Laser Light Scattering Analysis for Molecular Mass Characterization of Cationic Potato Amylopectin [J].J Chromatogr A,2003,1011(1/2):111 - 123.
[21]Rolland-Sabate A,Colonna P,Mendez-Montealvo M G,et al.Branching Features of Amylopectins and Glycon Determined by Asymmetrical Flow Field-Flow Fractionation Coupled with Multiangle Laser Light Scattering [J].Biomacromolecules,2007,8(8):2520 - 2532.
[22]Hecker R,Fawell P D,Jefferson A,et al. Flow Field-Flow Fractionation of Polyacrylamides:Commercial Flocculants[J].Sep Sci Technol,2000,35(4):593 - 612.
[23]Hecker R,Fawell P D,Jefferson A,et al. Flow Field-Flow Fractionation of High-Molecular-Mass Polyacrylamide [J].J Chromatogr A,1999,837(1/2):139 - 151.
[24]Leeman M,Islam M T,Haseltine W G. Asymmetrical Flow Field-Flow Fractionation Coupled with Multi-Angle Light Scattering and Refractive Index Detections for Characterization of Ultra-High Molar Mass Poly(Acrylamide) Flocculants[J].J Chromatogr A,2007,1172(2):194 - 203.
[25]Moon M H,Kwon H,Park I. Stoppless Flow Injection in Asymmetrical Flow Field-Flow Fractionation Using a Frit Inlet[J].Anal Chem,1997,69(7):1436 - 1440.
[26]Othegraven J,Piazza R,Bartsch E. Synthesis and Characteri zation of Core-Shell Colloids with Fluoro-Carbon Cores [J].Macromol Symp,2000,151(1):515 - 520.
[27]Zillies J C,Zwiorek K,Winter G,et al. Method for Quantifying the Pegylation of Gelatin Nanoparticle Drug Carrier Systems Using Asymmetrical Flow Field-Flow Fractionation and Refractive Index Detection [J].Anal Chem,2007,79(12):4574 - 4580.
[28]Giddings J C,Yu X,Myers M N. Enhancement of Performance in Sedimentation Field-Flow Fractionation by Temperature Elevation [J].Anal Chem,1994,66(19):3047 - 3053.
[29]Stegeman G,van Asten A C,Kraak J C,et al. Comparison of Resolving Power and Separation Time in Thermal Field-Flow Fractionation,Hydrodynamic Chromatography,and Size-Exclusion Chromatography [J].Anal Chem,1994,66(7):1147 - 1160.
[30]Mes E P C,de Jonge H,Klein T,et al. Characterization of High Molecular Weight Polyethylenes Using High Temperature Asymmetric Flow Field-Flow Fractionation with On-Line Infrared,Light Scattering and Viscometry Detection [J].J Chromatogr A,2007,1154(1/2):319 - 330.
[31]Bang D Y,Shin D Y,Lee S,et al. Characterization of Functionalized Styrene-Butadiene Rubber by Flow Field-Flow Fractionation/Light Scattering in Organic Solvent [J].J Chromatogr A,2007,1147(2):200 - 205.
[32]Park I,Paeng K J,Kang D,et al. Performance of Hollow-Fiber Flow Field-Flow Fractionation in Protein Separation [J].J Sep Sci,2005,28(16):2043 - 2049.
[33]Shin Se-Jong,Nam Hyun-Hee,Min Byoung-Ryul,et al. Separation of Proteins Mixtures in Hollow Fiber Flow Field-Flow Fractionation [J].Bull Korean Chem Soc,2003,24(9):1339 - 1344.
[34]Kang D,Sunok O,Reschiglian P,et al. Separation of Mitochondria by Flow Field-Flow Fractionation for Proteomic Analysis [J].Analyst,2008,133(4):505 - 515.
[35]Park I,Paeng K J,Yoong Y,et al. Separation and Selective Detection of Lipoprotein Particles of Patients with Coronary Artery Disease by Frit-Inlet Asymmetrical Flow Field-Flow Fractionation [J].J Chromatogr B,2002,780(2):415 -422.
[36]Lee S,Eun C H,Plepys A R. Capability of Thermal Field-Flow Fractionation for Analysis of Processed Natural Rubber[J].Bull Korean Chem Soc,2000,21(1):69 - 74.
[37]Frankema W,van Bruijnsvoort M,Tijssen R,et al. Characterization of Core-Shell Latexes by Flow Field-Flow Fractionation with Multi-Angle Light Scattering Detection [J].J Chromatogr A,2002,943(2):251 - 261.
[38]Vastamaki P,Jussila M,Riekkola M L. Continuous Two-Dimensional Field Flow Fractionation:A Novel Technique for Continuous Separation and Collection of Macromolecules and Particles [J].Analyst,2005,130(4):427 - 432.
[39]Shiundu P M,Giddings J C. Influence of Bulk and Surface Composition on the Retention of Colloidal Particles in Thermal Field Flow Fractionation [J].J Chromatogr A,1995,715(1):117 - 126.
[40]Shiundu P M,Munguti S M,Williams S K R. Practical Implications of Ionic Strength Effects on Particle Retention in Thermal Field-Flow Fractionation [J].J Chromatogr A,2003,984(1):67 - 79.
[41]Giddings J C. Factors Influencing Accuracy of Colloids and Macromolecules Properties Measured by Field-Flow Fractionation [J].Anal Chem,1997,69(4):552 - 557.
[42]Williams S K R,Lee D. Field-Flow Fractionation of Proteins,Polysaccharides,Synthetic Polymers,and Supramolecular Assemblies[J].J Sep Sci,2006,29(12):1720 - 1732.
[43]Williams S K R,Benincasa M A. Field-Flow Fractionation Analysis of Polymers and Rubbers [M]//Meyers R A,eds.Encyclopedia of Analytical Chemistry:Instrumentation and Applications. Chichester:Wiley,2000:7582 - 7608.
[44]Giddings J C. A New Separation Concept Based on a Coupling of Concentration and Flow Nonuniformities [J].J Sep Sci,1966,1(1):123 - 125.
[45]Giddings J C,Yang F J,Myers M N. Theoretical and Experimental Characterization of Flow Field-Flow Fractionation [J].Anal Chem,1976,48(8):1126 - 1132.
[46]Wahlund K G,Giddings J C. Properties of an Asymmetrical Flow Field-Flow Fractionation Channel Having One Permeable Wall [J].Anal Chem,1987,59(9):1332 - 1339.
[47]Litzen A,Wahlund K G. Improved Separation Speed and Ef fi ciency for Proteins,Nucleic Acids and Viruses in Asymmetrical Flow Field Flow Fractionation [J].J Chromatogr A,1989,476:413 - 421.
[48]Wahlund K G,Litzen A. Application of an Asymmetrical Flow Field-Flow Fractionation Channel to the Separation and Characterization of Proteins,Plasmids,Plasmid Fragments,Polysaccharides and Unicellular Algae [J].J Chromatogr A,1989,461:73 - 87.
[49]Li P,Hanson M,Giddings J C. Advances in Frit-Inlet and Frit-Outlet Flow Field-Flow Fractionation [J].J Microcolumn Sep,1998,10(1):7 - 18.
[50]Janca J. Field-Flow Fractionation in Biopolymer Analysis [J].Trends Anal Chem,1983,2(12):278 - 281.
[51]Benincasa M A,Giddings J C. Separation and Characterization of Cationic,Anionic,and Nonionicwater-Soluble Polymers by Flow FFF:Sample Recovery,Overloading,and Ionic Strength Effects[J].J Microcolumn Sep,1997,9(6):479 - 495.
[52]Basile F,Kassalainen G E,Williams S K R. Interface for Direct and Continuous Sample-Matrix Deposition onto a MALDI Probe for Polymer Analysis by Thermal Field-Flow Fractionation and Off-Line MALDI-MS [J].Anal Chem,2005,77(8):3008 - 3012.
[53]Lee H,Williams S K R,Wahl K L,et al. Analysis of Whole Bacterial Cells by Flow Field-Flow Fractionation and Matrix-Assisted Laser Desorption/Ionization Time-of-Flight Mass Spectrometry [J].Anal Chem,2003,75(11):2746 - 2752.
Application of Flow Field-Flow Fractionation Techniques to the Characterization of Relative Molecular Mass Distribution and Particle Size Distribution of Polymers
Luo Chunxia,Hou Jiaxiang,Zhang Longgui,Guo Meifang,Qiao Jinliang
(SINOPEC Beijing Research Institute of Chemical Industry,Beijing 100013,China)
As a new kind of analytical technique,field-flow fractionation has been developed speci fi cally for separating and characterizing polymers,biomacromolecules and polymer particles. The principle of fl ow fi eld- fl ow fractionation(FlFFF) as a kind of fi eld fl ow fractionation are introduced.Application of FlFFF to the separation and characterization of water-soluble polymers such as polyelectrolyte and polymer latex in aqueous system at room temperature and application of FlFFF to the separation and characterization of polyole fi ns with high relative molecular mass at high temperature are reviewed. Both the advantages of FlFFF compared to GPC and the problems in FlFFF are discussed. The future application of FlFFF to polymers with high relative molecular mass is discussed.
field-flow fractionation;flow field-flow fractionation;relative molecular mass distribution;polymer;particle
1000-8144(2012)01-0009-010
TQ 050.4
A
2011 - 06 - 29;[修改稿日期]2011 - 09 - 20。
罗春霞(1979—),女,湖北省武汉市人,博士,电话 010-59202924。联系人:乔金樑,电话 010 - 64208677,电邮qiaojl.bjhy@sinopec.com。
(编辑 王小兰)
