生物絮凝剂对好氧污泥颗粒化性能及其种群结构的影响
2012-11-08宋志伟宁婷婷
宋志伟, 宁婷婷
(黑龙江科技学院 资源与环境工程学院, 哈尔滨 150027)
生物絮凝剂对好氧污泥颗粒化性能及其种群结构的影响
宋志伟,宁婷婷
(黑龙江科技学院 资源与环境工程学院, 哈尔滨 150027)
为了加速好氧污泥的颗粒化进程,在好氧颗粒污泥培养的过程中投加生物絮凝剂,研究其对颗粒污泥理化性能的影响。利用分子生物学手段分析颗粒污泥的种群结构,探讨生物絮凝剂促进污泥颗粒化的作用机理。结果表明,生物絮凝剂的投加使污泥颗粒化的时间由56 d缩短为28 d,形成的颗粒具有良好的疏水性能和沉降性能。DGGE分析显示颗粒污泥的群落多样性十分丰富,总共测序的28个OTUs中,存在较多的是Actinobacteria和Proteobacteria的α和γ亚群,大约占OTUs总数的64.3%。而且投加的能分泌胞外多糖黏液的菌种Devosiahwasunensisstrain HST2-16T、Tetrasphaeraelongate在颗粒形成和维持其稳定性方面起到了重要的作用。
好氧颗粒污泥; 生物絮凝剂; SBAR; 种群结构
0 引 言
在活性污泥处理系统中,人们观察到了活性污泥的自凝聚现象,进而发现了絮凝细菌的存在,这对于微生物的固定化具有重要意义[1]。无论是好氧还是厌氧悬浮生长式生物反应器,絮凝细菌的存在都是必不可少的,但仅仅依靠系统内自身的絮凝细菌形成生物絮体,其启动周期很长。如在UASB反应器中,厌氧颗粒的形成约需2~8个月的时间[2],好氧颗粒污泥的培养需1.5~3个月的时间[3-10],极大地限制了颗粒污泥的应用。为此,有学者开始探讨采用一些方法促进生物絮体的快速形成。
近年来,促进悬浮生长式生物反应器生物固定增强技术的研究已获得许多成功的经验和数据[11-20],证实投加无机絮凝剂、合成的高分子絮凝剂、阳离子或絮凝细菌是一种促进微生物固定的行之有效的方法。絮凝菌是菌胶团的组成部分,甚至可以说是主要成分。这些细菌分泌的胶状物直接将各类细菌胶合在一起形成菌胶团,与其他的颗粒污泥增强技术相比,絮凝细菌具有安全无毒、无二次污染、易生物降解、絮凝效率高等优点,因而受到学者们的关注。与此同时,有关絮凝细菌对好氧污泥颗粒化影响的研究报道却鲜见[21]。
笔者探讨在SBAR反应器中连续投加生物絮凝剂对好氧污泥颗粒化进程的影响,试图通过对比实验,考察在污泥颗粒化过程中生物絮凝剂对颗粒污泥的理化特性的影响,利用分子生物学手段分析其种群结构,探讨生物絮凝剂促进污泥颗粒化的作用机理,以期为加速好氧污泥颗粒化奠定理论基础。
1 实验材料与方法
1.1实验装置及运行
实验采用自制气升式内循环序批反应器,如图1所示。反应器为有机玻璃圆柱体(V=5.0 L),由内外两层套管组成,内外套管的高径比大于15,混合液在内外套管之间形成升流式内循环,出水口距底部50 cm,曝气头设在反应器底部,由气体转子流量计控制曝气量,反应器运行由PLC实现自动控制;反应器采用水浴控温,温度由温控器控制。
实验运行条件为:进水10 min,曝气320~330 min,沉淀5~15 min,排水最初为15 min,两周后逐渐减少为5 min;有机负荷为3.0 kg/(m3·d),表面气流速度4.0 cm/s,运行温度30 ℃;运行时间60 d。
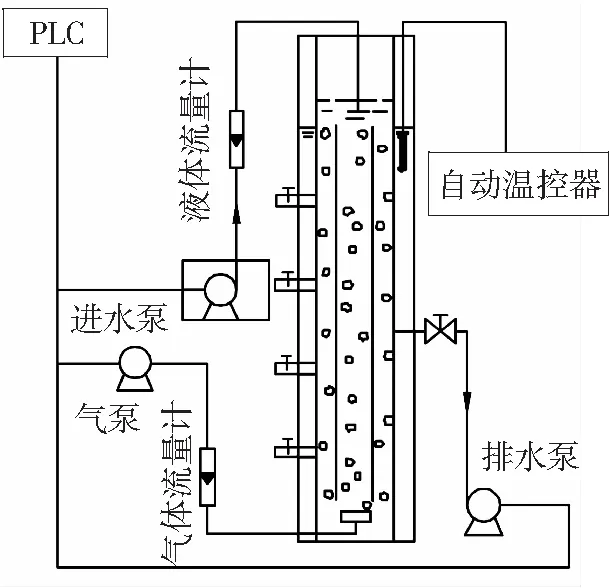
图1 SBAR反应器结构Fig. 1 Reactcr structure of SBAR
1.2实验材料
水样采用模拟城市生活污水,组成见表1。
自制生物絮凝剂主要以变形菌为主,相对分子量4.79×105,多糖质量分数85.82%。
接种污泥取自哈尔滨市文昌污水处理厂二沉池的活性污泥,其中接种污泥的MLSS为4 500 mg/L,SVI为106.12 mL/g,Zeta电位为-18.376 mV,污泥呈絮状灰褐色。
表1模拟城市生活污水组成
Table 1Constitutes of synthetic domestic wastewater
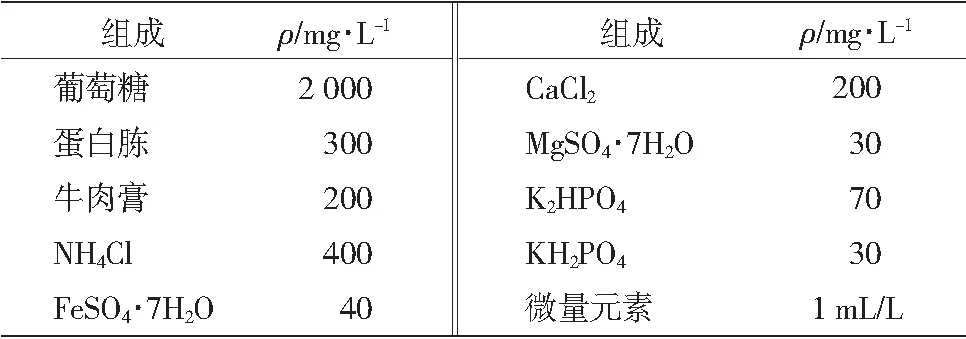
注:微量元素组成,mg/L:H3BO4150,ZnSO4·7H2O 120,MnCl2·7H2O 120,CuSO4·5H2O 30,NaMoO465, NiCl250,CoCl2·6H2O 210,KI 30。
1.3好氧颗粒污泥的培养
实验采用2个相同规格并联运行的SBAR,进水采用模拟水样,污泥接种量约为3 L,在运行中向一个反应器(R1)中定期投加生物絮凝剂,运行开始加入接种污泥的同时加入10 mL/L的生物絮凝剂,第2 d、第3 d每天投加3 mL/L,从第4 d开始每隔2 d投加一次3 mL/L复合生物絮凝剂,持续到63 d;不加生物絮凝剂的反应器(R2)做空白对比实验。
1.4分析项目及方法
(1)COD、NH3-N、TP、MLSS、SV和SVI采用标准方法测定[22]。
(2)颗粒污泥的形态利用Leica DM1000电子显微镜;颗粒污泥的粒径分布利用湿法筛分法[23]。
(3)颗粒污泥的微观结构采用英国Camscan公司的MX2600FE扫描电子显微镜观察。具体方法如下:将好氧颗粒污泥放入2.5%戊二醛中固定30 min;然后用磷酸缓冲溶液清洗固定好的好氧颗粒污泥,清洗3次,每次10 min,再依次放入50%、70%、80%、90%、95%和100%乙醇溶液中进行脱水10 min;之后用叔丁醇干燥法进行清洗,也是3次,每次10 min;最后将好氧颗粒污泥冷冻后抽真空使叔丁醇升华。用导电胶将好氧颗粒污泥样品固定在样品台上,用离子溅射仪溅射,镀上一层金属膜,即可进行扫描电镜观察[24]。
(4)颗粒污泥的菌群特征采用变性梯度凝胶电泳法(denaturing gradient gel electrophoresis,DGGE)分析[25]。
2 实验结果与分析
2.1颗粒的形态和性能
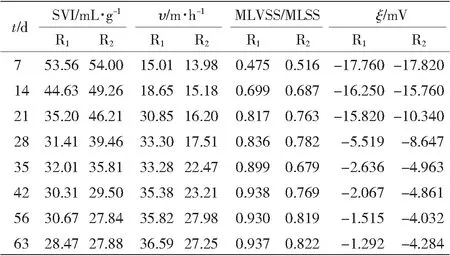
在好氧颗粒污泥的培养过程中,定期取样测SVI、υ,MLSS、MLVSS和Zeta电位ξ,结果见表2。
表2好氧颗粒污泥性能
Table 2Properties of granules
利用电子显微镜对污泥培养过程颗粒的形态进行观察,结果见图2。由图2a、b可见,运行7 d时,R1中已明显可见一些较规则的颗粒状物质出现,R2变化较小,仍以大量的絮状污泥为主,两反应器中的污泥沉降性能均有一定的改善,反应器污泥颜色变为深黄色。到第21 d时,两反应器中均出现了较多形状相对规则的颗粒,R1中的颗粒呈深黄色半透明状,颗粒相对较大,SVI达到了35.20 mL/g,沉降速度为30.85 m/h;由图2c可见,此时的颗粒表面包裹有一定厚度的凝胶状物质,这表明生物絮凝剂促进了胞外聚合物的分泌;到第28 d时,R1中出现了大量浅黄色的表面光滑、结构致密、平均粒径为0.8 mm、沉降性能良好的颗粒,这标志着颗粒污泥的成熟;到第56 d时,R2中颗粒的沉降性能才趋于稳定,SVI在27~30 mL/g,沉降速度达到了27.98 m/h,颗粒平均粒径为0.69 mm。

图2 不同阶段好氧颗粒污泥的形态变化Fig. 2 Morphology of granules at different phases
由表2可以看出,在颗粒污泥的培养过程中, R1中颗粒的MLVSS/MLSS在第21 d就超过了80%,并最终达到93.7%,其有机物的含量要明显高于R2中的颗粒污泥;R1中颗粒的Zeta电位在第28 d迅速下降到-5.519 mV,随后呈缓慢下降的趋势,R2中的颗粒Zeta电位始终呈缓慢下降的趋势,第56 d稳定在-4.0 mV左右,这说明生物絮凝剂的投加促进了胞外多糖聚合物的生成,改善了颗粒的疏水性能。
颗粒的性能变化说明投加生物絮凝剂在颗粒污泥的形成过程中促进了颗粒的自凝聚,使颗粒污泥的培养时间由56 d缩短为28 d。
2.2颗粒污泥的微观结构
在运行的末期从两个反映器中分别取成熟的好氧颗粒,经预处理后,在扫描电镜下观察其微观结构,结果如图3所示。
图3b显示,在未投加生物絮凝剂的R2中,颗粒污泥有明显的丝状骨架,呈丝状交织缠绕形成的三维网状结构,短杆状和部分球状菌团被吸附和包裹在其上生长,内部有大小不一的孔隙;图3a可见,投加生物絮凝剂的R1中的颗粒污泥结构明显不同,菌体由黏稠状的物质紧密的连接在一起,呈葡萄状,形成的框架比较粗大,看不到丝状结构,内部存在有不规则的相对较大的孔洞,这说明生物絮凝剂在颗粒的形成过程促进了胞外聚合物的产生,加速了颗粒化的进程。

图3 好氧颗粒污泥的扫描电镜照片Fig. 3 SEM photographs of aerobic granules
2.3颗粒污泥种群结构的变化
分别取生物絮凝剂样品和R1运行过程第0、7、14、21、28、35、42、49、56 d的污泥样品进行DGGE分析,图谱如图4所示。图中x为生物絮凝剂。

图4 投加生物絮凝剂的好氧颗粒污泥的DGGE图谱
Fig. 4DGGE profile of aerobic granule sludge samples added by bio-flocculant
图谱显示微生物群落多样性十分丰富,优势种属为28个OTUs。群落结构的变化可分为三个阶段:第一阶段是在0~7 d时,群落演替十分激烈,7 d时的微生物群落结构与接种污泥差异很大;第二阶段为7~21 d,群落的变化主要体现在其中某些微生物的数量变化上;第三阶段从28 d起,微生物群落结构已经趋于稳定,群落变化较小。
图4中还可以看出,生物絮凝剂的加入对好氧颗粒污泥的微生物群落产生了较大的影响,生物絮凝剂中的某种微生物(Band 10)在第7 d起就在反应器微生物群落中占较大数量,并在稳定时成为数量最多的微生物。另外一种(Band 18)在第14 d和21 d数量很大,而后逐渐减少。而Band 9和Band 20的影响较小,一直没有达到较多的数量。
反应器中的微生物数量变化,主要体现在以下几个方面:有的微生物种群逐渐减少,如Band 1、2、7、12、19、27等;一些微生物种群产生或逐渐增加,如Band 4、5、6、11、15、22、23、28等;还有的微生物种群在启动过程中一直存在且在不同时期的数量变化不大。如Band 8、10、13,这些微生物受环境变化影响较小,成为稳定时期微生物群落的组成部分。
胶图上条带的测序结果经Vecscreen去除载体后,至Genbank 的Blastn 数据库进行序列比对,比对结果见表3。大多数条带的比对结果与数据库中序列的相似度超过94%,可以确定这些条带代表的微生物与数据库中最相近的微生物属于同一个属。
从比对结果上看,总共测序的28个OTUs中,8个属于Actinobacteria(放线菌),7个属于α-Proteobacterium(变形菌纲α亚纲),4个属于γ-Proteobacterium(变形菌纲γ亚纲),3个属于Clostridiales(梭菌),Acidobacteria(酸杆菌)和Lactobacillales(乳杆菌)各有2个OTUs,还有2个OTUs无法确定其分类地位。群落中存在较多的Actinobacteria(放线菌)和Proteobacteria(变形菌)的α和γ亚群,大约占总OTUs总数的64.3%。这些微生物在群落结构中占据优势地位,有利于保持稳定的微生物群落结构,同时促进好氧颗粒污泥的形成。
测序结果表明,投加的生物絮凝剂主要有四种:Pseudomonas(假单胞菌)sp. AZ22R2(Band 9,γ-Proteobacterium(变形菌纲γ亚纲)),Devosiahwasunensisstrain HST2-16T(Band 10,α-Proteobacterium(变形菌纲α亚纲)),Tetrasphaeraelongate(Band 18, Actinobacteria(放线菌))和Pseudomonas(假单胞菌)sp. TM2_7(Band 20,γ-Proteobacterium(变形菌纲γ亚纲)),其多糖质量分数均超过80%。其中的Devosiahwasunensisstrain HST2-16T(Band 10,α-Proteobacterium(变形菌纲α亚纲))在好氧颗粒污泥微生物群落中一直数量最多,这种产絮微生物在反应器运行过程中会分泌凝胶状黏液物质促进好氧颗粒污泥的形成。
当微生物群落结构达到稳定时,群落中的微生物种类较多,其中大多数以较少数量存在。除了数量最大的Devosiahwasunensisstrain HST2-16T(Band 10,α-Proteobacterium(变形菌纲α亚纲))以外,UnculturedRhodobacter(红细菌)sp. clone SH2B-1C(Band 11,α-Proteobacterium(变形菌纲α亚纲)),Uncultured High G+C Gram-positive bacterium lpha7(Band 22, Actinobacteria(放线菌))和Uncultured Cellulomonadaceae(纤维单胞菌)bacterium clone HT06Ba18(Band 24, Actinobacteria(放线菌))数量相对较多。

表3 DGGE条带的测序比对结果Table 3 Partial 16S rDNA sequence similarity of DGGE bands
3 结 论
(1)在颗粒污泥的培养过程中投加生物絮凝剂是加速好氧污泥颗粒化进程的有效手段,它使颗粒的成熟时间由56 d缩短为28 d,而且形成的颗粒具有良好的沉降性能、有机物含量高,疏水性能好。
(2)16S rDNA测序比对结果表明,颗粒污泥的群落多样性十分丰富,总共测序的28个OTUs中,8个属于Actinobacteria(放线菌),7个属于α-Proteobacterium(变形菌纲α亚纲),4个属于γ-Proteobacterium(变形菌纲γ亚纲),3个属Clostridiales(梭菌),Acidobacteria(酸杆菌)和Lactobacillales(乳杆菌)各有2个OTUs,还有2个OTUs无法确定其分类地位。群落中存在较多的Actinobacteria(放线菌)和Proteobacteria(变形菌)的α和γ亚群,约占总OTUs总数的64.3%。
(3)通过生物相观察和分子生物学手段分析推断放线菌形成了颗粒污泥的网状结构,杆状的变形菌和其他少量球状细菌附着其上,其中Devosiahwasunensisstrain HST2-16T(Band 10,变形菌α亚纲)、Tetrasphaeraelongate(Band 18, Actinobacteria(放线菌))都具有较强的分泌胞外多糖黏液的功能,它们在颗粒的形成和维持颗粒稳定方面起到重要作用。
[1]SCHMIDT J E E, AHRING B K. Extracellular polymers in granular sludge from different upflow anaerobic sludge blanket(UASB) reactors[J]. Appl Microbiol Biotech, 1994, 42(2/3): 457-462.
[2]LIU YU, XU HAILOU, SHOU K Y, et al. Anaerobic granulation technology for wastewater treatment[J]. World J Microbiol Biotechnol, 2002, 18(2): 99-113.
[3]ZHENG YUMING, YU HANQING, LIU SHUANGJIANG, et al. Formation and instability of aerobic granules under high organic loading conditions[J]. Chemosphere, 2006, 63(10): 1791-1800.
[4]ZHU JIANRONG, WILDER P A. Effect of extended idle conditions on structure and activity of granular activated sludge[J]. Water Research, 2003, 37(9): 2013-2018.
[5]JANG A,YOON Y H, KIIM I S, et al. Characterization and evaluation of aerobic granules in sequencing batch reactor[J]. J Biotechnol, 2003, 105(1/2): 71-82.
[6]XIAO F, YANG S F, LI X Y. Physical and hydrodynamic properties of aerobic granules produced in sequencing batch reactors[J]. Sep Purif Technol, 2008, 63(3): 634-641.
[7]DE KREUK M K, HEIJNEN J J, VAN LOOSDRECHT M C M. Simultaneous COD, nitrogen and phosphate removal by aerobic granules sludge[J]. Biotechnology and Bioengineering, 2005, 90(6): 761-769.
[8]QIN L, TAY J J, LIU Y. Selection pressure is a driving force of aerobic granulation in sequencing batch reactors[J]. Process Biochem, 2004, 39(5): 579-584.
[9]BEUN J J, VAN LOOSDRECHT M C M, HEIJNEN J J. Aerobic granulation in a sequencing batch airlift reactor[J]. Water Res, 2002, 36(3): 702-712.
[10]WANG Q, CHEN J, DU G. Studies on aerobic granular sludge cultivated under selective pressure[J]. Environ Sci, 2003, 24(4): 99-104.
[11]IMAI T, UKITA M, LIU J, et al. Advanced start up of UASB reactors by adding of water absorbing polymer[J]. Water Sci Technol, 1997, 36(6/7): 399-406.
[12]CHEN JIAN, LUN SHIYI. Study on mechanism of anaerobic sludge granulation in UASB reactors[J]. Water Sci Technol, 1993, 28(7): 171-178.
[13]MANMOUNI R E, LEDUE R, GUIOT S R. Influence of synthetic and natural polymers on the anaerobic granulation process[J]. Water Sci Tech, 1998, 36(8/9): 341-347.
[14]LI XIAOMING, LIU QIANQIAN, YANG QI, et al. Enhanced aerobic sludge granulation in sequencing batch reactor by Mg2+augmentation[J]. Bioresource Technol, 2009, 100(1): 64-67.
[15]NANCHARAIAH Y V, JOSHI H M, HAUSNER M, et al. Bioaugmentation of aerobic microbial granules withPseudomonasputidacarrying TOL plasmid[J]. Chemosphere, 2008, 71(1): 30-35.
[16]BATHE S, SCHWARZENBECK N, HAUSNER M. Plasmid-mediated bioaugmentation of activated sludge bacteria in a sequencing batch moving bed reactor using pNB2[J]. Lett Appl Microbiol, 2005, 41(3): 242-247.
[17]BOON N, GORIS J, DE VOS P, et al. Bioaugmentation of activated sludge by an indigenous 3-chloroaniline degradingComamonastestosteronestrain, 12gfp[J]. Appl Environ Microbiol, 2000, 66(7): 2906-2913.
[18]BOON N, TOP E M, VERSTRAETE W, et al. Bioaugmentation as a tool to protect the structure and function of an activated sludge microbial community against a 3-chloroaniline shock load[J]. Appl Environ Microbiol, 2003, 69(3): 1511-1520.
[19]IVANOV V, WANG X M, TAY S T, et al. Bioaugmentation and enhanced formation of microbial granules used in aerobic wastewater treatment[J]. Appl Microbiol Biotechnol, 2006, 70(3): 374-381.
[20]WRITE R A, DAGUE R R. Enhancement of granulation and start-up in the anaerobic sequencing batch reactor[J]. Water Environ Res, 1996, 68(5): 883-892.
[21]宋志伟, 童龙燕, 潘月军, 等. 絮凝细菌投加量对好氧颗粒污泥性能影响的研究[J]. 环境科学, 2010, 31(5): 1263-1268.
[22]State Environmental Protection Administration of China. Standard methods for the examination of water and wastewater[M]. 4th ed Environmental Science Press, 2002.
[23]LAGUNA A, OUATTARA A, GONZALEZ R O. A simple and low cost technique for determining the granulometry of upflow anaerobic sludge blanket reactor sludge[J]. Wat Sci Technol, 1999, 40(8): 1-8.
[24]宋志伟, 梁洋, 任南琪. 有机负荷对SBAR中好氧颗粒污泥特性影响的研究[J]. 环境科学与技术, 2008, 31(10): 128-131.
[25]SONG ZHIWEI, REN NANQI, ZHANG KUN, et al. Influence of temperature on the characteristics of aerobic granulation in sequencing batch airlift reactors[J]. J Environ Sci, 2009, 21(3): 273-278.
(编辑徐岩)
Influence of bioflocculant on properties and microbial community structure of aerobic granular sludge
SONGZhiwei,NINGTingting
(College of Resources & Environmental Engineering, Heilongjiang Institute of Science & Technology, Harbin 150027, China)
Aimed at promoting the effect of bioflocculants-producing bacteria(BPA) on the formation of aerobic granular sludge, this paper presents an effort to dose bioflocculants in the process of aerobic granular sludge culture and describes a study on its impact on physical and chemical properties of granular sludge, an analysis of the population structure of granular sludge using molecular techniques, and an investigation into the mechanism in which bioflocculants promote sludge granulation. The results show that the addition of bioflocculants contributes to shortening granulation time from 56 d to 28 d and producing particles with better hydrophobic properties and sedimentation properties. Analyses based on denaturing gradient gel electrophoresis(DGGE) show that the microbial community of granular sludge boasts a great diversity marked a total of 28 sequenced OTUs which are dominated by a greater number of theαandγsubgroups of Actinobacteria and the Proteobacteria, representing approximately 64.3% of the total number of OTUs. The added bacterial species,Devosiahwasunensisstrain HST2-16T, andTetrasphaeraelongate, capable of secreting extracellular polysaccharide mucus, have played an important role in particle formation and its stability maintenance.
aerobic granular sludge; bioflocculant-producing bacteria; microbial community structure; bioaugmentation
1671-0118(2012)03-0241-06
2012-04-30
黑龙江省普通高等学校青年学术骨干支持计划项目(1155G4P)
宋志伟(1968-),女,黑龙江省讷河人,教授,博士,研究方向:污水治理技术及工艺,E-mail:szwcyp@tom.com。
X703.1
A
