无血清培养联合化疗药物对人结肠癌干细胞作用的初步研究
2012-11-06张全安
苏 沐,张全安
(江苏省南京市第二医院肿瘤二科,江苏南京,210003)
肿瘤细胞中存在一群生长、转移和复发特点与干细胞基本特性十分相似的细胞,这些细胞被称为肿瘤干细胞或肿瘤起源细胞,具有自我更新和无限增殖的能力,对肿瘤的存活、增殖、转移及复发有着重要作用[1-3]。在研究脑胶质瘤肿瘤干细胞的过程中,有学者[4]发现,人脑胶质瘤细胞能在无血清培养基中形成细胞球,这种细胞球由于富集肿瘤干细胞而被称之为肿瘤干细胞球,这种富集肿瘤干细胞的方法之后被广泛用于其他实体瘤肿瘤干细胞的研究中。这一类为数极少的细胞群数量极少,但却能瘤性克隆生长,被认为是治疗后复发的重要原因之一。因此,研究肿瘤干细胞有利于进一步了解肿瘤复发、转移及耐药机制,为更合理的制定治疗方案奠定基础。结肠癌是一种常见的消化道恶性肿瘤,约有40%~50%的患者因为复发需要行放疗或/和化疗,因此研究结肠癌肿瘤干细胞可一定程度上为临床针对性用药提供依据,具有现实意义。
1 材料与方法
1.1 材料
无血清培养基(SFM)为不含牛血清的DMEM/F12(1∶1)培养基,并在其中加入重组表皮生长因子(EGF)(20 μg/L,PeproTech)、碱性成纤维生长因子(bFGF)20 μg/L(PeproTech公司)、白血病抑制因子(LIF)20 μg/L(PeproTech 公司)、L-谷氨酰胺 2 mmol/L(Sigma公司)、尼克酰胺10 mmol/L(Sigma公司)、羟乙基哌嗪乙硫磺酸(HEPES)5 mmol/L、青霉素G 105 U/L和链霉素100 mg/L。其他试剂及仪器包括:四甲基偶氮唑蓝(MTT)、Hoechst33342(Sigma公司)、Trizol裂解液、Musashi-1及CD133抗体(B&D 公司)、逆转录-聚合酶链反应(RT-PCR)试剂盒(TaKaRa公司)、光学显微镜、CO2恒温箱细胞培养、生物超净工作台、酶标仪、流式细胞分析(FCM)仪,聚合酶链反应(PCR)仪。
1.2 方法
1.2.1 原代结肠癌细胞的培养:新鲜手术切除的结肠癌组织,在6孔板中用含青霉素及链霉素的DMEM/F12(1∶1)后的肿瘤组织置于含有Ⅱ型胶原酶400 U/mL的无血清培养基的培养瓶中,培养箱中消化3 h,300×g离心3次,彻底去除胶原酶,用DMEM/F12(1∶1)培养基洗涤。SFM 法培养分离获得的结肠癌细胞,当细胞生长到80%融合时,传代。培养的前4代细胞在传代时每次都保留部分细胞冻存于液氮中。
1.2.2 SFM条件下原代人结肠癌细胞的培养:原代培养获得的人结肠癌细胞,经5-氟尿嘧啶(5-Fu)25 mg/L、盐酸伊立替康(CPT-11)50 mg/L、奥沙利铂(L-OHP)50 mg/L及培美曲塞50 mg/L处理后的原代结肠癌细胞分别在无血清培养基中培养7 d,观察肿瘤干细胞球的形成过程,计数肿瘤干细胞球(>60 μ m)数目,并计算细胞球形成率(细胞球数目/接种细胞数×100%)。
1.2.3 FCM检测侧群(SP)细胞比例:将每组细胞均分置于A、B 2管中,以800 r/min的转速离心5 min;2管中均加入 5 μg/mL Hoechst33342染色液及无血清DMEM/F12(1∶1)培养液;再将50μ mol/L维拉帕米加入B管内,37℃水浴90min,后置于4℃环境中,检测SP细胞比例。SP细胞比例=A管中Hoechstlo比例-B管中Hoechstlo比例。1.2.4 FCM检测细胞表面分子CD133的表达:将细胞 800 r/min离心 5 min,分别加入 20 μL CD133单克隆抗体(4℃,30 min),使用冰磷酸盐缓冲液(PBS)洗涤1次,于FCM 上检测CD133+细胞比例。
1.2.5 RT-PCR半定量检测 Musashi-1 mRNA表达:采用Trizol法提取细胞的RNA,琼脂糖凝胶电泳初步评价RNA质量,分光光度仪测定总RNA纯度。将每组RNA调至每个反应体系中含1 μg。Musashi-1引物上游序列为5′-GGCT TCGTCACT TACATGGACCAGGCG-3′,下游引物序列为5′-GGAAACTGGTAGGTGTAG-3′;扩增产物为542 bp;内参为GAPDH,产物为216 bp。琼脂糖电泳RT-PCR产物,数字成像系统进行拍照分析。
1.2.6 Western-Blot检测Musashi-1蛋白的表达:细胞加入RIPA裂解液,提取总蛋白质,BCA法测定蛋白浓度,分装后-80℃保存。配制浓度6%、12%的分离胶和5%的浓缩胶。蛋白上样,SDSPAGE电泳后,使用PVDF膜转膜。将PVDF膜浸置于含5%脱脂奶粉的磷酸盐吐温缓冲液(PBST液)中封闭2 h,封闭后孵育小鼠抗人ABCG2,4℃,过夜,次日用PBST液充分洗涤后,室温下辣根酶标记山羊抗小鼠IgG孵育2 h,PBST洗涤后,使用ECL发光试剂盒,在Bio-Rad凝胶成像仪下,对PVDF膜进行图像采集分析。取等量的蛋白样品,通过Western-Blot测量各组细胞中β-actin的表达量,以此作为蛋白表达的内参。
2 结 果
2.1 肿瘤干细胞球的形成及形成率
原代培养获得的人结肠癌细胞在无血清培养基生长1周,大部分不贴壁,少部分形成大小不等的细胞球,形状较规则,球内折光性较好,球内细胞数增多,细胞间连接致密,难以区分细胞间的分界。经5-Fu、CPT-11、L-OHP及培美曲塞处理后的原代人结肠癌细胞在无血清的培养基中生长1周,亦有少部分形成肿瘤干细胞球,其细胞球形成率有差别。与空白对照组比较,经5-Fu、CPT-11、L-OHP及培美曲塞处理后的人结肠癌细胞在SFM中形成肿瘤干细胞球的比例增加(P<0.01);每2种药物之间比较均存在一定差异,但培美曲塞组与其他各组间最为差异明显(P<0.01)。见表1。
2.2 化疗药物联合SFM培养对SP细胞的影响
与空白对照组比较,经5-Fu、CPT-11、L-OHP及培美曲塞处理后的SP细胞均显著增加(P<0.01);每2种药物之间比较均存在一定差异,但培美曲塞组与其他各组间差异最为明显(P<0.01)。各组SP细胞比例见图1、表1。
表1 各组人结肠癌细胞在SFM中肿瘤干细胞球形成率及SP细胞比例(n=5,,%)

表1 各组人结肠癌细胞在SFM中肿瘤干细胞球形成率及SP细胞比例(n=5,,%)
与空白对照组比较,**P<0.01;与培美曲塞组比较,##P<0.01。
组别 肿瘤干细胞球形成率 SP细胞比例空白对照组 4.27±0.01 5.02±0.115-Fu组 6.15±0.23**## 6.11±0.45**##CPT-11组 7.22±0.43**## 7.87±0.66**##L-OHP组 8.16±0.21**## 8.65±0.56**##培美曲塞组 10.35±0.16** 9.87±0.32**

图1 各组SP细胞比例
2.3 化疗药物联合SFM培养对Musashi-1表达的影响
2.3.1 各组Musashi-1 mRNA的表达:通过图像处理系统上分析得出Musashi-1和GAPDH的光密度,以GAPDH的光密度为参照物,得到Musashi-1 mRNA表达的半定量结果。与空白对照组比较,经5-Fu、CPT-11、L-OHP及培美曲塞处理后的 Musashi-1 mRNA表达均增加(P<0.01);每2种药物之间比较均存在一定差异,但培美曲塞组与其他各组间差异最为明显(P<0.01)。见表2。
2.3.2 各组Musashi-1蛋白的表达:与空白对照组比较,经5-Fu、CPT-11、L-OHP及培美曲塞处理后Musashi-1蛋白的表达增加,培美曲塞组最为明显,见图 2。
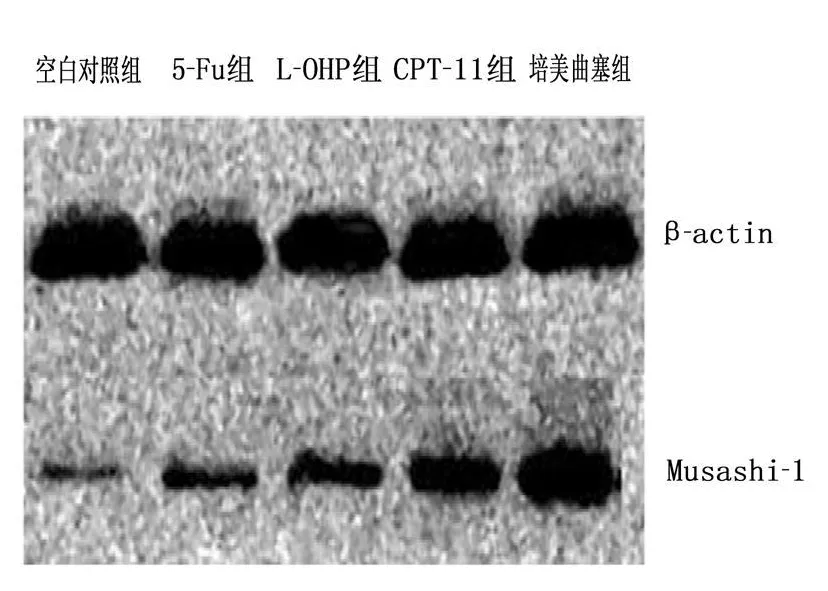
图2 各组Musashi-1蛋白的表达
2.4 化疗药物联合SFM培养对CD133+表达的影响
与空白对照组比较,经 5-Fu、CPT-11、L-OHP及培美曲塞处理后的人结肠癌细胞CD133+细胞比例增加(P<0.01);每2种药物之间比较均存在一定差异,但培美曲塞组与其他各组间差异最为明显(P<0.01)。见表2。
表2 各组人结肠癌细胞Musashi-1 mRNA的表达及CD133+细胞比例(n=5,)

表2 各组人结肠癌细胞Musashi-1 mRNA的表达及CD133+细胞比例(n=5,)
与空白对照组比较,**P<0.01;与培美曲塞组比较,##P<0.01。
组别 Musashi-1/GAPDH CD133+细胞比例(%)空白对照组 0.226±0.023 6.61±0.20365-Fu组 0.301±0.005**## 11.98±0.0198**##CPT-11组 0.425±0.040**## 12.33±0.2014**##L-OHP组 0.478±0.047**## 11.88±0.5891**##培美曲塞组 0.695±0.025** 14.86±0.1069**
3 讨 论
肿瘤干细胞被认为是恶性肿瘤发生、发展、治疗后复发和转移的根源,其数量少,分离困难,成为影响肿瘤干细胞研究的重要因素之一。最早是在血液肿瘤中发现了肿瘤干细胞,近10余年先后在乳腺癌、脑胶质瘤、大肠癌、肺癌、肾癌、前列腺癌[4-8]等实体肿瘤中发现肿瘤干细胞。通过流式细胞仪筛选细胞表面标记物[5]及SP细胞分选法[9]广泛用于肿瘤干细胞的分选,但这2种分选法在分选过程均会对细胞造成伤害。多种人肿瘤细胞,如脑肿瘤、乳腺癌、视神经母细胞瘤等,在无血清培养基中能形成具有干细胞特征的细胞球,其成为富集肿瘤干细胞的有效方法,给肿瘤干细胞培养的理论研究和实践带来了新的启示。
肿瘤干细胞理论认为[1],肿瘤干细胞大多数处于休眠状态,停滞于细胞周期中的G0期,其多数耐药蛋白高表达,因此对化疗不敏感,而成为肿瘤复发的根源。无血清培养的悬浮培养可使细胞维持在未分化的状态[10]。在无血清培养条件下,未分化的肿瘤细胞较已分化的细胞能耐受无血清条件而免于凋亡,并可以在添加生长因子的的情况下增殖形成细胞球[10-11]。
本实验小组之前的研究发现,5-Fu可富集人结肠癌细胞株SW480中的肿瘤干细胞;后在原代培养的人结肠癌细胞的无血清培养的研究中发现5-Fu有类似地富集肿瘤干细胞的作用。因此,本研究将临床上常用于结肠癌治疗的化疗药物与无血清悬浮培养法相结合,对原代人结肠癌细胞进行研究。结果表明,经5-Fu、L-OHP、CPT-11及培美曲塞处理后的人结肠癌细胞在SFM中形成干细胞球的能力增强;且与空白对照组相比,SP细胞比例、Musashi-1及CD133表达均有增加。有理由认为,与单纯SFM培养比较,联合化疗药物可有效进一步富集人结肠细胞中的肿瘤干细胞,但是除培美曲塞组与其他化疗药物的作用差异较为显著外,其余药物之间肿瘤干细胞的富集作用不十分明显,其原因有待于进一步的研究。
本研究再次用SFM培养法富集了原代培养获得的人结肠癌细胞中的肿瘤干细胞,且发现与化疗联合可强化富集作用,不同药物存在一定的差别,为进一步研究肿瘤干细胞在肿瘤复发、耐药机制中的作用奠定基础。
[1]Prud′homme G J.Cancer stem cells and novel targets for antitumor strategies[J].Curr Pharm Des,2012,18(19):2838.
[2]Martin-Belmonte F,Perez-Moreno M.Epithelial cell polarity,stem cells and cancer[J].Nat Rev Cancer,2011,12(1):23.
[3]O′Brien C A,Kreso A,Dick J E.Cancer stem cells in solid tumors:an overview[J].Semin Radiat Oncol,2009,19(2):71.
[4]Lee C,Dunn S E,Yip S.Stem cells in brain tumour development and therapy-two-sides of the same coin[J].Can J Neurol Sci,2012,39(2):145.
[5]Mbeunkui F,Metge B J,Shevde L A,et al.Identification of differentially secreted biomarkers using LC-MS/MS in isogenic cell lines representing a progression of breast cancer[J].J Proteome Res,2007,6(8):2993.
[6]Li C,Heidt D G,Dalerba P,et al.Identification of pancreatic cancer stem cells[J].Cancer Res,2007,67(3):1030.
[7]Zhang S,Balch C,Chan M W,et al.Identification and characterization of ovarian cancer-initiating cells from primary human tumors[J].Cancer Res,2008,68(11):4311.
[8]Suvà M L,Riggi N,Stehle J C,et al.Identification of cancer stem cells in Ewing′s sarcoma.Cancer Res,2009,69(5):1776.
[9]Hiraga T,Ito S,Nakamura H.Side population in MDA-MB-231 human breast cancer cells exhibits cancer stem cell-like properties without higher bone-metastatic potential[J].Oncol Rep.2011,25(1):289.
[10]Hwang-Verslues W W,Kuo W H,Chang P H,et al.Multiple lineages of human breast cancer stem/progenitor cells identified by profiling with stem cell markers[J].PLoS One,2009,4(12):e8377.
[11]Ricci-Vitiani L,Lombardi DG,Pilozzi E,et al.Identification and expansion of human colon-cancer-initiating cells[J].Nature,2007,445(7123):111.
[12]苏 沐,张全安.无血清悬浮法筛选人结肠癌肝细胞样亚群的初步研究[J].实用临床医药杂志,2011,15(24):46.
