Foxp3转染对哮喘小鼠脾淋巴细胞功能的影响*
2012-11-06沈华浩
李 茜, 沈华浩
(1浙江大学医学院附属第二医院呼吸科,浙江 杭州 310009; 2浙江省人民医院 ICU,浙江 杭州 310014)
1000-4718(2012)03-0512-06
2011-07-24
2012-01-05
浙江省自然科学基金资助项目(No.J20040116);卫生部科学研究基金-浙江省医药卫生重大科技计划项目(No.WKJ 2005-2-039)
△通讯作者 Tel: 0571-87783729; E-mail:hh_shen@yahoo.com.cn
Foxp3转染对哮喘小鼠脾淋巴细胞功能的影响*
李 茜2, 沈华浩1△
(1浙江大学医学院附属第二医院呼吸科,浙江 杭州 310009;2浙江省人民医院 ICU,浙江 杭州 310014)
目的转染Foxp3至哮喘小鼠脾淋巴细胞,探讨Foxp3表达对脾淋巴细胞功能的影响。方法卵白蛋白(OVA)致敏激发制作哮喘小鼠模型,收集培养脾脏淋巴细胞;使用电穿孔法转染真核表达载体pcDNA3.1(-)-Foxp3至脾脏淋巴细胞,并设转染空质粒组和对照组;RT-PCR和Western blotting检测Foxp3的表达;流式细胞术检测转染后CD4+CD25+Treg细胞/CD4+细胞比例;MTT法检测转染后的脾脏淋巴细胞增殖反应,ELISA检测脾淋巴细胞上清中白细胞介素4(IL-4)和干扰素γ(IFN-γ)的含量。结果转染组Foxp3 mRNA 和蛋白的表达水平显著高于空质粒组和对照组;转染Foxp3后CD4+CD25+Treg细胞/CD4+细胞比例显著高于空质粒组和对照组;与空质粒组和对照组相比,转染pcDNA3.1(-)-Foxp3质粒明显抑制了脾淋巴细胞增殖;转染组细胞上清中IL-4和IFN-γ含量低于空质粒组和对照组。结论转染pcDNA3.1(-)-Foxp3至哮喘小鼠脾淋巴细胞,Foxp3得到有效表达。Foxp3的高表达能增加CD4+CD25+T细胞的数量,抑制哮喘小鼠脾淋巴细胞的增殖以及Th1和Th2细胞因子的产生。
T淋巴细胞; 转录因子; 哮喘; 小鼠; 脾
调节性T细胞(T regulatory cell,Treg细胞)被认为参与重要免疫耐受机制,能够抑制获得性免疫反应。CD4+CD25+Treg细胞是最为重要的一种调节性T细胞,其表面持续表达CD25,能够抑制效应性CD4+和CD8+细胞的功能。越来越多的证据表明,过敏性疾病和哮喘中存在CD4+CD25+Treg细胞的功能缺陷或数目异常,而CD4+CD25+Treg细胞能够抑制这些疾病的变态反应炎症的发展。Foxp3(forkhead box P3)是调控CD4+CD25+Treg细胞发育及启动抑制功能的总开关,特异性表达于CD4+CD25+Treg细胞表面。本研究将Foxp3的真核表达载体转染至哮喘小鼠脾脏淋巴细胞,检测基因表达情况并探讨对转染细胞功能的影响。
材 料 和 方 法
1动物
清洁级小鼠,6~8周龄,体重17~22 g,雌雄不拘,浙江大学医学院动物中心提供。
2主要试剂与仪器
pcDNA3.1(-)-Foxp3和pcDNA3.1(-)质粒由德国Mainz大学免疫所Michael Stassen教授馈赠,大肠杆菌BL21为本实验室保存,限制性内切酶EcoR I和HindIII (大连宝生物工程公司),UNIQ-10柱离心式质粒小量抽提试剂盒(上海生工生物技术公司),鼠源性逆转录酶M-MLV(Promega), RPMI-1640细胞培养液(Gibco),Supersignal West Femto试剂盒(Pierce),大鼠anti-mouse CD4- FITC mAb (BD),大鼠anti-mouse CD25-PE mAb(BD),小鼠白细胞介素(interleukin,IL)-4 ELISA 试剂盒(R&D),小鼠干扰素(interferon,IFN)-γ ELISA 试剂盒(R&D)。
3方法
3.1质粒的扩增与鉴定
3.1.1感受态BL21菌的制备 取大肠杆菌BL21按细菌储存液∶培养液1∶100接种于2 mL LB液体培养基中,37 ℃、200 r/min振荡培养过夜;按过夜培养菌液∶培养液1∶100接种于5 mL LB液体培养基中,37 ℃、200 r/min振荡培养3 h;使菌体呈毛玻璃状即可。分装于1.5 mL EP管中,4 000 r/min离心10 min,弃上清,吸干多余残液;每管加1 mL 0.1 mol/L冰CaCl2,轻轻吹打均匀,冰浴30 min;4 000 r/min 离心10 min,弃上清;每管加200 μL 0.1 mol/L冰CaCl2,轻轻吹打均匀。
3.1.2质粒转化细菌 上述每管置冰上加入0.5 μL pcDNA3.1(-)-Foxp3或pcDNA3.1(-)质粒,轻轻吹打均匀;冰浴30 min;42 ℃热休克 90 s;迅速放回冰浴2 min;加500 μL液体培养基37℃、200 r/min×1 h;铺到含氨苄青霉素(100 mg/L)平板和阴性平板中37 ℃培养过夜;阳性平板上挑取单个菌落,于含有氨苄青霉素培养液中37 ℃、200 r/min培养过夜。
3.1.3抽提质粒 按质粒抽提试剂盒说明书进行。DNA样品浓度=A260×稀释倍数×50/1 000(g/L),重复1次取平均值为该样品的浓度。
3.1.4pcDNA3.1(-)-Foxp3质粒的酶切鉴定 前步所得的质粒 DNA 用HindIII 和EcoR I双酶切,酶切产物于0.9%凝胶电泳,紫外线下分析,凝胶成像系统拍照。
3.2质粒电穿孔转染脾淋巴细胞
3.2.1脾淋巴细胞细胞制备 C57BL/6小鼠,以卵白蛋白(ovalbumin,OVA)致敏激发制作哮喘小鼠,模型鼠处死后,无菌取脾,剪取部分脾脏以200目滤网研磨,制备脾细胞悬液,红细胞裂解液去除红细胞,计数,调整浓度。
3.2.2质粒电穿孔转染脾淋巴细胞
①脾淋巴细胞悬液洗涤后调整细胞浓度为 1×1010/L,每次电转杯中加入细胞悬液 200 μL+ pcDNA3.1(-)-Foxp3质粒4 μg,冰浴10 min。
②选择电压350 V,电容 25 μF,时间 2 ms,电击一次,电击后再冰浴10 min。
③吸细胞悬液至1.5 mL EP管中,5000 r/min离心10 min,向电转后的细胞加入含10%胎牛血清的RPMI-1640培养液,稀释至2×109/L,每孔2 mL接种于24孔培养板内,加入终浓度为40 mg/L的OVA液,在37 ℃、5%CO2条件下培养60 h。
同时用质粒pcDNA3.1(-)相同方法和条件电穿孔转染淋巴细胞作为空质粒组,相同条件下培养的未予转染的脾淋巴细胞作为对照组。各3孔为1例,每组例数n=8。
3.3转染细胞目的基因表达的检测
3.3.1RT-PCR检测脾淋巴细胞Foxp3 mRNA的表达 以GAPDH为内参照,半定量RT-PCR检测Foxp3 mRNA的表达。具体如下:取前述所得脾淋巴细胞2×106,提取总RNA,取2 μg RNA进行逆转录反应合成cDNA,反应条件:70 ℃预变性5 min,加入M-MLV逆转录酶200 U,再于42 ℃孵育60 min,72 ℃加热10 min灭活逆转录酶。取等量cDNA进行PCR反应,引物序列见表1,反应条件:Foxp3为94 ℃变性3 min,下述条件循环10 次,变性94 ℃ 10 s、退火70 ℃ 20 s、延伸72 ℃ 20 s,再按下述条件循环30次,变性94 ℃ 10 s、退火60 ℃ 20 s、延伸72 ℃ 20 s,最后72 ℃延伸10 min, 4 ℃冷却5 min结束反应;GAPDH为94 ℃变性3 min,按下述条件循环30次,变性94 ℃ 15 s、退火57 ℃ 30 s、延伸72 ℃ 30 s,延伸72 ℃ 20 s,最后72 ℃延伸10 min, 4 ℃冷却5 min结束反应。PCR产物进行琼脂糖电泳,用Biosens Gel Imaging System进行吸光度值扫描,以Foxp3和GAPDH条带吸光度比值作为Foxp3 mRNA水平。
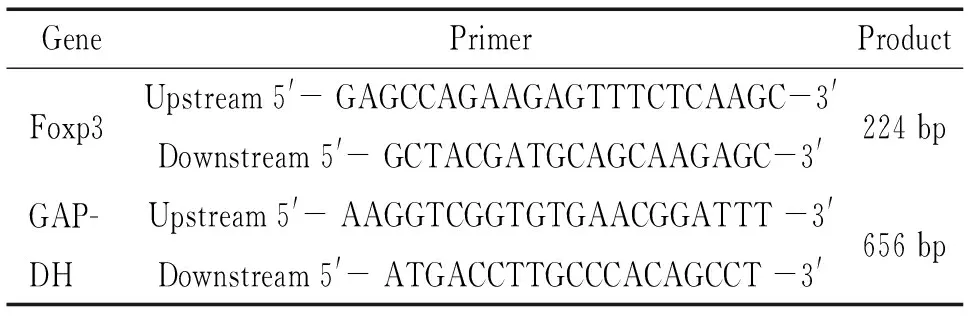
表1 RT-PCR使用的引物序列
3.3.2Western blotting检测转染细胞Foxp3蛋白的表达 取前述所得脾淋巴细胞2×106,以蛋白提取液提取蛋白,用BAC蛋白定量试剂盒定量;取40 μg待测蛋白加入6×加样缓冲液,100 ℃煮沸5 min;灌注10%聚丙烯酰胺凝胶,上样,电泳 80 V 45 min、200 V 90 min;转膜前10 min将硝酸纤维膜和滤纸浸泡在转膜缓冲液中,恒定电压100 V转膜1 h;脂奶粉室温阻断2~3 h;加Foxp3Ⅰ抗室温结合2 h,BST洗涤3次,每次10 min,加Ⅱ抗,室温结合1h,TBST洗涤3次,每次10 min;ECL显色后将滤膜在暗室曝光后显影,定影,使用凝胶图像分析系统BioSenSC300进行条带吸光度值扫描。以GAPDH作为内参照,同样进行以上反应。
3.4流式细胞术检测转染细胞中CD4+CD25+细胞/CD4+细胞的比例 测定管和阴性对照管各加入前述所得脾淋巴细胞1×106(100 μL),测定管加入FITC-anti-CD4抗体和PE-anti-CD25抗体各10 μL,阴性对照管加入同型对照 FITC-rat IgG2b和 PE-rat IgG2b各10 μL,分别避光孵育30 min,PBS洗涤2次后,1%多聚甲醛0.5 mL混悬,上流式细胞仪检测。
3.5转染细胞增殖活性的检测 质粒转染后的细胞,调整浓度为2×109/L,200 μL接种于96孔培养板,每组8孔,均设3复孔。加入40 mg/L OVA液,37 ℃、5%CO2条件下培养60 h。于每孔加入MTT(5 g/L),20 μL/well,继续培养 4 h。离心后吸弃上清,每孔加入二甲基亚砜(dimethyl sulfoxide,DMSO)150 μL,振荡 15 min后在酶标仪上检测490 nm波长处吸光度值。实验时设置调零孔,加培养基、MTT、DMSO。
3.6ELISA检测转染细胞上清液细胞因子含量 收集细胞上清液,放置于-80 ℃冰箱内保存,用于ELISA检测。使用小鼠IL-4和IFN-γ ELISA 试剂盒检测脾淋巴细胞上清细胞因子。
4统计学处理
结 果
1质粒的双酶切鉴定
根据pcDNA3.1-Foxp3的质粒图谱,目的基因和质粒载体在HindIII和EcoR I酶切点连接,故对质粒进行HindIII和EcoR I双酶切电泳鉴定,得到约1 300 bp的片段,,见图1,与Foxp3理论值大小相符。
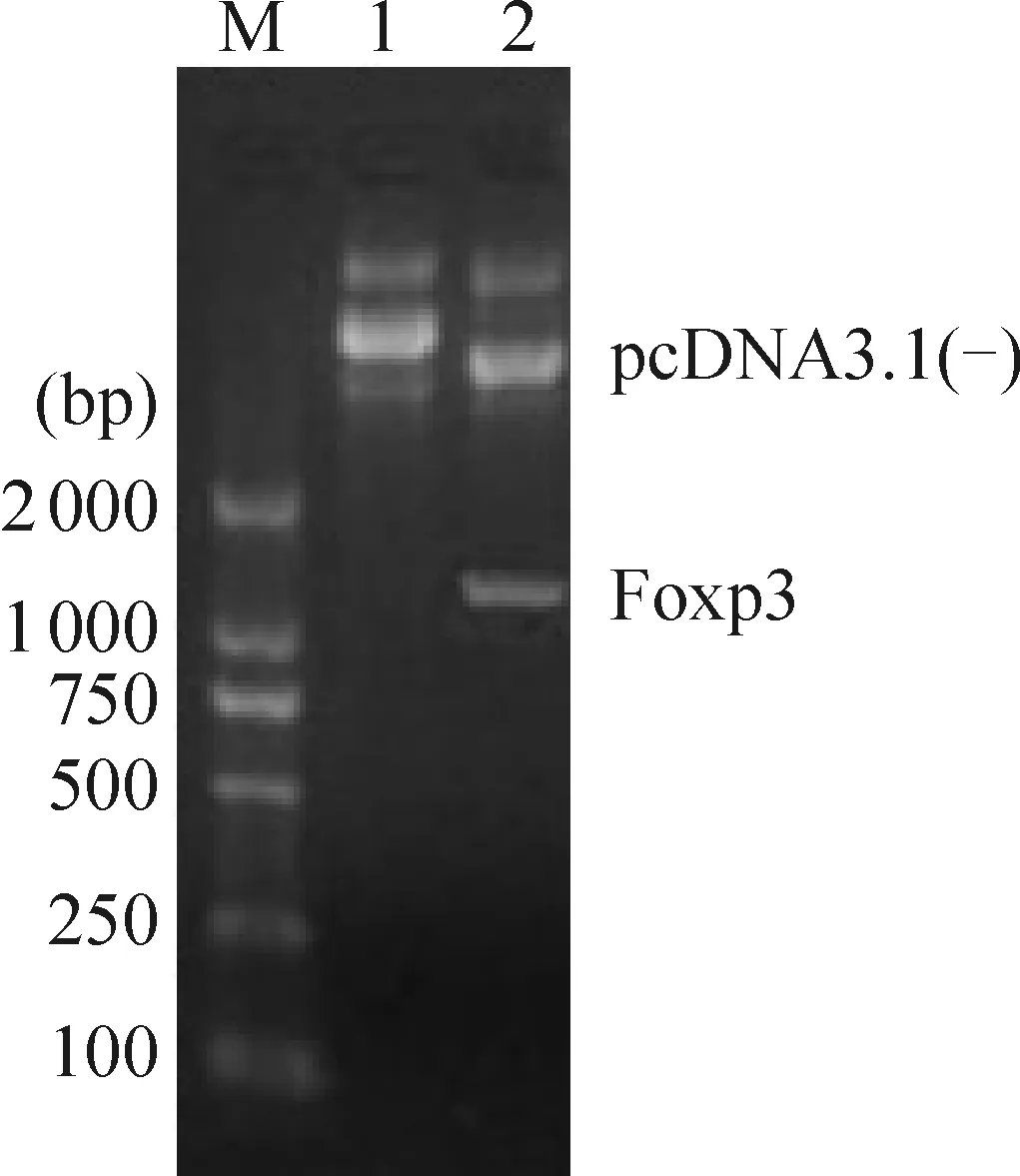
Figure 1. Double endonuclease digestion products of pcDNA3.1(-)-Foxp3. M:marker;Lane 1: pcDNA3.1(-)-Foxp3; Lane 2: pcDNA3.1(-) and Foxp3.
图1pcDNA3.1(-)-Foxp3双酶切产物的电泳图谱
2转染细胞中Foxp3mRNA和蛋白的表达
结果见图2、3和表2,转染组Foxp3 mRNA和蛋白的表达水平明显高于空质粒组和对照组,差异有统计学意义(P<0.01);空质粒组和对照组Foxp3表达水平无显著差异(P>0.05)。
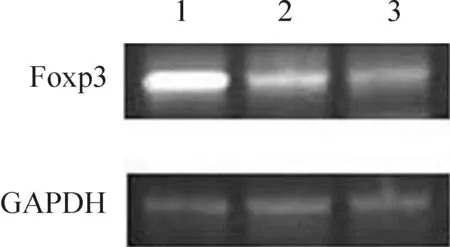
Figure 2. Foxp3 mRNA expression in splenocyte. Lane 1: transfection group;Lane 2: empty vector group;Lane 3: control group.
图2转染细胞Foxp3mRNA的表达
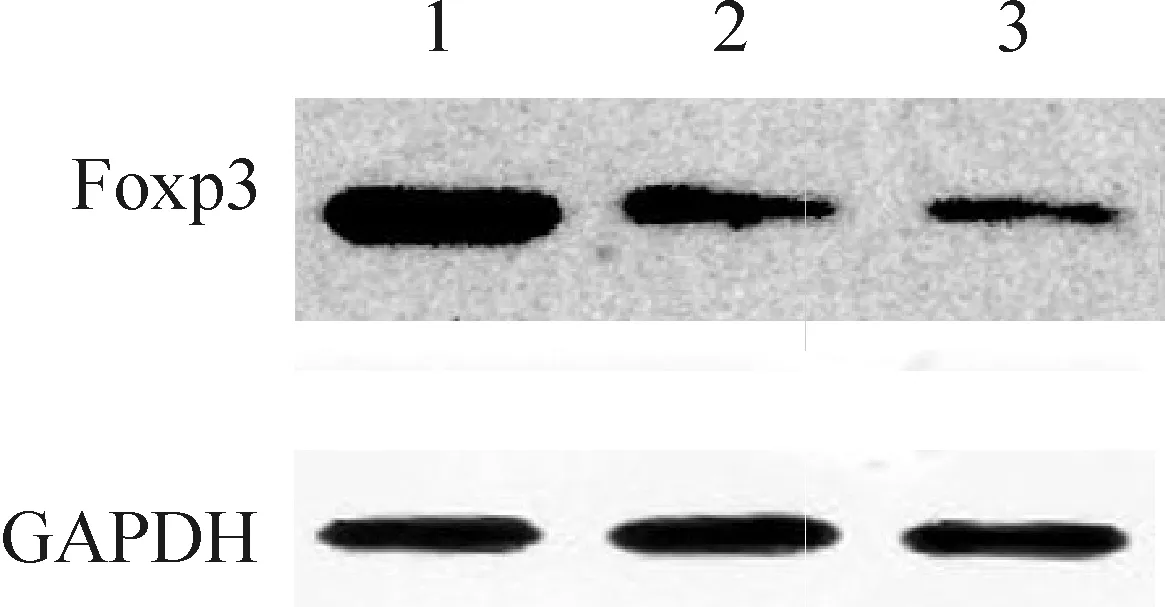
Figure 3. Foxp3 protein expression in splenocyte. Lane 1: transfection group; Lane 2: empty vector group; Lane 3: control group.
图3转染细胞Foxp3蛋白的表达
表2各组脾淋巴细胞中Foxp3mRNA和蛋白的表达


GroupFoxp3mRNAFoxp3proteinTransfection2.138±0.548**2.184±0.529**Emptyvector0.954±0.1761.048±0.266Control0.908±0.2700.896±0.182
**P<0.01vsempty vector group or control group.
3转染pcDNA3.1(-)-Foxp3质粒对脾淋巴细胞中CD4+CD25+细胞/CD4+细胞比例的影响
转染组CD4+CD25+细胞/CD4+细胞比例为(28.28±2.48)%,显著高于空质粒组和对照组[(11.05±2.53)% 和(9. 27±2.04)%],差异有统计学意义(P<0.01),见图4。
4转染pcDNA3.1(-)-Foxp3质粒对脾淋巴细胞增殖的影响
与空质粒组和对照组相比,转染pcDNA3.1(-)-Foxp3质粒明显抑制脾淋巴细胞增殖(P<0.01),见图5。
5转染pcDNA3.1(-)-Foxp3质粒对脾淋巴细胞上清液IL-4和IFN-γ水平的影响
转染组IL-4含量低于空质粒和对照组,差异有统计学意义(P<0.01);转染组IFN-γ含量低于空质粒和对照组,差异有统计学意义(P<0.01)。空质粒组和对照组中各细胞因子含量均无明显差异,见图6。
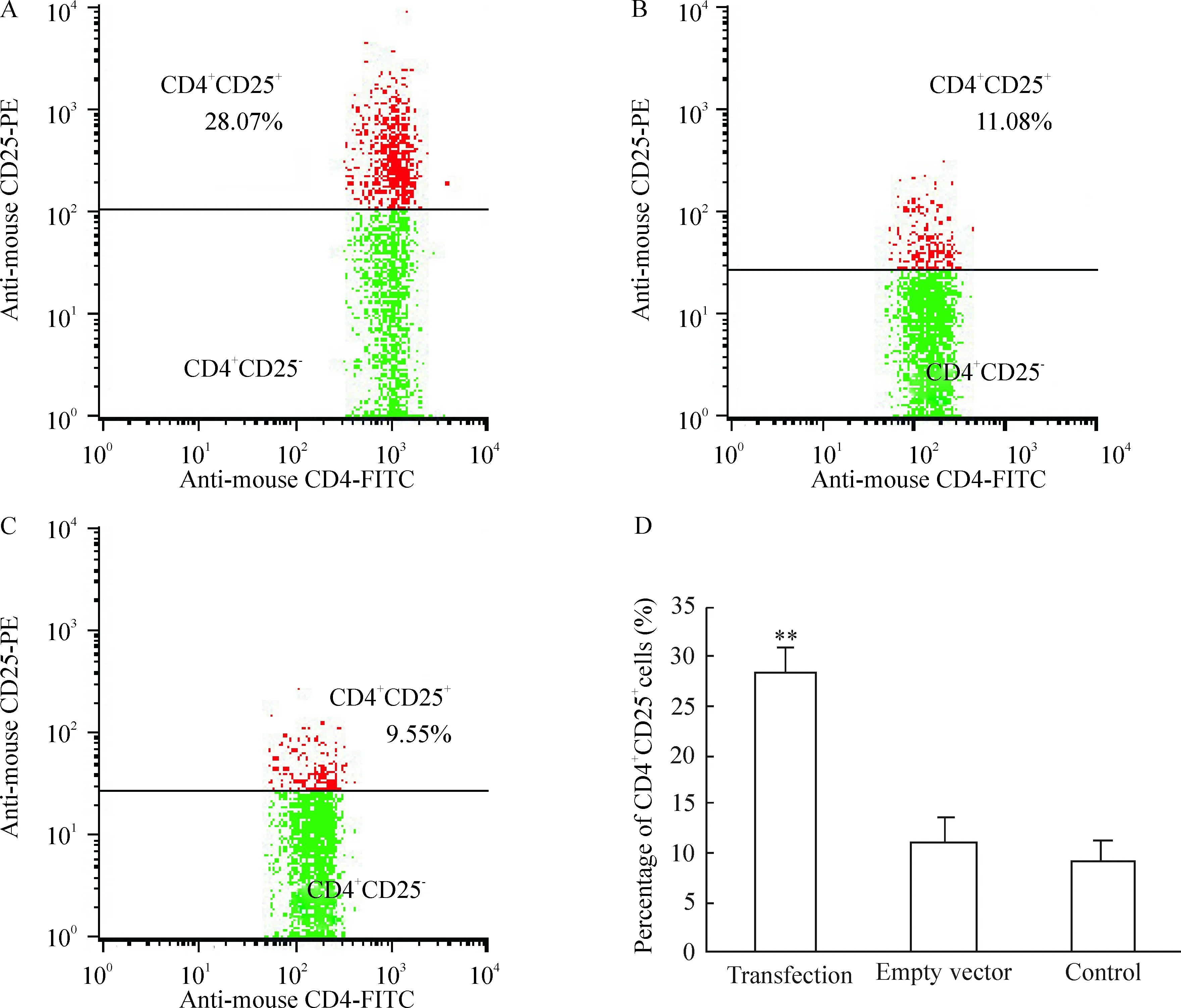

图4转染细胞中CD4+CD25+/CD4+比例
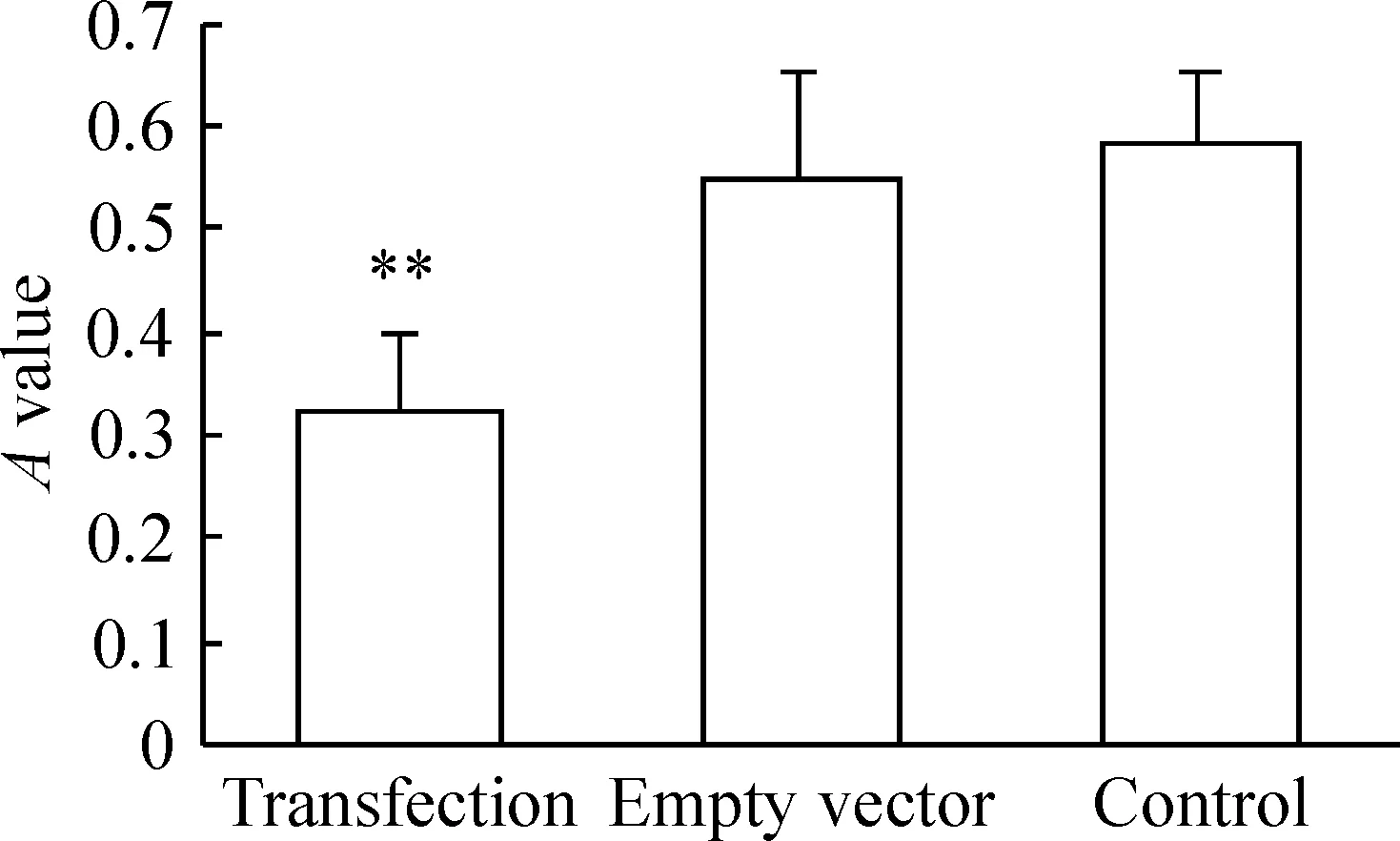

图5转染细胞增殖活性的变化
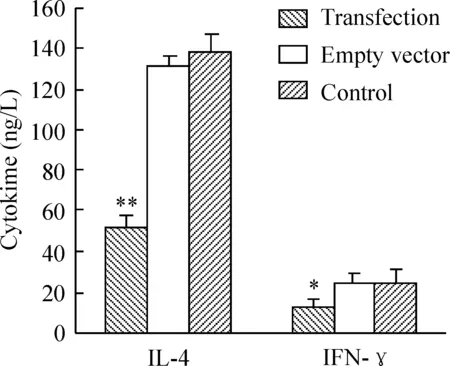

图6ELISA检测脾淋巴细胞上清IL-4、IFN-γ含量
讨 论
CD4+CD25+调节性T细胞由1995年Sakaguchi等[1]首次报道,作为一种具有独特免疫调节作用的专职抑制细胞引起广泛关注,已被证明在自身免疫性疾病、肿瘤免疫、微生物感染及包括支气管哮喘在内的过敏性疾病的发生发展中发挥着重要作用。研究表明,转录因子Foxp3特异性高表达在胸腺和外周CD4+CD25+Treg细胞表面,是CD4+CD25+Treg细胞特异性的标志,Foxp3是调控CD4+CD25+Treg细胞发育及启动抑制功能的总开关基因[2-5]。本实验将Foxp3的真核表达载体转染至哮喘小鼠脾脏淋巴细胞,并对基因表达情况及对转染细胞功能的影响进行研究。
本实验采用电穿孔转染法介导pcDNA3.1(-)-Foxp3和pcDNA3.1空质粒转染到小鼠脾淋巴细胞,RT-PCR和Western blotting结果均证实,转染组Foxp3 mRNA和蛋白含量均显著高于空质粒组和对照组,证明转染的真核表达载体所携带的Foxp3基因在小鼠脾淋巴细胞内得到了有效表达。应用流式细胞术进一步对脾淋巴细胞进行表型分析,高表达Foxp3的转染组中CD4+CD25+细胞/CD4+细胞比例显著高于空质粒组和对照组,Foxp3的表达诱导了CD4+CD25+细胞的产生。
Foxp3是叉头样转录因子家族中的成员,2001年由Brunkow等[6]首次报道,研究发现,它的表达及功能与Treg细胞密切相关。小鼠Foxp3基因编码的蛋白质由429个氨基酸组成,而其特征性的叉头样DNA结合域与家族中其它成员不同,靠近蛋白末端[7]。有学者认为Foxp3这种特殊结构使其不能活化相应基因的转录,因而能发挥抑制转录的作用。Foxp3对CD4+CD25+Treg细胞的发育是必需的,Foxp3的表达足以激活CD4+CD25+Treg细胞发挥其抑制功能。用携带Foxp3逆转病毒载体向CD4+CD25-T细胞导入Foxp3则可实现后者向CD4+CD25+Treg的转化[3]。因此,Foxp3的表达不是T细胞活化的结果,而是CD4+CD25+Treg细胞的一个特异性标志,Foxp3调控了CD4+CD25+Treg的分化发育。本实验中在小鼠脾淋巴细胞高表达的Foxp3,诱导获得了CD4+CD25+Treg细胞,为进一步研究Foxp3和CD4+CD25+Treg细胞功能搭建了一个平台。
本实验还发现,高表达Foxp3的转染组脾淋巴细胞在抗原OVA刺激下增殖受到了明显抑制。Hori等[3]的研究也表明Foxp3转染的CD25-T细胞在体外可以细胞-细胞接触抑制的方式抑制CD4+CD25-应答T细胞活化和增殖以及IL-2分泌。以往认为CD4+CD25+Treg细胞是通过影响了抗原呈递细胞的功能而发挥调节作用的,而现在倾向于它并不直接作用于抗原呈递细胞,但抗原呈递细胞为CD4+CD25+T细胞同靶细胞接触提供作用平台。CD4+CD25+Treg细胞很可能通过活化后表达CTLA-4或膜型TGF-β与靶细胞表面的CD80、CD86或TGF-β受体相互作用,使靶细胞休止于细胞周期G0/G1期而停止增殖,从而介导对靶细胞的抑制作用。Choi等[8]分别将Foxp3基因转染Jurkat细胞和原代T细胞,发现Foxp3能诱导这些细胞血红素加氧酶(heme oxygenase-1,HO-1)的表达,并通过HO-1依赖的途径抑制未转染细胞的增殖。
活化的CD4+T辅助细胞(Th)按其功能和分泌的细胞因子的不同至少分为2群:Th1和Th2,IFN-γ和IL-4分别是Th1和Th2细胞的特异性细胞因子。Th1、Th2细胞因子可促进本亚群和抑制另一亚群的生长分化。本实验中,转染Foxp3的脾淋巴细胞Th1、Th2细胞因子IFN-γ和IL-4分泌均受抑制。一方面,细胞增殖的受抑可能导致了分泌IL-4和IFN-γ的活化的CD4+Th细胞减少,从而细胞因子表达减少。同时,Foxp3也可能作为细胞因子转录抑制子发挥作用。与本实验结果相佐的研究表明,naïve T细胞转录Foxp3后,细胞因子IL-2、IL-4及IFN-γ的表达受到抑制[3,9],而Foxp3突变的Scurfy小鼠大量表达IL-4和IFN-γ等细胞因子[10]。目前,对于Foxp3的下游信号途径还不甚了解。研究证明[9],Foxp3的结合位点位于IL-2启动子旁的活化T细胞核因子(nuclear factor of activated T cell,NFAT)附近,Foxp3可能通过阻止NFAT向IL-2启动子的募集来抑制IL-2的转录。Bettelli等[10]研究也表明Foxp3通过阻断NFAT和核因子 κB(nuclear factor κB,NF-κB)途径,抑制Th细胞的功能,抑制细胞因子基因表达,发挥免疫调节作用;同时发现,与WT(野生型)小鼠比较,Scurfy小鼠来源的T细胞出现NFAT和NF-κB转录活性的明显提高,给Scurfy小鼠来源的T细胞Foxp3后,NFAT和NF-κB转录活性恢复到正常水平。也有研究提示,Treg细胞不是通过抑制Th1细胞的分化及其特异的转录因子T-bet的活性,而可能通过促进IL-10的产生,通过细胞因子间的作用来抑制IFN-γ的产生[11]。
本实验结果表明,转染pcDNA3.1(-)-Foxp3至哮喘小鼠脾淋巴细胞,Foxp3得到有效表达。Foxp3的高表达能增加CD4+CD25+T细胞的数量,抑制哮喘小鼠脾淋巴细胞的增殖和Th1和Th2细胞因子的产生。Foxp3作为CD4+CD25+Treg细胞发育和功能维持的主要调节基因,对它的功能研究有利于深入了解CD4+CD25+Treg细胞的起源及功能,有利于更好地了解CD4+CD25+Treg细胞发挥免疫调节的机制。对Foxp3表达进行调控,可诱导外周CD4+CD25+Treg细胞,为临床治疗哮喘等过敏性疾病提供新的基因治疗途径。
[1] Sakaguchi S, Sakaguchi N,Asano M,et al.Immunologic self-tolerance maintained by activated T cells expressing IL-2 receptor alpha-chains (CD25).Breakdown of a single mechanism of a single mechanism of self-tolerance causes various autoimmune diseases[J]. J Immunol, 1995, 155(3):1151-1164.
[2] Fontenotet JD,Gavin MA,Rudensky AY,et al. Foxp3 programs the development and function of CD4+CD25+regulatory T cells[J]. Nat Immuol, 2003, 4(4):330-336.
[3] Hori S,Nomurat T,Sakaguchi S. Control of regulatory T cell development by the transcription factor Foxp3[J]. Science, 2003, 299(5609):1057-1061.
[4] Fehervari Z, Sakaguchi S. Development and function of CD25+CD4+regulatory T cells[J]. Curr Opin Immunol, 2004, 16(2):203-208.
[5] Rudensky AY. Regulatory T cells and Foxp3[J]. Immunol Rev, 2011, 241(1):260-268.
[6] Brunkow ME, Jeffery EW, Hjerrild KA, et al. Disruption of a new forkhead/winged-helix protein scurfin results in the fatal lymphoproliferative disorder of the scurfy mouse[J]. Nat Genet, 2001, 27(1):68-73.
[7] Carlsson P, Mahlapuu M. Forkhead transcription factors key players in development and metabolism[J]. Dev Biol, 2002, 250(1):1-23.
[8] Choi BM, Pae HO, Jeong YR, et al. Critical role of heme oxygenase-1 in Foxp3-mediate immune suppression[J]. Biochem Biophys Res Commun, 2005, 327(4):1066-1071.
[9] Schubert LA, Jeffery E, Zhang Y, et al. Scurfin(FOXP3) acts as a repressor of transcription and regulates T cell activation[J]. J Biol Chem, 2001, 276(40):37672- 37679.
[10]Bettelli E, Dastranger M, Oukka M. Foxp3 interacts with nuclear factor of activated T cells and NF-κB to repress cytokine gene expression and effector function of T helper cells[J]. Proc Natl Acad Sci U S A, 2005, 102(14):5138-5143.
[11]Sojka DK, Fowell DJ. Regulatory T cells inhibit acute IFN-γ synthesis without blocking T-helper cell type 1 (Th1) differentiation via a compartmentalized requirement for IL-10[J]. Proc Natl Acad Sci U S A, 2011, 108(45):18336-18341.
EffectsofFoxp3transfectiononsplenocytefunctionsinasthmamice
LI Qian2, SHEN Hua-hao1
(1DepartmentofRespiratoryMedicine,TheSecondAffiliatedHospital,ZhejiangUniversitySchoolofMedicine,Hangzhou310009,China;2IntensiveCareUnit,People’sHospitalofZhejiangProvince,Hangzhou310014,China.E-mail:hh_shen@yahoo.com.cn)
AIM: To study the expression and the effects of Foxp3 on the immunologic functions by transfecting the Foxp3 eukaryotic expression plasmid into the splenocytes of the asthma mice.METHODSThe mice were sensitized and challenged by ovalbumin to make asthma model. The splenocytes were harvested and cultured. The Foxp3 expression vector pcDNA3.1(-)-Foxp3 was transfected into the splenocytes with electroporation. The splenocytes transfected with empty vector [pcDNA3.1(-)] and control splenocytes (non-transfected) were also set up. The expression of Foxp3 at mRNA and protein levels was detected by RT-PCR and Western blotting, respectively. The proportion of CD4+CD25+Treg cells/CD4+cells was measured by flow cytometry. Proliferation of the splenocytes was analyzed with MTT assay. ELISA was used to determine the levels of interleukin 4 (IL-4) and interferon γ (IFN-γ) in the supernatant of the splenocytes.RESULTSThe expression of Foxp3 at mRNA and protein levels in transfection group was significantly higher than that in empty vector group and control group. The proportion of CD4+CD25+Treg cells/CD4+cells in transfection group was higher than that in empty vector group and control group. The proliferation of transfected cells was markedly inhibited compared with empty vector group and control group. The levels of IL-4 and IFN-γ were significantly lower in transfection group than those in empty vector group and control group.CONCLUSIONThe transfectedFoxp3 gene overexpresses in the splenocytes of asthma mice. Foxp3 increases the number of CD4+CD25+T cells and inhibits the proliferation and production of Th1/Th2 cytokines in splenocytes.
T-lymphocytes; Transcription factor; Asthma; Mice; Spleen
R392
A
10.3969/j.issn.1000-4718.2012.03.022
