下调X连锁调亡抑制蛋白基因表达增强多西他赛诱导膀胱癌细胞凋亡的作用*
2012-11-06卢瑜,方勇
卢 瑜, 方 勇
(1南京军区杭州疗养院,浙江 杭州 310007;2浙江大学医学院附属邵逸夫医院肿瘤内科,浙江 杭州 310016)
1000-4718(2012)03-0427-06
2011-10-15
2011-12-14
浙江省中医药青年基金资助项目(No.2005-A-12)
△通讯作者 Tel:0571-86006926 ;E-mail:fyzju@sina.com
下调X连锁调亡抑制蛋白基因表达增强多西他赛诱导膀胱癌细胞凋亡的作用*
卢 瑜1, 方 勇2△
(1南京军区杭州疗养院,浙江 杭州 310007;2浙江大学医学院附属邵逸夫医院肿瘤内科,浙江 杭州 310016)
目的观察人源性膀胱癌细胞在下调X连锁凋亡抑制蛋白(XIAP)基因表达后,多西他赛对其敏感性的影响。方法以shRNA和shRNA-XIAP质粒分别稳定转染人源性膀胱癌T24T细胞。以荧光显微镜观察转染细胞。以RT-PCR和Western blotting法分别检测膀胱癌细胞XIAP mRNA和蛋白的表达。与T24T以及转染空载体的T24T细胞相比较,以ATPase法检测多西他赛对转染XIAP基因的膀胱癌细胞的细胞毒性。相差显微镜下观察,流式细胞术检测多西他赛预处理转染XIAP基因的膀胱癌细胞的凋亡率;以Western blotting法检测细胞内的聚腺苷二磷酸核糖聚合酶(PARP)和caspase-3蛋白表达和裂解水平。结果荧光显微镜下分别观察shRNA和shRNA-XIAP转染的T24T细胞,均见稳定荧光。Western blotting和RT-PCR检测结果显示,人源性膀胱癌T24T细胞在稳定转染反义XIAP基因后,其XIAP蛋白和mRNA水平均显著降低。经多西他赛处理24 h后, 转染反义XIAP基因的T24T细胞IC50为(1.23±0.62)nmol/L,远低于T24T以及转染空白载体的对照组细胞[(8.22±1.23) nmol/L,(8.35±0.98) nmol/L,P<0.01]。流式细胞术检测结果显示, T24T shRNA-XIAP细胞组(2 nmol/L和5 nmol/L)凋亡率[(41.45±6.23)%和(74.82±5.46)%]显著高于转染空载体细胞的凋亡率[(25.34±3.81)%和(34.14±6.25)%,P<0.01]。与转染空载体的细胞相比较,T24T shRNA-XIAP细胞内的PARP和caspase-3明显降低。结论下调膀胱癌细胞的XIAP基因表达后,可显著增强化疗药物多西他赛所诱导的膀胱癌细胞的凋亡,并增强多西化赛的细胞毒性。
T24T细胞; X连锁凋亡抑制蛋白; 多西他赛; 细胞凋亡
世界范围内,膀胱癌发病率居恶性肿瘤的第9位,男性排名第6位,女性排在第10位之后[1]。中国男性膀胱癌发病率位居全身肿瘤的第8位,女性排在第12位以后。但近年来我国部分城市肿瘤发病率报告显示膀胱癌发病率有增高趋势。
大部分膀胱癌患者确诊时处于分化良好或中等分化的非肌层浸润性膀胱癌,但其中约25%的患者最终可发展为肌层浸润性膀胱癌或转移性膀胱癌[2]。患者出现远处转移病灶后,需要接受化放疗治疗。患者常接受包括多西他赛(docetaxel)在内的二线药物治疗方案[3]。但由于肿瘤细胞易对化疗药物产生耐受性, 药物治疗常达不到满意的疗效。
X连锁凋亡抑制蛋白(X-linked inhibitor of apoptosis protein, XIAP)是哺乳动物细胞内存在的一种抑制凋亡蛋白(inhibitor of apoptosis proteins,IAPs),能直接和caspases家族成员中介导蛋白酶级联下游效应分子caspase-3、caspase-7和caspase-9结合并抑制其活性, 并可抑制化疗药物、紫外线照射、Bax诱导的凋亡[4]。有研究显示, 肿瘤细胞中XIAP水平的升高是肿瘤细胞逃避化疗药物杀伤作用的原因之一[5]。近些年, XIAP在肿瘤化疗敏感性中的作用及价值受到了国内外学者越来越多的重视。并在多种肿瘤中,如在胃癌、肺癌、胰腺癌和肝癌细胞系中均证明下调XIAP蛋白水平,可提高肿瘤对化疗药物的敏感性。在本研究中,我们以shRNA技术沉默XIAP基因,观察多西他赛药物诱导膀胱癌细胞的细胞毒性和凋亡效应的影响, 以探索改进膀胱癌化疗疗效的新方法。
材 料 和 方 法
1材料
真核表达载体shRNA-XIAP和空白载体购自Open Biosystem(载体包含GFP荧光显色)。转染试剂LipofectamineTM购自Invitrogen。XIAP、聚腺苷二磷酸核糖聚合酶[poly(ADP-ribose) polymerase, PARP]、caspase-3和GAPDH抗体均购自Santa Cruz。新生牛血清、DMEM、TRIzol® Reagent Kit和嘌吟霉素(puromycin)购自Gibco。 二甲基亚砜(DMSO)和ATP生物荧光检测试剂盒购自Promega。多西他赛为法国赛诺菲-安万特制药厂产品。高表达XIAP基因的人源性膀胱癌细胞T24T购自ATCC,细胞在含有10%新生牛血清、100 kU/L青霉素及100 mg/L链霉素的 DMEM/F12培养基、37 ℃、5% CO2条件下培养, 每3 d/传代1次。
2方法
2.1分组 转染细胞设置未转染对照组、shRNA表达质粒转染组和shRNA-XIAP融合质粒转染组。基因转染步骤参照LipofectamineTM试剂盒说明书进行,分别在转染后24、48 和72 h于荧光倒置显微镜下观察GFP荧光。转染72 h后, 加入嘌呤霉素筛选4周,终浓度5 mg/L。克隆细胞形成后, 随机挑选克隆,扩增抗性细胞, 荧光显微镜观察细胞内GFP表达荧光。
2.2T24T细胞XIAP mRNA和蛋白表达的检测 收集细胞约1×106, 按TRIzol®试剂盒说明书提取总RNA,采用Invitrogen公司RT-PCR试剂盒。逆转录反应体系: 模板RNA 2 μg, 10 mmol/L dNTP 1 μL, RNA酶抑制剂(RNasin)1 μL,Oligo dT 1.5 μL, AMV逆转录酶1 μL, 5×逆转录酶缓冲液5 μL, 终体积为25 μL, 50 ℃ 50 min, 采用Pub Mediline的Primer Blast软件设计XIAP基因PCR引物(扩增产物大小281 bp),上游引物5’-TTTCCAGATTGGGGCTCGGG-3’,下游引物5’-CCCTGCTCGTGCCAGTGTTGAT-3’,由上海捷倍思基因技术有限公司合成。同时以GADPH作为内参照。PCR产物经2%琼脂糖凝胶电泳, MGIAS-1000凝胶成像系统扫描定量并拍照。采用Western blotting法检测转染细胞株XIAP蛋白表达情况。即胰酶消化收集细胞,PBS洗2次,加入蛋白提取液提取细胞总蛋白。Bio-Rad DC蛋白定量检测试剂盒测定蛋白浓度。8%和12.5%聚丙烯酰胺凝胶电泳分离80 μg细胞总蛋白后,转至PVDF膜(Bio-Rad);常规封闭过夜,室温下与抗人XIAP、GAPDH抗体(1∶1 000,Santa Cruz)孵育2 h,与辣根过氧化物酶标记的Ⅱ抗(1∶7 500, ImmunoResearch)孵育1 h。每次孵育后,均用含0.02% Tween 20的PBS洗脱3次,用ECL(Amersham)系统检测信号。
2.3ATP生物荧光检测法检测细胞毒性 将T24T、转染空载体T24T shRNA以及T24T shRNA-XIAP细胞,以5 000 cells/well的密度接种于96孔培养板, 设置不加药物阴性对照,不同浓度的多西他赛药物与细胞共同作用48 h。使用Promega公司荧光酶试剂盒(LOT# 154590),去掉上清后,加入荧光酶底物后,荧光扫描仪(Microplate Luminometer LB 96 V)测定荧光强度,软件分析药物各浓度抑制率,计算IC50,并绘制药物作用曲线,评估药物作用。
2.4PI 染色法和流式细胞仪检测细胞凋亡 胰酶消化并收集细胞,70%乙醇固定,4 ℃保存。600×g离心5 min,并用PBS液 (含有0.5% BSA 和0.1% Triton X-100)洗2次。加入PI染色液避光保存30 min后,用流式细胞仪(Beckman Coulter)检测DNA含量和凋亡细胞百分数。
2018年12月11日,唐纳森无锡新工厂奠基仪式在华平(无锡)智造园成功举行。无锡新吴区领导及区党政办、宣传部、经发局等各部门负责人、星洲股份公司负责人、唐纳森公司董事长兼首席执行官Tod Carpenter先生、亚太区副总裁Franklin Cardenas先生、大中华区总裁毕明先生以及唐纳森的重点客户和供应商代表一同出席了奠基仪式。
2.5Western blotting检测细胞内PARP和caspase-3蛋白裂解 蛋白转膜后,室温下与抗人PARP、caspace-3、GAPDH抗体孵育2 h,与辣根过氧化物酶标记的Ⅱ抗(1∶7 500, ImmunoResearch)孵育1 h。每次孵育后,均用含0.02% Tween 20的PBS洗脱3次,用ECL(Amersham)系统检测信号。
3统计学处理
结 果
1shRNA-XIAP转染肿瘤细胞后下调XIAP表达水平
将shRNA载体和shRNA-XIAP分别转染到T24T细胞,经嘌呤霉素筛选4周后,可见明显的阳性克隆, 继续扩增培养, 分别获得稳定表达shRNA-XIAP和空白载体shRNA的T24T细胞。经荧光显微镜下观察,转染后的T24T细胞内均出现稳定的GFP绿色荧光,见图1。
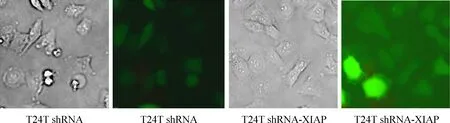
Figure 1. T24T cells were stably transfected with shRNA and shRNA-XIAP plasmids, and puromycin was used as drug selection to acquire the stable expression cells. The GFP green fluorescence appeared in the cytoplasm under the fluorescence microscope (×400).
图1shRNA载体和shRNA-XIAP分别转染到T24T细胞后GFP的表达
转染shRNA和shRNA-XIAP的细胞经Western blotting检测均可见分子量为55 kD的蛋白条带,见图2A。经RT-PCR检测T24T细胞均可见281 bp的XIAP扩增条带, 但T24T shRNA-XIAP细胞以同量的RNA模板扩增后仅有微弱的显影,见图2B。经图形分析软件扫描检测,以GADPH为内参照,T24T shRNA-XIAP组的XIAP蛋白表达较对照组T24T shRNA细胞明显减低,见图2C。以上结果表明转染shRNA-XIAP后,XIAP蛋白和mRNA水平均下调。
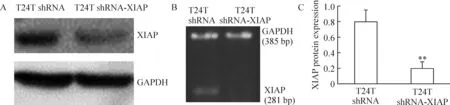
图2转染shRNA-XIAP和shRNA的T24T细胞XIAP蛋白和mRNA的表达
2下调XIAP表达后增强多西他赛药物的细胞毒性
实验分未转染对照组、shRNA表达质粒转染组、shRNA-XIAP融合质粒转染组。不同浓度的多西他赛作用细胞48 h后,检测细胞的ATPase活力,见图3。T24T细胞和shRNA T24T细胞之间的生长抑制率无显著区别,其IC50分别为(8.22±1.23)nmol/L和(8.35±0.98) nmol/L。而shRNA-XIAP T24T细胞的IC50为(1.23±0.62)nmol/L,其细胞的生长抑制率较其余2组有显著差异(P<0.01)。


图3不同浓度的多西他赛分别预处理未转染对照组、shRNA表达质粒转染组和shRNA-XIAP融合质粒转染组T24T细胞48h后细胞的ATPase活性
与shRNA T24T细胞相比较,shRNA-XIAP T24T细胞经2.5 nmol/L和5nmol/L多西他赛处理后,出现典型的凋亡形态学改变,如体积变小,细胞质浓缩等现象,而细胞的增殖也受到抑制,见图4A。T24T shRNA-XIAP细胞组2nmol/L和5nmol/L多西他赛诱导的凋亡率分别为(41.45±6.23)%和(74.82±5.46)%, 显著高于转染对照空载体细胞的凋亡率[(25.34±3.81)%和(34.14±6.25)%],P<0.01,见图4B。
4下调XIAP基因表达后促进肿瘤细胞内PARP和caspase-3蛋白的裂解
T24T shRNA-XIAP细胞的XIAP蛋白表达较T24T shRNA细胞明显下调。与T24T shRNA细胞相比较,T24T shRNA-XIAP细胞经2.5 nmol/L和5 nmol/L多西他赛处理后,较明显地出现了PARP和caspase-3的裂解产物——有活性的17 kD (p17)亚单位,见图5。证实下调XIAP基因可显著地增加细胞内PARP和caspase-3蛋白发生裂解,诱导肿瘤细胞凋亡。
讨 论
泌尿系统来源的膀胱上皮肿瘤是我国常见的恶性肿瘤之一,近年来发病率呈明显上升趋势, 其晚期接受进一步化放疗的治疗效果仍不理想[2,6]。 本研究证实,通过下调膀胱癌细胞内的XIAP基因,将有助于增加化疗药物如多西他赛的细胞毒性,促进caspase-3裂解,膀胱癌细胞凋亡明显增多,有助于提高临床疗效。同时也表明在多西他赛诱导肿瘤细胞凋亡过程中,XIAP起着重要作用。
越来越多的研究表明,有效诱导细胞凋亡是化疗药物杀伤肿瘤细胞的重要作用机制。对细胞凋亡的抗性是肿瘤细胞耐药性产生的新机制, 可以解释相当一部分化疗失败的原因[7]。IAPs是细胞内一类独特的抗凋亡蛋白家族, 包括XIAP、cIAP1、cIAP2、神经元凋亡抑制蛋白(neuronal apoptosis inhibitory protein,NAIP)、livin和survivin等。XIAP分子量57 kD,其基因定位于Xq25,主要由3个杆状病毒IAP重复序列区(baculoviral inhibitor of apoptosis repeat,BIR)和1个RING锌指结构域(ring Zn finger domain)组成。XIAP的N-端有3个BIR结构域:BIR1、BIR2和BIR3[8]。体外动力学研究表明, XIAP是IAP家族里最强有力的caspase抑制物。XIAP的BIR2及BIR2前的连接区参与抑制caspase-3和caspase-7的活性, 单独的BIR3结构域也足以能够抑制caspase-9的活性, 这表明XIAP的不同BIR是以不同的方式抑制caspase-3和caspase-9的活性[9]。
已经有研究证实, 过表达XIAP可抑制凋亡, 提示XIAP可作为肿瘤等疾病基因治疗的新靶点。本研究的结果也证实,通过抑制细胞内的XIAP表达,多西他赛诱导的caspase-3裂解明显增加,促进肿瘤细胞凋亡。如He等[10]证实通过HtrA1(属于丝氨酸蛋白酶家族)促进卵巢肿瘤细胞的XIAP降解,可提高顺铂所诱导的卵巢肿瘤细胞的细胞毒性。转导反义XIAP不仅使卵巢癌细胞对顺铂诱导的细胞凋亡的敏感性增加, 而且还激活了caspase介导的鼠双微粒体-2(murine double minute-2,MDM2)活化和p53的积聚[11]。另外在血液系统疾病中,对78名急性髓系白血病患者的研究发现, XIAP和患者存活率有直接相关性, XIAP低水平的患者比XIAP高水平者的存活时间明显延长[12]。这些实验结果均证实XIAP可影响化疗药物的敏感性,并影响患者的预后。
汪良等[13]报道细胞在转染XIAP基因并使其过表达后,可导致其对化疗药物丝裂霉素的敏感性下降。另外,阴振飞等[14]证明化疗药物可下调膀胱癌细胞XIAP的表达。我们的实验中,通过shRNA技术转染并下调人源性膀胱癌细胞内的XIAP基因的表达,证实能显著增降低多西他赛药物的IC50,诱导细胞出现凋亡,促进细胞体内的PARP和原caspase-3的裂解, 与文献报道的XIAP作用机制相符合。其结果与已有在膀胱癌中的上述研究结果相吻合。这一结果为提高膀胱癌患者化疗敏感性提供新的思路, 也为进一步研究XIAP基因在诱导实体肿瘤细胞凋亡及凋亡调控途径中的作用奠定了基础。

Figure 4. Apoptosis of T24T shRNA and T24T shRNA-XIAP cells treated with different concentrations of docetaxel for 24 h. A: observation under phase-contrast microscope (×400). B: flow cytometry detection.
图4不同浓度的多西他赛预处理对shRNA表达质粒转染组和shRNA-XIAP融合质粒转染组T24T细胞凋亡的影响
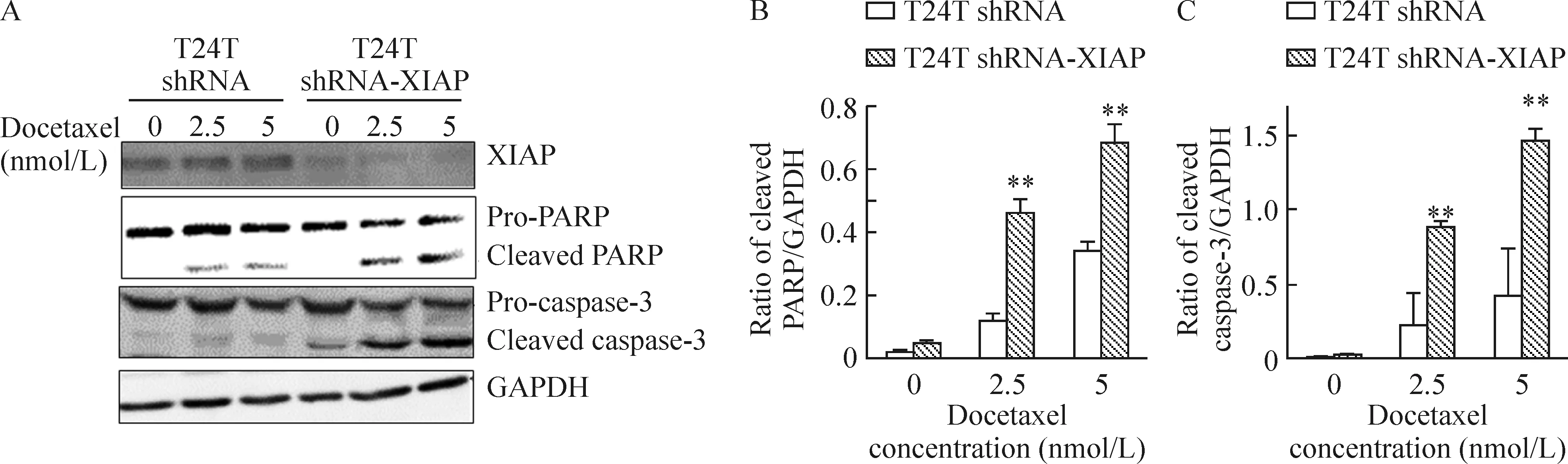

图5T24TshRNA和T24TshRNA-XIAP细胞接受2.5nmol/L和5nmol/L多西他赛24h后PARP和caspase-3蛋白的裂解情况
同时本研究也还有不足之处。临床上多西他赛一般是晚期膀胱癌患者的二线药物方案,多数病人此前已接受一线含铂方案的化疗。本实验中直接使用多西他赛,与临床有一定距离。因此,转染XIAP基因至肿瘤细胞后,其它含铂类化疗药物对细胞毒性的影响还需要在今后的研究工作中得到进一步证实。细胞内其它信号转导途径如JNK/c-Jun和JAK/STAT的变化也有待进一步研究。
[1] Jemal A, Siegel R, Ward E, et al. Cancer statistics, 2009[J]. CA Cancer J Clin, 2009,59(4):225-249.
[2] Yafi FA, Duclos M, Correa JA, et al. Contemporary outcome and management of patients who had an aborted cystectomy due to unresectable bladder cancer[J]. Urol Oncol,2011, 29(3):309-313.
[3] McCaffrey JA, Hilton S, Mazumdar M, et al. Phase II trial of docetaxel in patients with advanced or metastatic transitional cell carcinoma [J]. J Clin Oncol, 1997,15(5):1853-1857.
[4] Hock M, Gibson H, Korneluk RG. XIAP: apoptotic brake and promising therapeutic target [J]. Apoptosis,2001,6(4):253-261.
[5] Sasaki H, Sheng Y, Kotsuji F, et al. Down-regulation of X-linked inhibitor of apoptosis protein induces apoptosis in chemoresistant human ovarian cancer cells [J]. Cancer Res, 2000,60(20):5659-5666.
[6] 顾方六.尿路上皮肿瘤的诊断和治疗[M].∥吴阶平. 吴阶平泌尿外科学.第1版. 济南:山东科学技术出版社,2004.961-980.
[7] Wang ZH, Chen H, Guo HC, et al. Enhanced antitumor efficacy by the combination of emodin and gemcitabine against human pancreatic cancer cells via downregulation of the expression of XIAPinvitroandinvivo[J]. Int J Oncol,2011,39(5):1123-1131.
[8] Zou B, Chim CS, Pang R, et al. XIAP-associated factor 1 (XAF1), a novel target of p53, enhances p53-mediated apoptosis via post-translational modification [J]. Mol Carcinog, 2011 Jun 15.[Epub ahead of print].
[9] Deveraux QL, Leo E, Stennicke HR, et al. Cleavage of human inhibitor of apoptosis protein XIAP results in fragments with distinct specificities for caspases [J]. EMBO J, 1999,18(19):5242-5251.
[10]He X, Khurana A, Maguire JL, et al. HtrA1 sensitizes ovarian cancer cells to cisplatin-induced cytotoxicity by targeting XIAP for degradation [J]. Int J Cancer,2012,130(5):1029-1035.
[11]Carter BZ, Mak DH, Schober WD, et al. Simultaneous activation of p53 and inhibition of XIAP enhance the activation of apoptosis signaling pathways in AML [J]. Blood,2010,115(2):306-314.
[12]Carter BZ, Milella M, Tsao T, et al. Regulation and targeting of antiapoptotic XIAP in acute myeloid leukemia [J]. Leukemia, 2003, 17(11):2081-2089.
[13]汪 良, 曾甫清,陈方敏,等. 转染XIAP基因对丝裂霉素诱导膀胱癌细胞凋亡的影响[J].临床泌尿外科杂志,2004,19(4):226-228。
[14]阴振飞,李 鸣, 来永庆,等. 化疗药物剂量依赖性下调化疗敏感膀胱癌细胞中X染色体连锁的凋亡抑制蛋白的水平[J].中华医学杂志,2006,86(25):1774-1777.
Effectsofdown-regulationofX-linkedinhibitorofapoptosisproteingeneondocetaxel-inducedapoptosisinbladdercancercells
LU Yu1, FANG Yong2
(1HangzhouSanatoriumofNanjingMilitaryRegion,Hangzhou310007,China;2DepartmentofMedicalOncology,SirRunRunShawHospital,SchoolofMedicine,ZhejiangUniversity,Hangzhou310016,China.E-mail:fyzju@sina.com)
AIM: To observe the effects of down-regulation of X-linked inhibitor of apoptosis protein (XIAP) gene on the chemotherapeutic sensitivity of bladder cancer cells.METHODSThe shRNA and shRNA-XIAP were transfected into bladder cancer T24T cells. The fluorescence microscopy was used to detect the transfection effects.XIAPgene expression was detected by RT-PCR and Western blotting. Docetaxel was administrated to T24T, T24T shRNA and T24T shRNA-XIAP bladder cancer cells. ATPase methods was performed to measureinvitrocell viability. Morphological changes and apoptotic rates were determined by phase contrast microscopy and flow cytometry assay. Cellular poly(ADP-ribose) polymerase (PARP) and caspase-3 protein expression and their cleavage were assayed by Western blotting.RESULTSThe fluorescence was obvious in the T24T shRNA and T24T shRNA-XIAP cells under the fluorescence microscope. Using Western blotting and RT-PCR methods, the protein and mRNA levels ofXIAPgene in T24T shRNA-XIAP cells were significantly decreased,respectively. After treated with various concentrations of docetaxel for 24 h, the IC50of T24T shRNA-XIAP cells was (1.23±0.62) nmol/L, lower than that of T24T and T24T shRNA cells, which were (8.22±1.23) and (8.35±0.98) nmol/L (P<0.01), respectively. Compared with control group, the typical morphological changes of apoptosis were observed in T24T shRNA-XIAP cells. Detected by flow cytometry assay, the apoptotic rates in shRNA-XIAP group were (41.45±6.23)% and (74.82±5.46)% after exposed to docetaxel at the concentrations of 2 nmol/L and 5 nmol/L for 24 h, which were significantly higher than that in T24T shRNA group with (25.34±3.81)% and (34.14±6.25)%, respectively (P<0.01). Compared with T24T shRNA cells, the cleavage of PARP and caspase-3 proteins in the cells transfected with shRNA-XIAP was significantly increased.CONCLUSIONXIAPgene is significantly down-regulated via shRNA-XIAP, which could increase the docetaxel-induced apoptosis and cytotoxic activity.
T24T cells; X-linked inhibitor of apoptosis protein; Docetaxel; Apoptosis
R73
A
10.3969/j.issn.1000-4718.2012.03.008
