以组织因子为靶点的肿瘤免疫治疗结合物的合成及其对结直肠癌细胞的影响
2012-11-06饶本强梁绮雯汪建平黄振倩
许 希, 饶本强, 梁绮雯 刘 丹, 谭 获, 汪建平△, 黄振倩△
(1广州医学院第一附属医院肿瘤血液中心,广东 广州 510230;2中山大学附属第六医院,广东 广州 510655)
1000-4718(2012)03-0420-07
2011-07-31
2011-12-21
△通讯作者 汪建平 Tel:020-38250737; E-mail:wangjpgz@yahoo.com.cn; 黄振倩 Tel:020-34294310;E-mail:huangzq2003@yahoo.com.cn
▲并列第1作者
以组织因子为靶点的肿瘤免疫治疗结合物的合成及其对结直肠癌细胞的影响
许 希1▲, 饶本强2▲, 梁绮雯2刘 丹1, 谭 获1, 汪建平2△, 黄振倩1△
(1广州医学院第一附属医院肿瘤血液中心,广东 广州 510230;2中山大学附属第六医院,广东 广州 510655)
目的构建含hFVII-LC+hIgG1-Fc cDNA的重组真核表达载体,并转染中国仓鼠卵巢细胞亚株CHO-K1获得以组织因子(TF)为靶点的免疫治疗结合物用于肿瘤的靶向治疗。方法用分子生物学方法从汉族人肝组织和淋巴细胞中分别获得hFVII-LC和hIgG1-Fc DNA片段并用连接酶正向克隆入真核表达质粒pcDNA3.1(+)中。以脂质体法转染阳性质粒入CHO-K1细胞,G418加压筛选获得阳性单克隆细胞;Excel 301无血清培养液扩大培养, 培养液Ni-NTA亲和层析纯化和制备hFVIII-LC+hIgG1-Fc融合蛋白,ELISA法检测该融合蛋白与TF的靶向作用,免疫激活物与结肠癌细胞HT-29及NK细胞混合培养检测结合物激活NK细胞的能力。结果以汉族人肝组织和淋巴细胞为模板扩增的hFVII-LC和hIgG1-Fc DNA片段经测序证实与基因库报道的系列完全一致;经酶切分析、测序证实构建的hFVII-LC+hIgG1-Fc融合基因片段完整地落在真核表达质粒pcDNA3.1(+)的阅读框架中;LipofectamineTM2000转染试剂能获得含pcDNA3.1(+)-hFVII-LC+hIgG1-Fc阳性的CHO-K1细胞,经1 g/L G418加压筛选可以获得分泌hFVII-LC+hIgG1-Fc融合蛋白的单克隆细胞株;1L Excel 301无血清培养液用Ni-NTA亲和层析纯化可以制备1.3 mg hFVII-LC+hIgG1-Fc融合蛋白,经ELISA法鉴定与TF具有高亲和力,免疫激活物与结肠癌细胞HT-29及NK细胞混合培养表现出明显的激活NK细胞的能力。结论成功构建了hFVII-LC+hIgG1-Fc融合蛋白的真核表达载体并获得了分泌hFVII-LC+hIgG1-Fc融合蛋白的CHO-K1单克隆细胞株,为制备以TF为靶点的肿瘤免疫治疗结合物奠定了基础。
肿瘤靶向治疗; 组织因子; 免疫结合物; CHO-K1细胞
组织因子(tissue factor,TF),是一个由263个氨基酸残基组成的跨膜单链糖蛋白,分子量约为47 kD。生理状态下组织因子位于血管壁外膜细胞,包绕血管的成纤维细胞、巨噬细胞、部分上皮细胞中,而在血管内皮细胞中无表达。临床上发现多种肿瘤有不同程度的TF过度表达,通过不同检测方法都证实在多种实体肿瘤细胞[1-2]、血液恶性肿瘤细胞[3]、肿瘤血管内皮细胞表面的表达均异常增高而正常组织、细胞和血管不表达,基于此,很多肿瘤学家认为TF是抗血管治疗的理想靶点。凝血因子VII(factor VII,FVII)是TF的天然配体,它们之间具有很高的亲和力,Hu等[4-5]利用此特性设计的免疫结合物(immunoconjugate, Icon),由2段FVII肽段和免疫球蛋白G1可结晶片段(immunoglobulin G1 fragment crystallizable,IgG1-Fc)构成,其中FVII肽段与靶细胞的相应配体TF结合,通过IgG1-Fc可与自然杀伤细胞(natural killer cells,NK cells)和补体C1q结合而激活NK细胞和补体级联反应而杀伤靶细胞,在肿瘤治疗上表现出显著的抗血管效应,因而被认为是一种较有开发前景的以TF为靶点的免疫治疗结合物。但Icon 是以完整的FVII分子作为TF的靶向,容易激发凝血系统的异常甚至诱发DIC。本研究中采用中国汉族人FVII轻链(light chain of human factor VII,hFVII-LC)和IgG1-Fc(hIgG1-Fc)构建新的以TF为靶点的真核表达载体并制备和纯化免疫结合物蛋白。
材 料 和 方 法
1试剂与细胞株
1.1材料 外周血10 mL(健康志愿者抽取)、正常肝组织(肝结石患者手术切取)、真核表达载体pcDNA3.1(+)质粒(Invitrogen)、DH5α菌株(TaKaRa)、CHO-K1(中国仓鼠卵巢细胞亚株,中国科学院细胞库)、HT-29细胞株、转染了CD16的NK92MI细胞(耶鲁大学胡志伟教授惠赠)。
1.2试剂 人淋巴细胞分离液和RNA提取试剂盒(Promega);PrtoScriptTMM-MuLV Taq RT-PCR Kit试剂盒(Biolabs);DNA胶回收试剂盒,BamH I、EcoR I和XhoI 内切酶,T4 DNA连接酶(NEB);LipofectamineTM2000(Invitrogen);Ni-NTA树脂和抗His标签蛋白(Novagen);抗TF抗体(R&D);Calcein-AM (Invitrogen)。
2方法
2.1引物设计与目的基因的扩增
2.1.1根据hFVII-LC cDNA、hIgG1-Fc cDNA序列及pcDNA3.1(+)质粒图谱,设计2对引物。引物由Invitrogen合成,hFVII-LC基因片段上游引物5′ -CGCGGATCCGCCACCATGGCCAACG CGTTCCTGGAGGAGCTG- 3′,下游引物5′- CCGGAATTCTCGGCCTTGGGGTTTGCTGGCATTTCT- 3′。hIgG1-Fc基因片段上游引物5′ -CCGGAATTCGCAGAGCCCAAATCTTGTGACAAAACT- 3′,下游引物5′-CCGCTCGAGTTATCAGTGGTGGTGGTGGTGGTGGTG-GTGTTTACCCGGAGACAGGGAGAG- 3′,在下游引物C端设计6×His标签蛋白。
2.1.2肝组织置于RNA保存液中,并于-80 ℃中保存。
2.1.3外周血B淋巴细胞培养 用淋巴细胞分离液分离外周血单个核细胞,用含10%胎牛血清和10%双抗的RPMI-1640并加入植物血凝素(0.1%,Sigma)10 μL,IL-2 1 000 U的完全培养基,于5%CO2、37 ℃恒温箱内培养4~6 d。
2.1.4采用RNA提取试剂盒(Promega)分别提取肝组织和淋巴细胞总RNA。操作方法按说明书进行。紫外分光光度计测定RNA含量与纯度。PrtoScriptTMM-MuLV Taq RT-PCR Kit试剂盒逆转录合成互补DNA第1链,反应条件:1 μg肝组织总RNA、50 μmol/L dT23VN 2 μL和dNTP Mix 2 μL混匀,DEPC水调整至总体积16 μL,70 ℃水浴5 min后加入10×RT buffer 2 μL、RNase inhibitor 1 μL和M-MuLV逆转录酶1 μL,42 ℃水浴1 h,90 ℃水浴5 min灭活逆转录酶,DEPC水调整产物浓度至总体积50 μL。PCR反应体系:Taq2×Master Mix 25 μL,上游引物 10 μmol/L 1 μL,下游引物10 μmol/L 1 μL,cDNA产物5 μL,DEPC水18 μL。反应条件:95 ℃预变性2 min;94 ℃ 30 s,55 ℃ 30 s,68 ℃ 60 s,共35个循环;72 ℃ 8 min终止反应。hFVII-LC PCR产物经琼脂糖凝胶电泳鉴定。用同样的方法对淋巴细胞总RNA进行RT-PCR反应,获得hIgG1-Fc基因PCR产物。
2.2pcDNA3.1(+)-hFVII-LC+hIgG1-Fc重组真核表达载体的构建及鉴定 用BamH I和EcoR I分别双酶切hFVII-LC PCR扩增产物和pcDNA3.1(+)质粒,1%琼脂糖凝胶电泳,用DNA凝胶回收试剂盒回收目的片段,于37 ℃在T4 DNA连接酶作用下连接1 h,然后转化DH5α感受态细胞,筛选Amp抗性克隆,用PCR、双酶切及测序方法鉴定阳性克隆pcDNA3.1(+)-hFVII-LC,用同样的方法及EcoR I、XhoI内切酶构建pcDNA3.1(+)-hFVII-LC+hIgG1-Fc 最后酶切及测序方法鉴定阳性克隆。重组表达载体构建流程见图1。
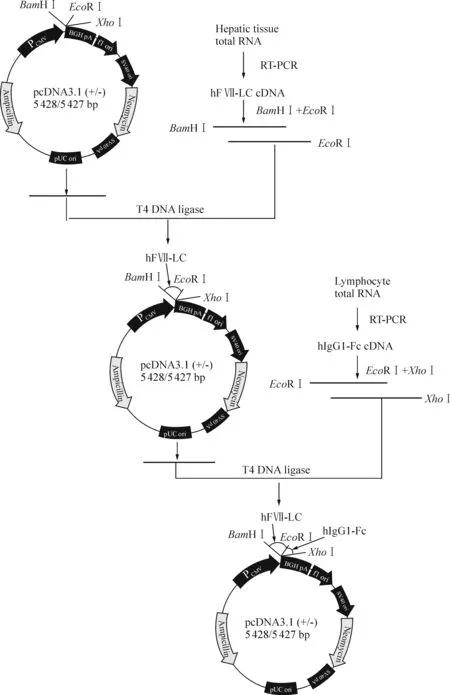
Figure 1. The construction of a recombinant eukaryotic expression vector pcDNA3.1(+)-hFVII-LC+hIgG1-Fc.
图1质粒构建流程图
2.3细胞转染和阳性克隆筛选 参照LipofectamineTM2000(Invitrogen)说明书,将pcDNA3.1(+)-hFVII-LC+hIgG1-Fc和pcDNA3.1(+)质粒转染中国仓鼠卵巢细胞亚株CHO-K1中,48 h后将转染细胞按1∶10传代,继续培养24 h,换含G418(Invitrogen) 1 g/L的F12培养基筛选2周。挑取单细胞阳性克隆继续在含G418 500 mg/L的培养基中扩大培养。转染后两种细胞分别命名为CHO-K1-hFVII-LC+hIgG1-Fc和CHO-K1空细胞。
2.4用半定量RT-PCR鉴定转染是否成功 收获对数生长期的CHO-K1-hFVII-LC+hIgG1-Fc和CHO-K1细胞,采用RNA提取试剂盒分别抽提2种细胞总RNA(Promega)。用M-MuLV逆转录酶制备cDNA,取cDNA进行PCR扩增。hFVII-LC基因片段引物同上,hFVII-LC+hIgG1-Fc重组基因片段上游引物5′-CGCGGATCCGCCACCATGGCCAACGCGTTCCTGGAGGAGCTG- 3′,下游引物5′ -CCGCTCGAGTTATCAGTGGTGGTGGTGGTGGTGTTT-ACCCGGAGACAGGGAGAG- 3′。GAPDH(内参照)上游引物5′ -TGCATCCTGCACCAACT- 3′,下游引物5′ -CGCCTGCTTCACCACCTTC- 3′。扩增条件为:95 ℃ 2 min,94 ℃ 30 s,55 ℃ 30 s,68 ℃ 60 s,共35个循环;72 ℃ 8 min。
2.5生成、纯化和鉴定hFVII-LC+hIgG1-Fc蛋白
2.5.1G418筛选出的CHO-K1单细胞克隆转入175 cm2细胞培养瓶中用含10%胎牛血清和500 mg/L G418的F12培养基培养至细胞融合度达90%时,弃培养基,用PBS洗3次然后换入不含胎牛血清CHO-K1 Excel 301(JRH Biosciences)培养基并添加维生素K1使终浓度达1 mg/L。无血清细胞培养基每个星期收集2次。收集的培养基于-20 ℃中冻存。
2.5.2hFVII-LC+hIgG1-Fc蛋白使用Ni-NTA树脂(Novagen)纯化,并使用离心过滤管(MWCO 10 000 Milipore)浓缩蛋白。通过亲和层析纯化的hFVII-LC+hIgG1-Fc蛋白经过SDS-PAGE蛋白胶检测其纯度及分子量大小。提纯的蛋白于-20 ℃保存。
2.5.3纯化后蛋白,BCA法测蛋白浓度。样品加入5×蛋白上样缓冲液混合后煮沸5 min,取20 μL上样进行SDS-PAGE电泳;电泳后将蛋白转移至PVDF膜,5%脱脂奶粉封闭;随后加入鼠抗人His抗体(Novagen),4 ℃孵育过夜;加辣根过氧化物酶(HRP)标记的Ⅱ抗,作用1 h,用TBST洗3次,每次10 min,然后用ECL显色液显色,并进行曝光显影。
2.6hFVII-LC+hIgG1-Fc融合蛋白与TF亲和力检测 以1.25 mg/L TF包被酶标板(100 μL/well),4℃湿盒包被过夜,第2 d 200 μL/well PBSM(PBS + 2%脱脂奶粉)37 ℃静置封闭1 h,0.05%PBST(PBS+0.05% Tween 20)洗3次。加入0、0.01、0.1、1和10 mg/L hFVII-LC+hIgG1-Fc,及抗TF抗体(R&D)1 mg/L,各100 μL,30 r/min结合1 h。0.05%PBST洗3次,于各样品孔和阴性对照孔中加入鼠抗人IgG1-Fc-HRP(Vector) 100 μL 0.4 mg/L, 30 r/min结合1 h。0.05%PBST洗3次,50 μL/well TMB避光显色20 min,50 μL/well 2 mol/L H2SO4终止,450 nm/630 nm读A值。
2.7hFVII-LC+hIgG1-Fc融合蛋白激活NK细胞对HT-29细胞的影响 Calcein-AM的乙酸甲基脂亲酯性很高,使其可以透过细胞膜,calcein-AM本身并无荧光,但在进入细胞后被酯酶水解成绿色荧光素calcein并滞留于细胞膜完整的细胞内。如细胞膜损伤的细胞,如在ADCC(antibody-dependent cell cytotoxicity)时,calcein释出而被检测[6]。 HT-29细胞96孔板体外完全培养基培养,当细胞浓度生长至1×104时用于实验。方法如下:预温的不含钙1×HBSS洗细胞1次,加50 μL 8 μmol/L calcein-AM ,37 ℃孵育40 min。 不含钙HBSS液洗细胞1次,加入0 mg/L、1 mg/L和10 mg/L hFVII-LC+hIgG1-Fc融合蛋白(含钙的HBSS 含5 mmol/L CaCl2稀释),加入转染了CD16的NK细胞(人源性钮扣细胞,由耶鲁大学癌症中心胡志伟教授惠赠)作为效应细胞至总体积200 μL HBSS液, 37 ℃ 孵育4 h。另设一空白孔不加NK细胞及提纯蛋白,余步骤同前,并于该孔加裂解液20 μL (9% Triton X-100溶解于双蒸水) 裂解细胞,孵育45 min。离心后每孔取上清100 μL 至新的96孔板作荧光分光光度计检测,荧光的激发和发射波长分别为490和515 nm。ADCC效应评价公式:hFVII-LC+hIgG1-Fc融合蛋白组荧光值/空白孔荧光值(最大荧光标记值)×100%。
3统计学处理
结 果
1pcDNA3.1(+)-hFVII-LC+hIgG1-Fc真核表达载体的构建
使用特异引物进行RT-PCR,从肝组织和淋巴细胞中扩增得到目的基因片段,将其插入pcDNA3.1(+)真核表达载体,构建成pcDNA3.1(+)-hFVII-LC+hIgG1-Fc重组载体。经BamH I、EcoR I和XhoI三酶切,可见约5.4 kb、696 bp和456 bp大小的3条带,分别为酶切后的载体片段及2条目的片段,见图2。将pcDNA3.1(+)-hFVII-LC+hIgG1-Fc阳性重组子进行DNA测序,测序结果与GenBank中的hFVII-LC和hIgG1-Fc序列完全吻合,且带有编码6×His标签蛋白序列,见图3。说明pcDNA3.1(+)-hFVII-LC+hIgG1-Fc真核表达载体构建成功。

Figure 2. Enzyme digestion identification of the recombinant eukaryotic expression vector pcDNA3.1(+)-hFVII-LC+hIgG1-Fc. M:100~6 000 bp marker; 1: hFVII-LC ; 2: hIgG1-Fc ; 3:pcDNA3.1(+)- hFVII-LC+hIgG1-Fc plasmid without digestion; 4~5: pcDNA3.1(+)-hFVII-LC+hIgG1-Fc plasmid digested byBamH I,EcoR I andXhoI.
图2重组真核表达载体pcDNA3.1(+)-hFVII-LC+hIgG1-Fc的酶切鉴定
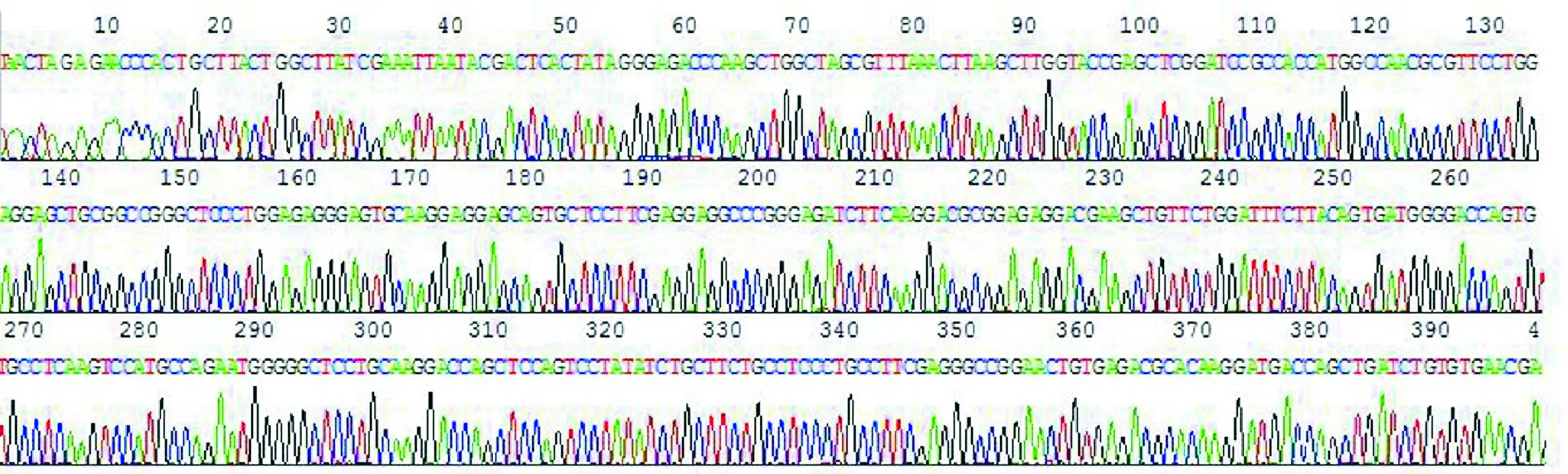
Figure 3. Partial Chromas figure of recombinant eukaryotic expression vector pcDNA3.1(+)-hFVII-LC+hIgG1-Fc.
图3质粒测序图
2RT-PCR检测hFVII-LC+hIgG1-FcmRNA的表达
对CHO-K1-hFVII-LC+hIgG1-Fc细胞的总RNA进行RT-PCR扩增,结果扩增出大小为456 bp的hFVII-LC条带、大小为1 152 bp的hFVII-LC+hIgG1-Fc条带以及大小为327 bp的GAPDH条带,见图4。在相同RT-PCR扩增条件及加样量下,同步转染空质粒CHO-K1细胞无特异目的条带。
3SDS-PAGE凝胶检测通过Ni-NTA树脂纯化后蛋白的纯度和分子量大小
收集的无血清培养基经过Ni-NTA树脂纯化后得到较纯的目的蛋白分子量大小为55~70 kD之间。经Western blotting检测纯化后的蛋白带有His标签蛋白,见图5。
4ELISA检测hFVII-LC+hIgG1-Fc蛋白与TF的亲和力
检测5个不同稀释度(0、0.01、0.1、1和10 mg/L)的hFVII-LC+hIgG1-Fc与TF的结合能力,在450 nm/630 nm双波长下分别测定其A值,各平行对照孔的平均值分别为0.091、0.283、0.385、0.464和0.765。A值越大说明合成的免疫结合物与TF的结合能力越强,故以上结果提示免疫结合物与TF有亲和力,且呈剂量依赖性,见图6。
5hFVII-LC+hIgG1-Fc融合蛋白激活NK细胞对HT-29细胞的影响
加0 mg/L hFVII-LC+hIgG1-Fc蛋白组细胞ADCC效应比例为9.60%±0.25%,1 mg/L和10 mg/L hFVII-LC+hIgG1-Fc蛋白对人结直肠癌的ADCC效应分别为47.20%±0.81%和69.60%±0.42%,ADCC效应在1 mg/L组、10 mg/L组与0 mg/L组比较均有显著差异(P<0.05),在0~10 mg/L范围内呈剂量依赖关系,见图7。
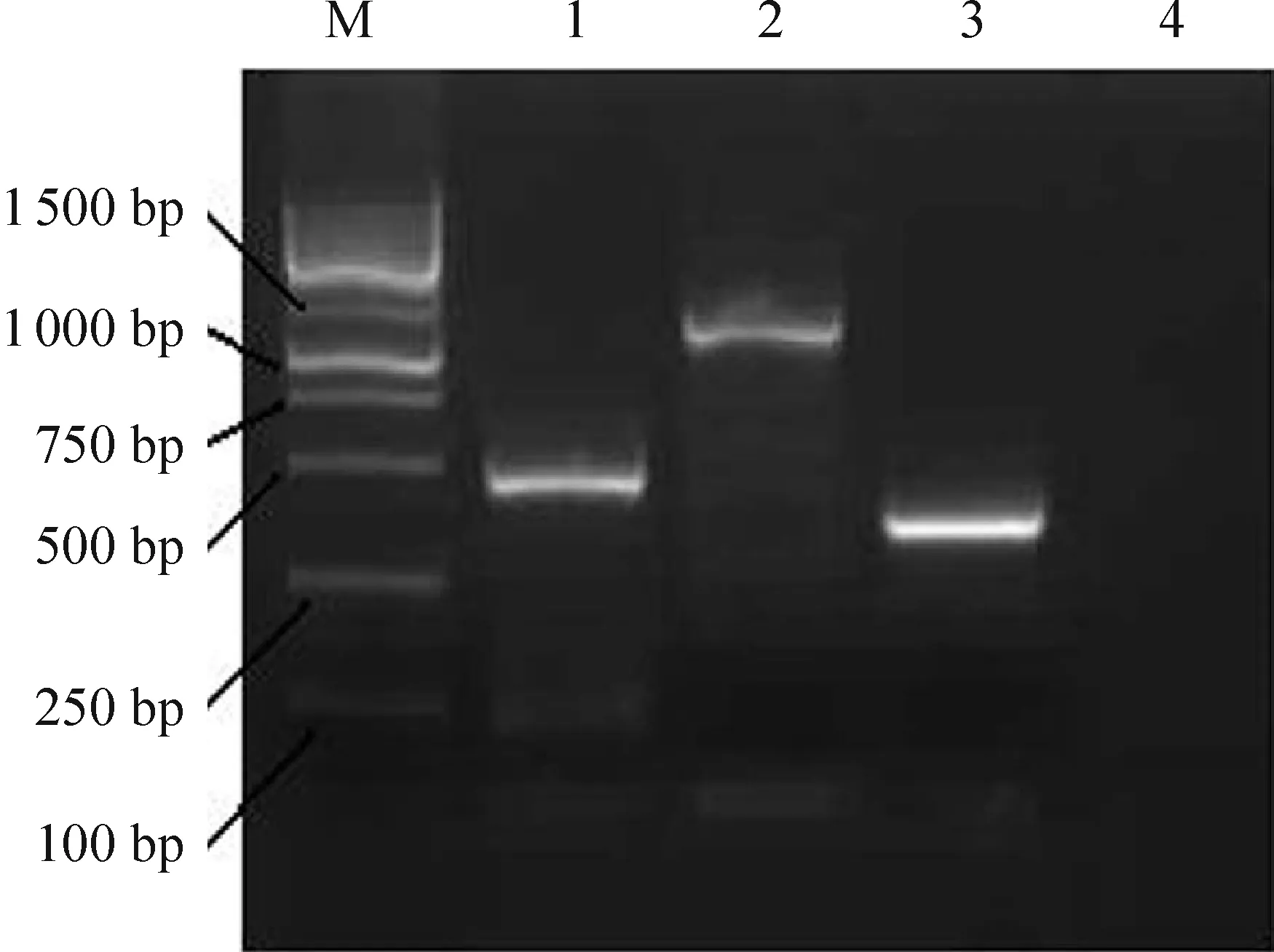
Figure 4. The RT-PCR for hFVII-LC+hIgG1-Fc. M:100~6 000 bp ladder marker; 1: hFVII-LC; 2: hFVII+hIgG1-Fc; 3:GAPDH; 4:negative control.
图4RT-PCR检测转染后CHO-K1细胞hFVII-LC+hIgG1-FcmRNA的表达
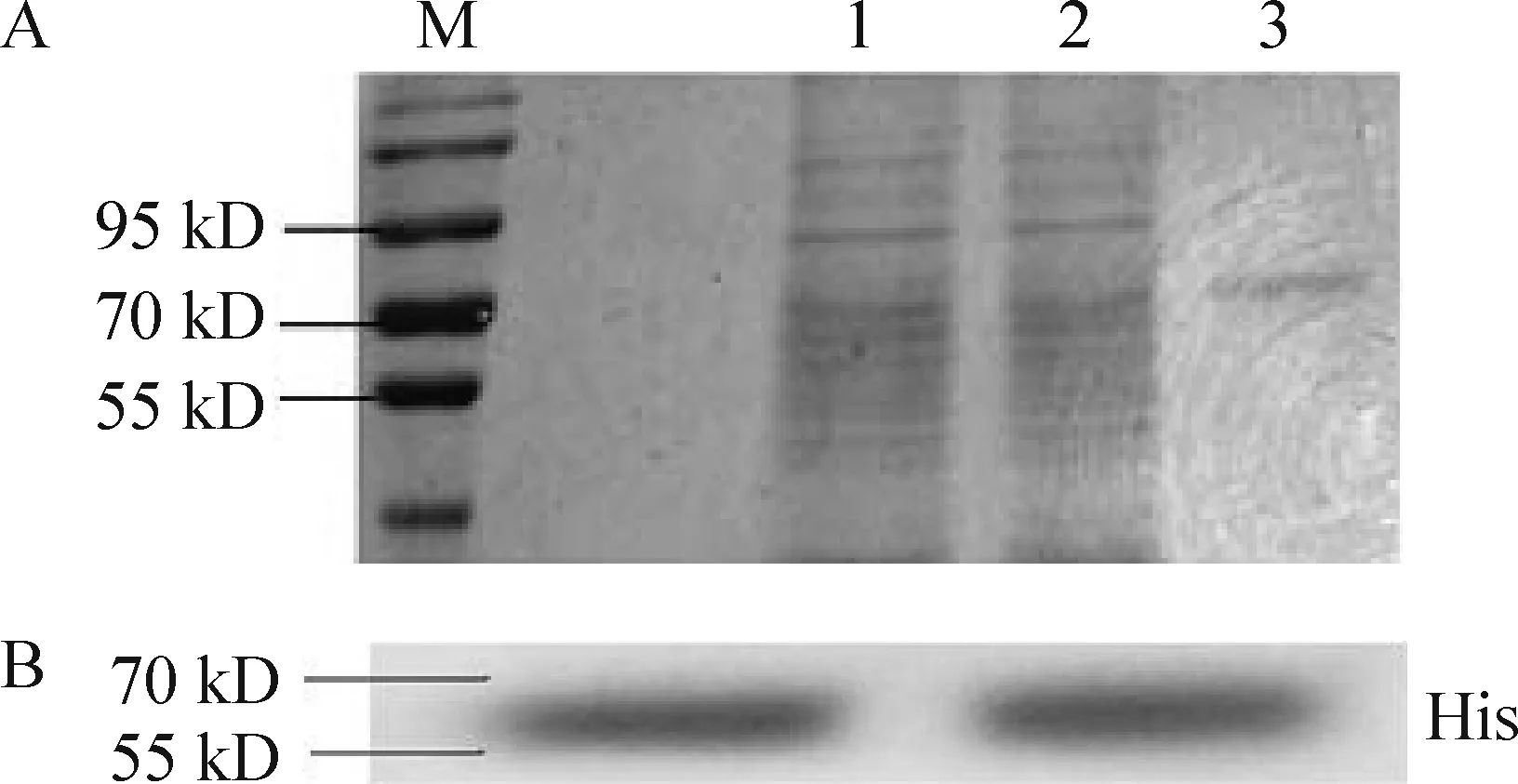
Figure 5. Protein purification and detection. A:Ni-NTA affinity chromatography. M:protein markers,10~170 kD; 1:collected serum-free medium; 2:flow-through; 3:eluate(target protein).B:His-tag Western blotting.
图5蛋白纯化和检测
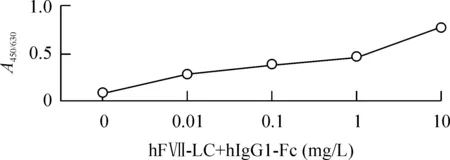
Figure 6. The immunoconjugate identified by ELISA on tissue factor (TF) affinity and specificity.
图6ELISA检测hFVII-LC+hIgG1-Fc蛋白与TF的亲和力
讨 论
越来越多的研究显示TF在多种肿瘤细胞上的特异性表达与肿瘤的发生、发展有着密切的联系,其诱导的凝血级联反应及与之相关的信号途径等机制与促进肿瘤血管形成、肿瘤转移和肿瘤生长有关[7],更有学者提出组织因子与肿瘤干细胞是否存在联系[8-9],即TF有可能是肿瘤干细胞表面标志物。许多针对TF在肿瘤细胞上特异性表达的靶向治疗如siRNA干扰肿瘤细胞TF的表达[10],或者使用组织因子特异性抗体如重组线虫抗凝蛋白c2(rNAPc2)[11]和Versteeg等[12]阻断组织因子的信号转导途径等在动物实验中都表现出肿瘤抑制作用。以TF为靶点的肿瘤靶向治疗免疫交联物hFVII-LC+hIgG1-Fc不仅可以破坏癌细胞,亦可以针对肿瘤所依赖的供应血管从而防止肿瘤的进一步生长。Hu等[4-5]设计的抗体类似物,由编码点突变(K341A)hFVII和IgG1-Fc构成的Icon在应用于包括黑色素瘤、前列腺癌和乳腺癌等动物模型上时表现出显著效果,使移植瘤消退,但是,动物实验表现出该结合物对小鼠的凝血功能有一定影响。FVII属于丝氨酸蛋白激酶家族成员,晶体结构分析发现,FVII由轻链和重链组成,轻链中EGF和Gla区都与其与TF紧密结合有关,而重链则与凝血反应有关[13]。作为靶向治疗,靶向片段的靶向性与其分子量大小和稳定性有重要联系,利用TF的天然配基FVII中与TF紧密结合且不引起凝血功能异常的片段FVII-LC构成的靶向治疗免疫结合物,能达到靶向治疗的目的且减少引起凝血功能异常的危险。并且有研究发现中国汉族人的IgG-Fc基因与基因库比较存在2个基因碱基的差异,且CH3区编码的氨基酸不同[14]。我们之前设计的hFVII-LC+hIgG1-Fc腺病毒载体,治疗结直肠癌小鼠模型体内产生的hFVII-LC+hIgG1-Fc蛋白表现出与TF的亲和力与hFVII一样,且远高于TF的单克隆抗体。因而我们合成的新hFVII-LC+hIgG1-Fc免疫交联物有如下特点:(1)为研究不引起机体凝血异常的以TF为靶点的肿瘤治疗免疫结合物提供基础。(2)hFVII-LC解决了点突变FVII分子量太大不适合于基因干预治疗的问题。(3)使用提纯蛋白作为药物可减少以腺病毒为载体在动物实验中表现出来的肝损伤。(4)对研究 IgG效应片段基因差异是否会影响IgG对疾病的免疫反应性提供对比物。通过引物设计加入6×His标签蛋白,利于蛋白的纯化和检测,因6×His很小,在生理pH值下较稳定,因此不改变重组蛋白的折叠结构和生化特性,对蛋白功能几乎没有影响值。(5)hFVII-LC+hIgG1-Fc免疫交联物在体外实验中,对结直肠癌细胞HT-29细胞株ADCC效应与对照组相比表现出显著差异性,且ADCC效应在0~10 mg/L范围内呈剂量依赖关系。
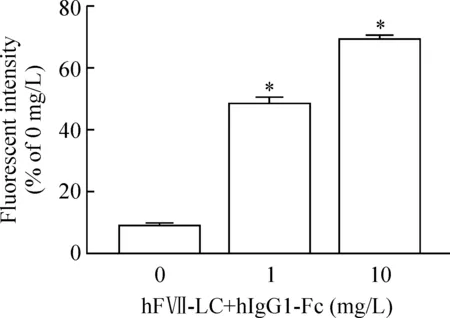

图7hFVII-LC+hIgG1-Fc蛋白与NK细胞混合培养对HT-29细胞的杀伤作用
本研究成功构建了免疫交联蛋白hFVII+hIgG1-Fc的真核表达载体,并获得相关蛋白,今后我们将验证其体外与体内的肿瘤治疗效果。
[1] Callander NS, Varki N,Rao LV. Immunohistochemical identification of tissue factor in solid tumors [J]. Cancer, 1992, 70 (5):1194-1201.
[2] Rao B, Gao Y, Huang J, et al. Mutations ofp53 andK-rascorrelate TF expression in human colorectal carcinomas: TF downregulation as a marker of poor prognosis [J]. Int J Colorectal Dis, 2011, 26 (5):593-601.
[3] Lopez-Pedrera C, Barbarroja N, Dorado G, et al. Tissue factor as an effector of angiogenesis and tumor progression in hematological malignancies [J]. Leukemia, 2006, 20 (8):1331-1340.
[4] Hu Z, Sun Y,Garen A. Targeting tumor vasculature endothelial cells and tumor cells for immunotherapy of human melanoma in a mouse xenograft model [J]. Proc Natl Acad Sci U S A, 1999, 96 (14):8161-8166.
[5] Hu Z,Garen A. Intratumoral injection of adenoviral vectors encoding tumor-targeted immunoconjugates for cancer immunotherapy [J]. Proc Natl Acad Sci U S A, 2000, 97 (16):9221-9225.
[6] Golay J, Cortiana C, Manganini M, et al. The sensitivity of acute lymphoblastic leukemia cells carrying the t(12;21) translocation to campath-1H-mediated cell lysis [J]. Haematologica, 2006, 91 (3):322-330.
[7] Kasthuri RS, Taubman MB,Mackman N. Role of tissue factor in cancer [J]. J Clin Oncol, 2009, 27 (29):4834-4838.
[8] Milsom C, Magnus N, Meehan B, et al. Tissue factor and cancer stem cells: is there a linkage? [J]. Arterioscler Thromb Vasc Biol, 2009, 29 (12):2005-2014.
[9] Milsom C, Yu J, May L, et al. The role of tumor-and host-related tissue factor pools in oncogene-driven tumor progression [J]. Thromb Res, 2007, 120(Suppl 2):S82-S91.
[10]Nitori N, Ino Y, Nakanishi Y, et al. Prognostic significance of tissue factor in pancreatic ductal adenocarcinoma [J]. Clin Cancer Res, 2005, 11 (7):2531-2539.
[11]Zhao J, Aguilar G, Palencia S, et al. rNAPc2 inhibits colorectal cancer in mice through tissue factor [J]. Clin Cancer Res, 2009, 15 (1):208-216.
[12]Versteeg HH, Schaffner F, Kerver M, et al. Inhibition of tissue factor signaling suppresses tumor growth [J]. Blood, 2008, 111 (1):190-199.
[13]Wildgoose P, Kazim AL,Kisiel W. The importance of residues 195-206 of human blood clotting factor VII in the interaction of factor VII with tissue factor [J]. Proc Natl Acad Sci U S A, 1990, 87 (18):7290-7294.
[14]饶本强, 高晓燕, 王 磊, 等. 汉族人免疫球蛋白G效应片段基因特征性分析 [J]. 中国病理生理杂志, 2010,26(6):1214-1216.
Constructionofanimmunoconjugatetargetingtissuefactoranditseffectoncolorectalcancercells
XU Xi1, RAO Ben-qiang2, LIANG Qi-wen2, LIU Dan1, TAN Huo1, WANG Jian-ping2, HUANG Zhen-qian1
(1TumorBloodCenter,FirstAffiliatedHospital,GuangzhouMedicalCollege,Guangzhou510230,China;2TheSixthAffiliatedHospital,SunYat-senUniversity,Guangzhou510655,China.E-mail:huangzq2003@yahoo.com.cn)
AIM: To construct a recombinant eukaryotic expression vector pcDNA3.1(+)-hFVII-LC+hIgG1-Fc, and to produce and purify the immunoconjugate hFVII-LC+hIgG1-Fc protein.METHODSThe target sequences were amplified by RT-PCR from hepatic tissue and lymphocyte RNA, and cloned into eukaryotic expression vector pcDNA3.1(+). After confirmed by restriction endonuclease digestion and DNA sequencing, the recombinant plasmid was transfected into CHO-K1 cells by lipofectamine 2000. The transfectant clones were selected by G418 screening. The positive monoclonals were grown in CHO-K1 serum-free medium Excel 301 and the culture medium was collected. The hFVII-LC+hIgG1-Fc protein was purified by affinity Ni-NTA resin. The immunoconjugate was identified by ELISA with tissue factor (TF) affinity and specificity. Induction of NK cell-mediated antibody-dependent cell cytotoxicity(ADCC) was examined in HT-29 colorectal cancer cell line.RESULTSHuman liver tissue and lymphocytes from Han population were used as template for amplification of hFVII-LC and hIgG1-Fc DNA fragments, which were confirmed by sequencing and were exactly the same as those GenBank reported. The eukaryotic expression vector pcDNA3.1(+)-hFVII-LC+hIgG1-Fc was successfully constructed, and 1.3 mg of hFVII-LC+hIgG1-Fc protein could be prepared from 1 liter of Excel 301 serum-free culture medium through Ni-NTA affinity chromatography. The immunoconjugate was specially bound to TF and induced a significant ADCC response in HT-29 cells.CONCLUSIONThe human hFVII-LC+hIgG1-Fc recombinant plasmid and the hFVII-LC+hIgG1-Fc immunoconjugate are obtained, which provide the basis for further study of cancer-targeted therapy.
Tumor targeted therapy; Tissue factor; Immunoconjugate; CHO-K1 cells
R363
A
10.3969/j.issn.1000-4718.2012.03.007
