超声与CTA在大动脉瘤诊断中的应用价值
2012-11-05王志远石卫东刘美含陈恩琪
王志远,石卫东,刘美含,陈恩琪,姜 微
(吉林大学中日联谊医院 超声科,吉林 长春130033)
大动脉瘤的影像检查有超声、CTA、MRA、DSA等方法。由于MRA检查费用较高、检查时间长且要求患者严格制动,DSA检查费用高且属有创、并有一定的禁忌症,故临床对动脉瘤的诊断通常采用超声及CTA检查[1]。目前,国内外在超声及CTA对大动脉瘤的临床应用方面的研究较多,但大多针对一种影像学特点进行分析研究,或对单一动脉瘤的多种影像学诊断方法进行研究[2],而对三种大动脉瘤在这两种检查的对比分析研究较少。本文对比彩色多普勒超声及CTA的大动脉瘤检查结果,分析两者在动脉瘤诊断中的优势及限度,探讨两种方法在临床上的应用价值。
1 资料与方法
1.1 一般资料 选取我院2009年1月至2011年1月住院的7例大动脉瘤患者,术前均采用超声和CTA检查,全部通过手术证实。临床诊断假性动脉瘤2例,真性动脉瘤2例,主动脉夹层(亦称夹层动脉瘤)3例。其中,男性4例,女性3例(男女比例,4:3),年龄32-66岁,平均54岁。
1.2 仪器与方法
超声检查:使用PHILIPS IU22彩色多普勒成像仪,分别采用3.5MHz探头探查深部血管,10 MHz探头检查四肢血管。采用适当的取样容积、壁滤波、脉冲重复频率,声束与血流方向的夹角小于60度,观察不同类型的动脉瘤的二维及彩色多普勒表现。患者取恰当的体位,沿相应血管走行区进行纵、横切面扫查。二维切面观察瘤体大小及形态、瘤颈、瘤壁有无搏动、血管内有无夹层剥离及附壁血栓或斑块、与邻近重要血管的关系及距离、动脉瘤体对周围组织有无压迫等。CDFI:显示瘤体内血流速度、性质、方向及色彩。假性动脉瘤应明确来源动脉。主动脉夹层时,识别真腔和假腔,寻找破口,测量血流速度,并注意频谱时相,探查其分支血管供血来源于真腔还是假腔。
CTA检查:Philips Brilliance 64排CT扫描机,首先行肘静脉穿刺建立经脉通道,患者平卧扫描正位及侧位定位像,扫描范围为上下均大于考虑动脉瘤范围10cm,扫描方向为头足向。采用双筒高压注射器,对比剂用量约每千克体重1ml,速度4.0 ml/s,另一注射生理盐水30-40ml,速度3.0ml/s,全部注射时间共计30s-32.5s,采用 Bolus Tracking,设定触发阈值为100HU。扫描参数:电压120KV,电流300mA,扫描旋转速度0.5s/rot,准直器宽度:64mm×0.625mm,螺距:0.704,总扫描时间12-14s。扫描完成后进行回顾性重建原始数据:层后0.8mm,层间隔0.6mm,矩阵512×512,DFOV为350mm,重建数据传入工作站上进行后处理重建。重建方法包括容积显示、最大密度投影、多平面重组等,同时结合原始横断面图像进行分析。
2 结果
7例大动脉瘤患者中,假性动脉瘤2例,2例真性动脉瘤,3例主动脉夹层(见表1)。

表1 7例大动脉瘤患者超声与CTA正确诊断例数对照
2例假性动脉瘤,超声表现为主动脉一侧的囊性低回声,周边包膜强回声,与主动脉相连,CDFI:来源于主动脉的血流呈“双期双相”改变。CTA显示主动脉旁的囊状突起,以宽基底与主动脉相连,周围低密度环绕(见图1)。2例真性动脉瘤,超声表现为动脉局部瘤样扩张,瘤壁与相邻动脉壁相延续,瘤体内可见附壁血栓;CDFI:瘤体内呈低速涡流血流信号(见图2)。CTA均显示动脉局部管腔瘤样扩张,管腔内径增宽,瘤体内可见附壁血栓。
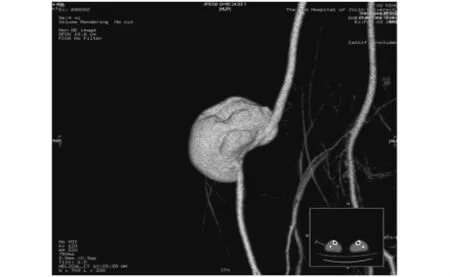
图1 腘动脉假性动脉瘤CTA重建图像
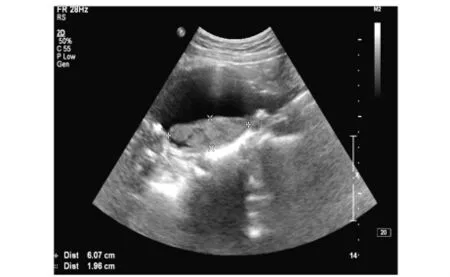
图2 腹主动脉真性动脉瘤超声图像
主动脉夹层,超声2例明确诊断,1例高度怀疑(仅显示动脉增宽及局部附壁血栓、但未探及明确膜样回声)。CTA检查中3例均明确诊断,提示内膜破口位置及夹层的累及范围(超声及CTA特征性表现检出情况见表2、表3)。

表2 7例大动脉瘤患者超声特殊表现检出情况
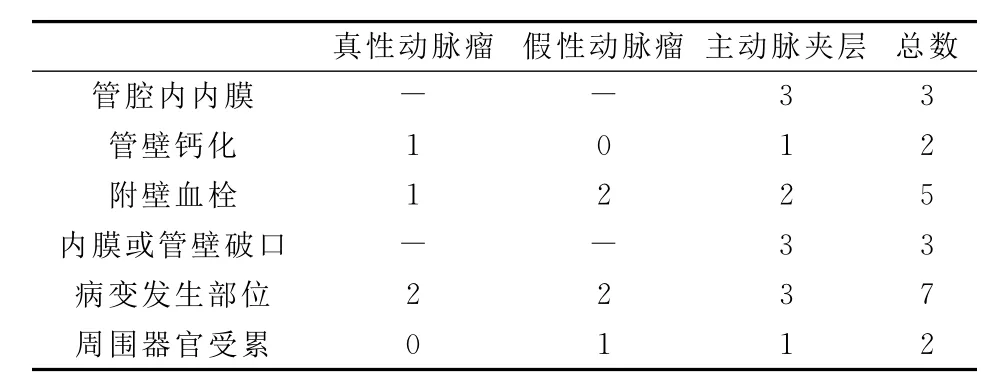
表3 7例大动脉瘤患者CTA特殊表现检出情况
7例大动脉瘤中有1例假性动脉瘤手术证实来源动脉为髂总动脉,超声提示来源于腹主动脉下段。手术所见7例大动脉瘤管壁上4例可见钙化,超声检查均显示,CTA仅2例提示管壁钙化。
3 讨论
3.1 大动脉瘤的超声与CTA表现
3.1.1 真性动脉瘤超声与CTA表现 超声检查,二维图像显示病变的动脉段呈梭形或囊状膨大,瘤壁与动脉壁的三层结构一致,并且相连续,扩张的动脉段外径为近端或远端正常动脉外径的1.5倍以上,瘤壁内膜增厚、毛糙、伴有斑块,瘤腔内常可见低回声或中等回声的附壁血栓及钙化。CDFI:于扩张的动脉段内探及紊乱血流信号,紊乱程度与动脉扩张大小呈正比,在明显扩张的动脉瘤中,还可看到涡流。
CTA检查,动脉管径呈不规则扩张,边缘清楚,瘤体与动脉密度一致,其内瘤壁呈不均匀增厚。
3.1.2 假性动脉瘤超声与CTA表现 超声检查,二维图像显示动脉旁无回声或混合回声区;CDFI:瘤腔内血流缓慢或呈涡流,有时表现为半红半蓝的旋转血流信号,若能清晰显示瘤颈部或破裂口则在破裂口或瘤颈部常能探及特征性“双期双相”血流频谱。当压迫瘤体近侧来源动脉时,瘤体可缩小,瘤体的搏动性也明显减弱,瘤颈部和瘤腔内血液流速减低[3]。
CTA检查,假性动脉瘤主要表现为扩张的囊腔,与相邻动脉同步同程度强化,囊腔内可有血栓形成;可显示母体血管通向瘤体的破口,以及通过瘤体密度变化反映出血液动力学改变;增强扫描早期,瘤体多显影浅淡,稍后瘤体明显强化与动脉密度接近,随后动脉密度下降,而瘤体密度减低迟于动脉。如果破口较大,瘤体密度改变可与动脉同步。
3.1.3 主动脉夹层超声与CTA表现 超声检查,二维图像显示受累动脉内膜分离,分离的内膜呈线状回声,将血管分隔成真、假两腔,当假腔内有血栓形成时,内部有实性回声,内膜贴附于血栓表面,急性期常见分离的内膜随心动周期不停地摆动,慢性期分离的内膜较固定。CDFI可显示同一动脉管腔内血流被分离的内膜和血栓分开,同一条动脉同一水平存在两种不同性质的血流,分别代表真、假腔血流。
CTA检查可显示主动脉内膜钙化内移,一半内移5mm以上,此征象具有诊断价值,一般情况下,病变部位越广泛,假腔越大;增强后,真、假两腔可同时显影,真腔因血流速度快,密度往往较假腔高;CT增强扫描能较清晰显示撕裂内膜片[4],CT横断图像上呈弯曲的线状低密度影。
3.2 超声与CTA对大动脉瘤诊断的优势及限度
3.2.1 CTA对大动脉瘤位置诊断的准确性优于超声检查 CTA可将病变的血管强化,其后期强大的软件功能及丰富的后处理技术[5]可逼真地显示动脉瘤的部位、与周围结构的毗邻关系,能正确的对动脉瘤进行定位,尤其对假性动脉瘤的来源动脉可明确诊断。本组有1例超声提示腹主动脉假性动脉瘤,CTA诊断为右髂总动脉瘤,后经手术证实为右侧髂总动脉假性动脉瘤。
超声可对病变位置直接扫查,方便、无创,可兼顾病变以外的其他部位。但分辨率相对较低,图像不够直观,缺乏整体性;尤其对于腹部血管,因受肠气干扰较重,或动脉瘤与相邻的正常动脉有重叠时,其动脉瘤位置判定的准确率相应受影响。
3.2.2 超声对真性动脉瘤与假性动脉瘤区分优于CTA 彩色多普勒超声可以实时显示血流动力学变化,可明确血流方向、速度,明确假性动脉瘤的瘤颈及破口位置,进而明确区分真性动脉瘤及假性动脉瘤。CTA因其不能动态显像,对于带有不对称附壁血栓的真性动脉瘤很容易与假性动脉瘤相混淆。
3.2.3 CTA对主动夹层的确诊优于超声检查CTA对主动脉夹层动脉瘤成像有其独特的优越性[6]。夹层动脉瘤常累及胸主动脉及腹主动脉,CTA可不受胸骨及肺气、肠气的影响,对病变血管直接观察;CTA对夹层动脉瘤的真腔和假腔的血流灌注情况、血管内膜剥离长度和范围均显示理想;可观察病变血管供血器官的受累情况,是真腔供血还是假腔供血。彩色多普勒超声对血流较为敏感,但其受影响因素较多,如病变部位、声束及血流方向等,有一定的漏诊率;超声检查有时不能显示夹层的全貌或全程,对破裂口及隔膜的显示有一定的局限性;特别对于假腔内血栓较多,血流速度缓慢,且肥胖,肺气、肠气较多的患者,CDFI的血流信号就更加不敏感。本组3例主动脉夹层中,1例彩超结果仅高度怀疑、但未得到明确诊断,另两例超声检查明确诊断、与CTA相符。
3.2.4 超声对管壁钙化诊断优于CTA 由于管壁钙化内部结构致密,与血管壁及邻近的软组织有明显的声阻抗差,可使超声波全反射,故在超声影像上显示为强回声。超声对于判断钙化及确定钙化在管壁上的位置具有较强的敏感度。而钙化在CTA现象中呈高密度,于造影剂的高密度难以区分,仅管壁钙化于造影剂间有低密度血栓存在时方可明确显示。真性动脉瘤及夹层动脉瘤常好发于中老年人,动脉硬化为病因者占多数,常伴随动脉管壁或动脉瘤管壁钙化,明确管壁有无钙化及钙化发生的位置对判定动脉瘤损害程度有一定提示作用。
3.2.5 超声在安全性等方面优于CTA 超声检查简便易行可兼顾其他部位的检查,价格便宜无创,避免射线照射,免除造影剂过敏的风险,对于儿童、孕妇都可采用;超声检查不要求患者绝对制动,对于儿童及意识障碍的患者有绝对的优势;由于超声检查在体表进行,对于病变的定位可以体表标志位参照点,对外科手术定位起到一定的辅助作用;超声检查还可反复操作,故可对病变治疗效果进行评估。
随着经食管超声心动图、动态三维超声及血管超声造影等新技术的不断发展,超声检查对动脉瘤的评价会更加完善[7]。Clevert等[8]认为,血管超声造影应用于腹部动脉检查时,可更清晰的显示动脉瘤瘤体的走行及瘤壁情况,实时动态观察并清晰显示血流是来源于主动脉夹层的真腔还是假腔,在某种程度上甚至可以部分代替CTA[9]。
[1]Yoo SM,Lee HY,White CS.MDCT evaluation of acute aortic syndrome[J].Radiol Clin North Am,2010,48(1):67.
[2]Hanley M,Zenzen WJ,Brown MD,et al.Comparing the Accuracy of Digital Subtraction Angiography,CT Angiographyand MR Angiography at Estimating the Volume of Cerebral Aneurysms[J].Interv Neuroradiol,2008,14(2):173.
[3]Chaikof EL,Shamberger RC,Brewser DC.Traumatic pseudoaneurysms of the abdominal aortal[J].J Trauma,1999,9(4):174.
[4]印隆林,杨志刚,陈加源,等.64层螺旋CT血管成像在主动脉夹层诊断中的临床价值[J].放射学实践,2012,27(4):404.
[5]Flohr Th,Stierstorfer K,Bruder H,et al.Image reconstruction and image quality evaluation for a 16-slice CT scanning[J].Med Phys,2003,30(5):832.
[6]Litmanovich D,Bankier AA,Cantin L,et al.CT and MRI in diseases of the aorta[J].AJR Am J Roentgenol,2009,193(4):928.
[7]Evangelista A,Carcia del Castillo H,Gonzalez Alujas T,et al.Diagnoisis of ascending aortic dissection by transesophageal echocardiography:utility of M-mode in recognizing artifacts[J].J Am Coll Cardiol,1996,27(1):102.
[8]Clevert DA,Sticke IM,Johnson T,et al.Imaging of aortic abonrmalities with contrast-enhanced ultrasound A pictorial comparison with CT[J].Eur Radio J,2007,17(11):2991.
[9]Clevert DA,Weckbach S,Kopp R,et al.Imaging of aortic lesions with color coded duplex sonography and contrast-enhanced ultrasound versus multislice computed tomography(MS-CT)angiography[J].Clin Hemorheol Microcirc,2008,40(4):267.
