变异链球菌乳酸脱氢酶与霍乱毒素B亚单位嵌合表达质粒的构建和表达
2012-11-05刘建国马欣荣吴家媛管晓燕
张 燕,刘建国,陈 筑,马欣荣,唐 琳,吴家媛,张 剑,管晓燕
(1.遵义医学院附属口腔医院,贵州遵义 563003;2.中国科学院成都分院生物研究所,四川成都6100413.滨州医学院附属医院口腔内科,山东滨州 256603)
变异链球菌(简称变链菌)是公认的主要致龋菌。变链菌利用乳酸脱氢酶(Lactate dehydrogenase,LDH)发酵碳水化合物产生酸性代谢物,导致生物膜环境pH值降低,是龋病发生的直接原因[1-2]。本研究采用分子生物学技术,将 LDH 编码基因ldh和免疫佐剂霍乱毒素B亚单位(CTB)编码基因ctxB克隆到原核表达载体pET32a(+)上,并诱导表达融合蛋白,为下一步构建含该嵌合基因的植物真核表达载体奠定基础。
1 材料和方法
1.1 材料
变链菌临床分离株(血清型C,四川大学口腔疾病研究国家重点实验室龋病研究室刘天佳教授惠赠);E.coli JM109(四川大学生命学院张义正教授惠赠);pET32a(+)(四川大学生命学院张仁怀博士惠赠);pBSK-ctxB(中国科学院上海生物化学研究所吴祥甫教授惠赠);E.coli BL21(Promega公司);细菌基因组DNA提取试剂盒、小量质粒提取试剂盒、PCR纯化试剂盒、DNA凝胶回收试剂盒(V-gene公司);DNA连接试剂盒、限制性内切酶KpnⅠ、SacⅠ、XhoⅠ(TaKaRa生命技术工程公司)。
1.2 方法
1.2.1 变链菌培养和基因组DNA的提取
37℃微需氧培养变链菌至饱和状态,以细菌基因组DNA提取试剂盒提取基因组DNA。
1.2.2 LDH 编码基因 ldh的获得
以基因组DNA为模板,根据GS-5全序列(GeneBank accession number M72545)设计引物扩增ldh。引物序列:p1:5'-GCG GGT ACC ATG ACT GCA ACT AAA CAA CA-3';p2:5'-GCA GAG CTC GGA TCC GCC GTT ACG AGC TGC AGC AAA T-3'。PCR反应体系:ddH2O 37.8 μL,10 × buffer 5 μL,dNTPs 4 μL,p11 μL,p21 μL,rTaq 0.2 μL,模板1 μL。共计50 μL。反应条件为:94℃预变性5 min,94℃变性30 s,58℃退火45 s;72℃延伸2 min;以上条件反应循环35次,72℃延伸7 min;4℃保存。5 μL PCR扩增产物进行10 g/L琼脂糖凝胶检测。使用PCR产物回收试剂盒回收全部产物。
1.2.3 质粒 pET-LDH 的构建
将目的基因ldh和载体pET32a(+)以KpnⅠ和SacⅠ双酶切后连接。体系如下:pET32a(+)双酶切纯化产物0.5 μL,目的基因双酶切纯化产物4.5 μL,ligation solutionⅠ5 μL,总体积 10 μL。混匀后16℃连接过夜。连接产物转化大肠杆菌感受态细胞。挑取阳性重组子提质粒酶切鉴定。
1.2.4 ctxB 基因的获得
以质粒pBSK-ctxB为模板,根据文献报道[2]设计引物扩增 ctxB,引物序列如下:p3:5’-GCG GAG CTC GGC TCT GGT GGC TCT GGA TCT ATT AAA TTA AAA TTT GGT GTT TT -3';p4:5'-GCC CTC GAG TTA ATT TGC CAT ACT AAT TG-3'。反应体系 ddH2O 37.8 μL,10 × buffer 5 μL,dNTPs 4 μL,p31 μL,p41 μL,rTaq 0.2 μL,模板 1 μL,共计50 μL。循环条件为:94℃预变性5 min;94℃变性45 s;58℃退火30 s;72℃延伸1 min;以上条件反应循环 35次,72℃延伸7 min,4℃保存。5 μL PCR扩增产物进行10 g/L琼脂糖凝胶检测。使用PCR产物回收试剂盒回收全部产物。
1.2.5 质粒 pET-LDH/CTB 的构建
将目的基因 ctxB和 pET-LDH以 SacⅠ和XhoⅠ双酶切后连接。体系如下:pET-LDH双酶切纯化产物 0.5 μL,目的基因双酶切纯化产物4.5 μL,ligation solutionⅠ 5 μL,总体积 10 μL。混匀后16℃连接过夜,连接产物转化大肠杆菌感受态细胞。挑取阳性重组子提质粒酶切鉴定。质粒pET-LDH/CTB送上海联合基因公司对插入基因进行序列测定。
1.2.6 诱导表达
质粒 pET-LDH/CTB转化 E.coli BL2l(DE3),加入IPTG,37℃诱导4 h,以SDS-PAGE电泳检测。
2 结果
2.1 基因ldh的 PCR扩增
扩增PCR产物电泳条带呈单一条带,特异性高,大小约1 kb,与预计大小相符(图1)。
2.2 质粒pET-LDH酶切鉴定
重组质粒pET-LDH经KpnⅠ单酶切后得到约6.9 kb大的单一片段;经KpnⅠ和SacⅠ双酶切后得到大小约5.9 kb和1.0 kb的两个片段(图2)。
2.3 基因ctxB的 PCR扩增
PCR产物电泳结果显示为单一条带,特异性高,大小约390 bp,与预计相同(图3)。
2.4 质粒pET-LDH/CTB的酶切鉴定
重组质粒pET-LDH/CTB经SacⅠ单酶切后得到约7.3 kb大小的单一片段;经KpnⅠ和XhoⅠ双酶切后得到大约5.9 kb和1.4 kb的两个片段;以KpnⅠ和SacⅠ双酶切后得到约6.3 kb和1.0 kb大小的两个片段;以SacⅠ和XhoⅠ双酶切后得到约6.9 kb和0.4 kb大小的两个片段(图4)。
2.5 质粒pET-LDH/CTB的序列测定和分析
重组质粒 pET-LDH/CTB中插入嵌合基因1390 bp。质粒pET-LDH/CTB中插入的ldh序列与Gene Bank中ldh比较同源性98%,插入的ctxB与Gene Bank中ctxB比较同源性达99%。在插入基因的上游,即KpnⅠ酶切位点的3’端为启始密码子ATG,在插入基因的下游,即XhoⅠ酶切位点的5’端为终止密码子TAA。
2.6 融合蛋白的诱导表达和表达产物SDS-PAGE鉴定
结果表明:表达菌株 BL/pET-LDH/CTB经IPTG诱导4 h后表达融合蛋白,融合蛋白的分子量约70×103(图5)。
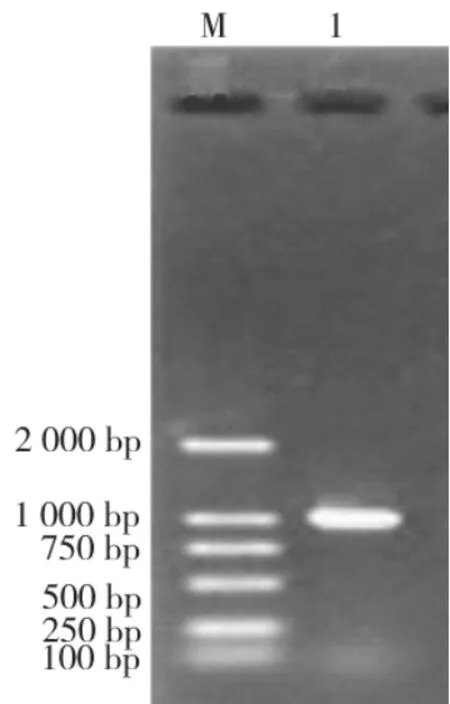
图1 变链菌ldh PCR
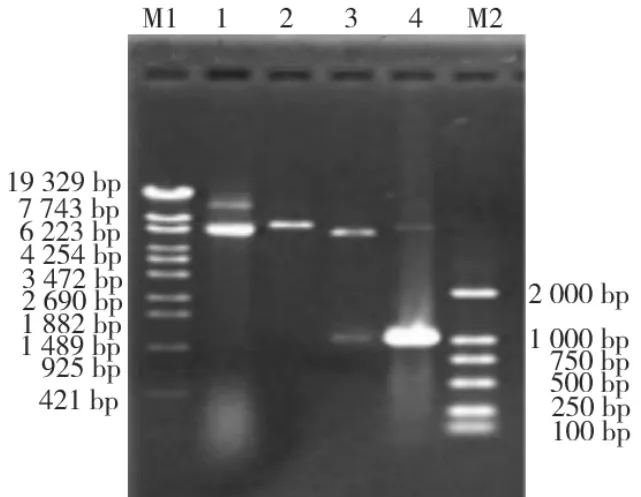
图2 质粒pET-LDH酶切鉴定
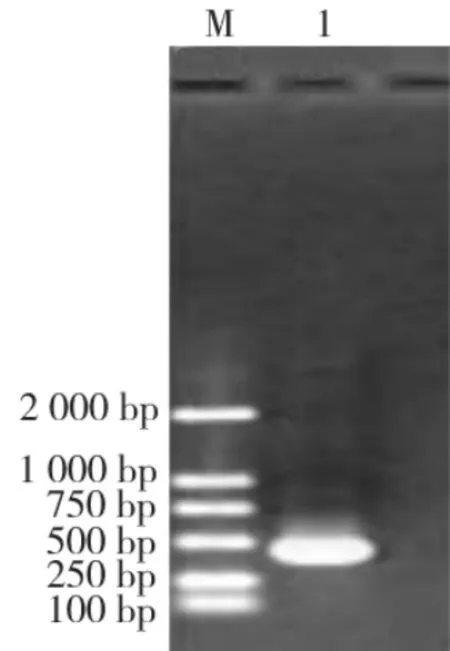
图3 ctxB PCR扩增
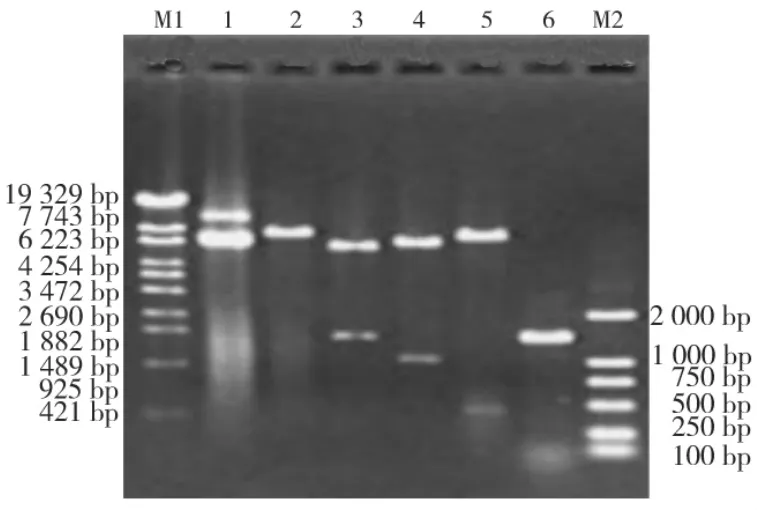
图4 质粒pET-LDH/CTB酶切
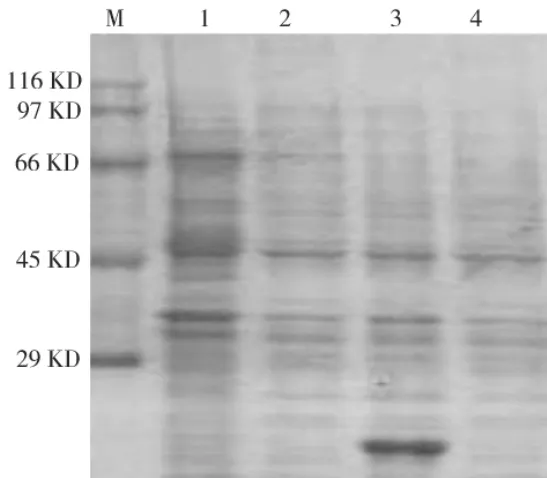
图5 BL/pET-LDH/CTB表达产物的SDS-PAGE
3 讨论
pET表达系统是有史以来在E.coli中克隆表达重组蛋白功能最强大的系统之一。目的基因被克隆到pET32a(+)载体上,受T7噬菌体强转录和翻译信号控制,并通过在宿主细胞提供T7 RNA聚合酶来诱导表达。pET表达系统使用最广泛的为宿主菌 BL21(DE3)及其衍生菌株[3]。pET32a(+)带有氨苄青霉素抗性基因,以及可供选择的His.tag、S.tag 、Trx.tag 标签,利用这些标签可以设计表达融合蛋白以利于蛋白的分离纯化[4]。当目的基因被人为的克隆致pET载体的多克隆位点(T7 lac强启动子的下游)后,宿主菌在代谢性乳糖类似物IPTG的诱导作用下能产生大量的T7RNA聚合酶,后者特异性的识别表达载体中核糖体结合位点,从而高效表达目的重组蛋白。由于IPTG不会被宿主菌利用,因此向培养液中加入少量的IPTG就能对lacUV5和T7 lac强启动子产生持久的诱导作用。本研究中将已构建的嵌合基因表达质粒pET-ldh-ctxB 转化 E.coli BL2l(DE3),经IPTG诱导表达了融合蛋白质。
LDH是合成乳酸的关键酶,作为变链菌的重要毒力因子之一,其生物学作用是致龋的关键环节。变链菌LDH蛋白分子量为35×103,由328个氨基酸组成,分子量与其他产乳酸菌的LDH相近且氨基酸序列具有较高同源性。LDH的活性编码区大小为1.2 kb,加上相关调节序列共1.29 kb,存在多个酶切位点。碱基1~255 bp是核糖体结合和启动子区域,256~1239 bp为编码活性区,其后是由两个反相重复序列构成的非依赖性终止子区域。已有研究证实变链菌LHD具备全套转录、翻译基原,为独立调节基因[2,5]。不同种属的LDH活性中心、结构和配体作用动力学参数极为相似,有着相同的FDP(1,6-二磷酸果糖)激活机制并存在较强的免疫交叉反应。目前变链菌LDH在龋病防治中的应用研究主要是替代疗法。有学者通过基因重组构建了效应株BCS3-L1,经体外发酵实验、啮齿类动物试验、基因稳定性和对宿主健康影响的研究,证实菌株发酵各种碳源的产物以乙醇和乙酰甲基醇代替了乳酸,在限菌大鼠和传统SD大鼠口腔中的竞争和定植较对照组强,牙面各级龋病计分均较对照组低[2,6]。乳酸脱氢酶蛋白作为抗原具有免疫原性,本研究选取编码LDH蛋白的全序列作为构建嵌合体防龋疫苗的目的基因。
口服疫苗主要通过黏膜途径诱导机体产生保护性抗体,其最大缺陷是所需抗原剂量大和易对抗原产生免疫耐受,需免疫佐剂的辅助[7-8]。近年来在防龋疫苗方面研究较多也较为成熟的主要是霍乱毒素和CTB。CTB本身不具有毒性,具有很强的免疫原性,通过口服能使机体产生很高的抗体效价,能辅佐其他抗原刺激机体产生SIgA和血清型IgG,因此可以作为黏膜免疫佐剂或给药的导向分子,特别是当其经化学方法或基因融合技术使其与不相关抗原形成偶联蛋白或融合蛋白时,其免疫佐剂活性强于其与不相关抗原混合免疫时的佐剂活性[8-10]。许多研究者通过基因重组技术获得ctxB与目的抗原的融合蛋白从而达到增强特异性抗原的免疫原性的目的[11-14]。本课题组在前期构建了携带变链菌表面蛋白PAcA和CTB嵌合基因的植物表达质粒,利用农杆菌介导法转化番茄,获得表达嵌合蛋白PAcA/CTB的转基因番茄,并进行了动物免疫实验和生态安全性的评价研究证实表达的嵌合蛋白PAcA/CTB具有很好的免疫原性,能够诱导动物产生特异性的黏膜免疫应答和系统免疫应答[15]。因此本研究选用CTB作为黏膜免疫佐剂,以提高变链菌乳酸脱氢酶的免疫原性。
[1]Dong YM,Pearce EIF,Yue L,et al.Piaque pH and associated parameters in relation to caries[J].Caries Res,1999,33(4):428-436.
[2]杨德琴,刘天佳.变形链球菌乳酸脱氢酶的结构及应用[J].国外医学口腔医学分册,2003,30(3):203 -205.
[3]Mitraki A,King J.Protein folding intermediates and inclusion body formation[J].Biotechnology,1989,7(6):690 -697.
[4]J萨姆布鲁克,DW拉塞尔.《分子克隆实验指南》[M].黄培堂,译.3版.北京:科学出版社,2002:1217-1265.
[5]杨德琴,刘天佳,庄恒,等.变形链球菌临床分离株乳酸脱氢酶遗传多态性研究[J].四川大学学报(医学版),2006,37(5):781-784
[6]林静,朱明,李新尚,等.没食子鞣质及联合氟化钠对不同状态下变形链球菌乳酸脱氢酶活性影响的研究[J].口腔医学,2011,31(5):257-260
[7]Yamamoto M,McGhee JR,Hagiwara Y,et al.Genetically manipulated bacterial toxin as a new generation mucosal adjuvant[J].Scand J Immunol,2001,53(3):211 -217.
[8]Isaka M,Yasuda Y,Taniguchi T,et al.Mucosal and systemic antibody responses against an acellular pertussis vaccine in mice after intranasal co-administration with recombinant cholera toxin B subunit as an adjuvant[J].Vaccine,2003,21(11 - 12):1165-1173.
[9]严小芳,张佩,董硕.霍乱毒素无毒B亚单位(CTB)黏膜免疫佐剂的研究进展[J].生命科学,2009,21(1):53-55.
[10]Dertzbaugh MT,Peterson DL,Macrina FL.Cholera toxin B subunitgene fusion:structural and functional analysis of the chimeric proterin[J].Infect Immun,1995,63(10):2021 -2025.
[11]张任飞,杨致邦,周侠,等.幽门螺杆菌vacA-ctxB融合基因原核表达载体的构建[J].重庆医科大学学报,2009,34(1):37-40.
[12]Habarta A,Patricia AE,Olivera N,et al.Increased immunogenicity to LipL32 of Leptospira interrogans when expressed as a fusion protein with the cholera toxin B subunit[J].Curr Microbiol,2011,62:526 -531.
[13]Prabakaran M,Velumani S,He F,et al.Protective immunityagainst influenza H5N1 virus challenge in mice by intranasalcoadministration of baculovirus surface-displayed HA and recombinant CTB asan adjuvant[J].Virology,2008,380:412 -420.
[14]Odumosu O,Nicholas D,Payne K,et al.Cholera toxin B subunit linked to glutamic acid decarboxylase suppresses dendritic cell maturation and function[J].Vaccine,2011,IN PRESS.
[15]白国辉,刘建国,田源,等.防龋用转基因番茄生态安全性的评价研究[J].牙体牙髓牙周病学杂志,2011,21(5):245-249.
