不同剂量过敏原对滴鼻制备急性和亚急性小鼠哮喘模型的影响*
2012-11-02姚秀娟袁慧慧贾军会赵文明安云庆黄克武
姚秀娟 李 艳 吕 喆 袁慧慧 贾军会 赵文明 安云庆 王 炜* 黄克武 孙 英
目前,我国约有1500~2000万人罹患哮喘,哮喘是全球范围内严重威胁公众健康的慢性疾病。随着社会工业化、城市现代化、环境清洁化的发展,近年来哮喘发病率有明显增加的趋势[1]。该病作为一种慢性进行性疾病不仅严重影响患者的生活质量,而且增加了家庭和社会经济负担,因此,哮喘发生机制及其防治研究成为目前迫切需要解决的问题。
哮喘发病机制较为复杂,动物模型是研究哮喘发病机制、进行药物研发的主要工具。其中将卵清蛋白(ovalbumin,OVA)经腹腔或皮下多次致敏小鼠,雾化吸入OVA诱导哮喘的方法较为常见,该方法可引起小鼠气道高反应性、嗜酸性粒细胞浸润、气道重塑等哮喘病理学改变,同时也是进行免疫学机制研究的优选模型。然而,仅以肺组织存在嗜酸性粒细胞浸润来判断哮喘模型建立的成功与否仍存在较大争议,因此限制了该类小鼠哮喘模型在国内的广泛应用[2]。本实验采用滴鼻法成功建立了急性和亚急性小鼠哮喘模型,并对采用不同剂量OVA滴鼻诱导小鼠产生不同程度支气管哮喘症状,并对呈现气道高反应性、气道炎症和气道重塑等主要特征进行了评估,为进一步探讨哮喘的发生机制和药物筛选奠定了良好的基础。
1 材料和方法
1.1 材料
选用6~8周龄BALB/c雌性小鼠,均为无特定病原体(SPF)级小鼠,购于北京维通利华实验动物有限责任公司。OVA、氢氧化铝[Al(OH)3]凝胶,均购自美国Sigma公司。红细胞裂解液、刚果红染液购自北京Solarbio公司;伊红(HE)染液购自北京中山金桥生物技术有限公司;马松染液购自南京建成科技有限公司;过碘酸雪夫氏(PAS)染液购自北京益利精细化学品有限公司。FlexiVent动物肺功能测量仪(加拿大);Eppendorf离心机(德国)。
1.2 方法
1.2.1 急性期和亚急性期支气管哮喘模型小鼠的制备
取6~8周龄BALB/c雌性小鼠,随机分成两组:OVA组,生理盐水(NS)组。OVA组每只小鼠于0 d、12 d腹腔注射100 μg OVA致敏;18~23 d,分别采用不同剂量OVA(25 μg、50 μg、100 μg)溶于50 μl生理盐水中连续滴鼻激发急性和亚急性哮喘模型小鼠。NS组每只小鼠于0 d、12 d腹腔注射100 μl生理盐水致敏;18~23 d,采用50 μl生理盐水连续滴鼻激发作为对照组。
1.2.2 小鼠肺力学参数及气道反应性的测量
实验在0 d、20 d、24 d按80 mg/kg体重腹腔注射苯巴比妥钠将小鼠麻醉,行气管切开插管并与动物肺功能测量仪相连接后,以含量为21%氧气、呼吸频率为150次/min、潮气量10 ml/kg 、呼气末正压(PEEP)为2 cm H2O状态下进行机械通气,腹腔注射0.05 ml琥珀酸胆硷(9 mg/ml)使小鼠处于肌松状态。当小鼠呼吸平稳后测量单腔模型和常态模型呼吸功能参数,完成测量后利用FlexiVent雾化器以生理盐水和1 mg/ml、1.5 mg/ml、3 mg/ml、6 mg/ml、12 mg/ml呈递增浓度的乙酰甲胆碱(Mch)溶液雾化原位激发10 s,1 min后测定肺功能参数,分别得到气道阻力(Raw)、肺组织阻力(G)等的剂量对应数值。
1.2.3 支气管肺泡灌洗液中炎症细胞计数
各组小鼠分别在0 d、20 d、24 d,肺功能测定结束后,即刻用气管插管分3次注入预冷无菌PBS灌洗液(0.8 ml/次);收集灌洗液以2000 rpm离心10 min,细胞沉淀经红细胞裂解液处理后重悬于1 ml PBS中,取10 μl计数细胞总数,另取100 μl细胞悬液涂片,干燥后经HE染色和刚果红染色后计数嗜酸性粒细胞百分比(至少计数300个细胞)。
1.2.4 小鼠肺组织标本的采集和病理学检测
各组小鼠分别在0 d、20 d、24 d,收集肺泡灌洗液后,左肺用10%福尔马林溶液4 ℃固定过夜,常规石蜡包埋切片(厚度约为5 μm)。分别进行HE染色、刚果红染色、PAS染色和马松染色,观察炎性细胞浸润,特别是嗜酸性粒细胞浸润,黏液分泌和胶原沉积等气道重塑指标。
1.2.5 统计学方法
所有数据用均数±标准差(x±s)表示,采用Prism 5.0软件进行One-way ANOVA分析,两样本均数之间采用Bonferroni's Multiple Comparison Test法进两两比较,P<0.05为存在统计学差异。
2 结果
2.1 不同剂量OVA诱导建立急性和亚急性哮喘模型小鼠肺功能参数
实验20 d急性期,24 d亚急性期。乙酰胆碱(Mch)为3 mg/ml时,100 μg OVA激发组与50μg OVA激发组小鼠气道阻力、肺组织阻力、明显高于NS对照组;25 μg OVA激发组小鼠与NS对照组比较,气道阻力、肺组织阻力无显著性差异(如图1所示)。
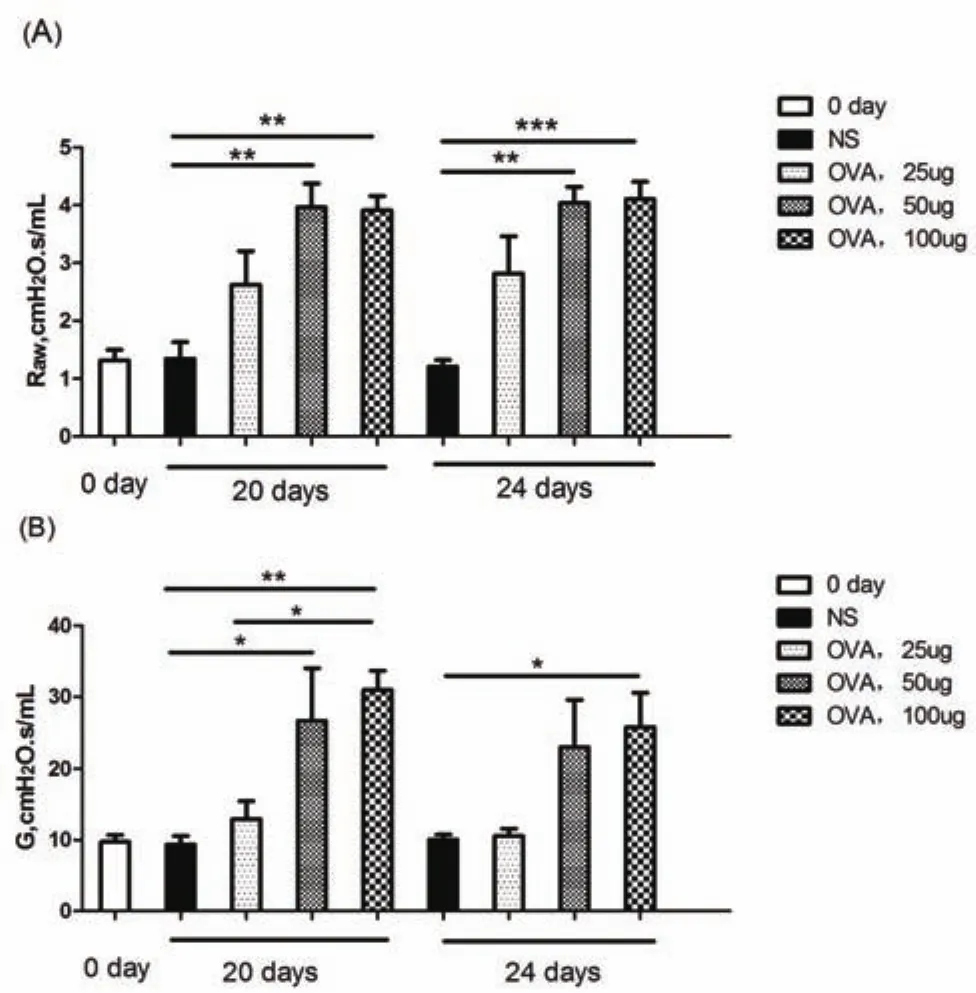
图1 肺功能检测
2.2 不同剂量OVA诱导建立急性和亚急性哮喘模型小鼠肺泡灌洗液(BALF)中细胞总数和嗜酸性粒细胞百分比
实验急性期(20 d)、亚急性期(24 d),100 μg OVA激发组与50 μg OVA激发组小鼠肺泡灌洗液中计细胞总数较NS组显著增加,嗜酸性粒细胞所占比例明显增加,25 μg OVA激发组其细胞总数有少量增加,嗜酸性粒细胞亦较少(如图2所示)。

图2 肺泡灌洗液中的细胞总数和嗜酸性粒细胞百分比
注:在20 d、24 d时,(图A)50 μg和100 μg OVA激发组小鼠肺泡灌洗液中细胞总数明显高于生理盐水对照组和25 μg OVA激发组(每组n=5)。(图B)50μg和100μg OVA激发组小鼠肺泡灌洗液中嗜酸性粒细胞百分比明显高于生理盐水对照组和25μg OVA激发组(每组n=5)。*:P<0.05, **:P<0.01, ***:P<0.001
2.3 不同剂量OVA诱导建立急性和亚急性小鼠哮喘模型病理学改变
2.3.1 炎性改变
肺组织石蜡切片经HE染色后见,100 μg OVA与50 μg OVA激发组小鼠肺泡、管腔、管壁及伴行动脉周围均有大量炎性细胞浸润,支气管黏膜皱襞增多、延长,管腔内存有大量黏液性痰栓,25 μg OVA激发组小鼠支气管管壁周围有少量炎性细胞浸润,管腔内未见黏性痰栓存在(如图3所示)。
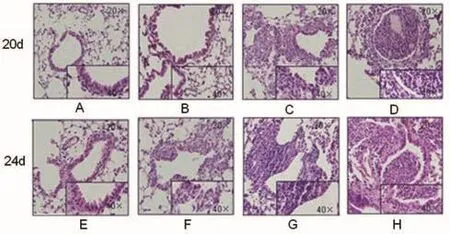
图3 行HE染色,生理盐水组(A,E),25 μg (B,F),50 μg(C,G)和100 μg OVA激发组(D,H)
2.3.2 嗜酸粒细胞浸润的观察
肺组织石蜡切片经刚果红染色如图4所示,100 μg OVA与50 μg OVA激发组小鼠管壁及伴行动脉周围较NS组有大量嗜酸性粒细胞浸润,25 μg OVA激发组小鼠管壁周围亦有少量嗜酸性粒细胞浸润。

图4 行刚果红染色,生理盐水组(A,E),25 μg(B,F),50 μg(C,G)和100 μg OVA激发组(D,H)
2.3.3 胶原纤维沉积的检测
肺组织石蜡切片马松染色如图5所示,100 μg OVA与50 μg OVA激发组小鼠支气管管壁及其伴行动脉周围存在明显的胶原纤维沉积,25 μg OVA激发组小鼠与NS组对比,管壁及其血管周围胶原纤维沉积无明显增加。
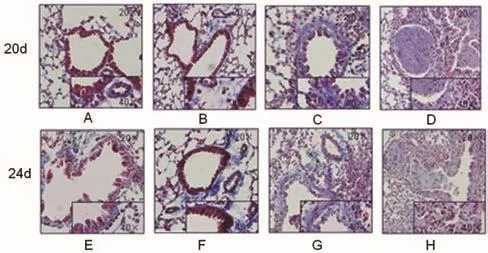
图5 行马松染色,生理盐水组(A,E),25 μg(B,F),50 μg(C,G)和100 μg OVA激发组(D,H)
2.3.4 气道粘液分泌的测定
肺组织石蜡切片经PAS粘多糖染色显示:100 μg OVA与50 μg OVA激发组小鼠较NS组气道内有大量粘液分泌,上皮细胞呈杯状细胞样增生,粘蛋白染色成阳性反应。25 μg OVA激发组小鼠气道上皮细胞内也可见有少量粘液蛋白(如图6所示)。

图6 行PAS染色,生理盐水组(A,E),25 μg (B,F),50 μg(C,G)和100 μg OVA激发组(D,H)
3 讨论
哮喘是一种气道慢性炎症性疾病,其病理生理特征涉及气道高反应性和气道重塑。Hayashi等[3]发现,在OVA诱发成熟雌性、雄性BALB/c小鼠的迟发性气道炎症中,雄性BALB/c小鼠其嗜酸性粒细胞和淋巴细胞浸润的支气管-细支气管炎没有雌性 BALB/c小鼠严重,而且支气管肺泡灌洗液中炎性细胞数也较雌性小鼠少。因此,在本实验中选用了SPF级BALB/c雌性小鼠,以便能更好地模拟哮喘的发病过程。
在过去的哮喘模型建立中,主要以肺组织是否存在明显的嗜酸性粒细胞浸润来判断哮喘模型建立是否成功。随着无气道高反应性的嗜酸性粒细胞性支气管炎诊断的提出[4], BALF中嗜酸性粒细胞百分比的增加并不能完全判断为哮喘模型,气道反应性的增高是判断哮喘模型成功建立的重要指标。通常认为有创的肺功能检测是气道高反应性的金指标,适用于阻塞性和限制性肺部疾病的检查[5]。有创小鼠肺功能检查遵循呼吸生理学和解剖学的原理,敏感性特异性较高,能够确定气道收缩的强度与具体部位,并可避免上气道阻力带来的误差[6-9]。
本实验使用小动物肺功能测量仪,在小鼠哮喘模型急性期和亚急性期,利用FlexiVent雾化器以生理盐水和递增浓度的乙酰甲胆碱溶液雾化原位激发后测定肺力学参数,分别得到小鼠气道阻力(Raw)、肺组织阻力(G)的数值。检测发现,50 μg和100 μg OVA激发组小鼠气道阻力(Raw)、肺组织阻力(G)在乙酰胆碱(Mch)浓度为3 mg/ml激发时明显高于生理盐水组,两组比较差异显著,有统计学意义。25 μg OVA激发组小鼠气道阻力(Raw)、肺组织阻力(G)较生理盐水组增加,但无统计学意义。同时,实验结果表明50 μg应为首选诱导剂量,不仅可以诱导较多嗜酸粒细胞浸润,亦可诱导气道高反应性和一定程度的气道重塑。
方法不一的小鼠哮喘模型构建是为了进一步了解过敏性气道炎症和气道高反应性的病理机制[10-12]。在国内外小鼠哮喘模型的建立中,雾化激发的方法较为常见[13-16]。此外,有研究使用OVA以外的致敏原制备出哮喘模型以便更好地模拟人类哮喘发病机制[17-20]。本实验采用25 μg、50 μg和100 μg OVA滴鼻,成功制备急性期和亚急性期小鼠哮喘模型,不同剂量的OVA滴鼻可诱导不同程度支气管哮喘模型。此方法操作方便,无需使用特殊装置,不仅可以缩短实验耗时,节约成本,更能够避免因OVA雾化挥发而对实验操作人员所造成的损伤。
4 结语
理想的哮喘模型应具备气道炎症、气道高反应性和气道重塑等特征。本实验采用OVA滴鼻法成功建立了急性和亚急性小鼠哮喘模型,通过有创肺功能和炎性反应的检测,确认了该模型的可靠性及首选过敏原剂量,为进一步研究哮喘的发生机制和药物筛选奠定了基础。
[1]钟南山.我国支气管哮喘防治研究重点及努力方向[J].中华结核与呼吸杂志,2005,28(12):809-811.
[2]万欢英.支气管哮喘与慢性阻塞性肺疾病鉴析[M].北京:人民卫生出版社,2008:22-28.
[3]Hayashi T,Adachi Y,Hasegawa K,et al.Less
[4]Gibson PG, Dolvoich J,Denburg J, et al.Chronic cough: eosinophilic bronchitis without asthma[J]. Lancet,1989,1(8651):1346-1348.
[5]Glaab T,Taube C,Braun A, et al.Invasive and noninvasive methods for studying pulmonary function in mice[J].Respir Res,2007,8:63.
[6]Bates JH, Irvin CG. Measuring lung function in mice: the phenotyping uncertainty principle[J].J Appl Physiol,2003,94(4):1297-1306.
[7]Irvin CG,Bates JH.Measuring the lung function in the mouse:the challenge of size[J].Respir Res,2003,4:4.
[8]Kaczka D,Dellaca RL.Oscillation mechanics of the respiratory system: applications to lung disease[J].Crit Rev Biomed Eng,2011,39(4):337-359.
[9]Schuessler TF, Bates JH. A computercontrolled research ventilator for small animals:design and evaluation[J].IEEE Trans Biomed Eng,1995,42(9):860-866.
[10]Taube C, Dakhama A, Gelfand EW, et al.Insights into the pathogene-sis of asthma utiliz ing murine models[J].Int Arch Allergy Immunol,2004,135(2):173-186.
[11]Kips JC, Anderson GP, Fredberg JJ, et al. Murine models of asthma[J].Eur Respir J,2003,22(2):374-382.
[12]Kumar RK,Foster PS.Modeling allergic asthma in mice: Pitfalls and opportunities[J].Am J Respir Cell Mol Biol,2002,27(3):267-272.
[13]Lloyd CM, Gonzalo JA, Coyle AJ, et al.Mouse models of allergic airway disease[J]. Adv Immunol,2001,77:263-295.
[14]商艳,李强,黄怡,等.不同剂量致敏原对小鼠过敏性哮喘模型的影响[J].第二军医大学学报,2002,23(1):69-71.
[15]沈璐,赖克方,姜华,等.不同激发方式对小鼠过敏性支气管哮喘模型的影响[J].中华哮喘杂志,2009,36(15):404-408.
[16]陈晓红,钟南山,张卫东,等.布地奈德对哮喘小鼠气道重塑及JAK1/STAT6表达的影响[J].中华医学杂志,2007,87(23):1627-1632.
[17]DiGiovanni FA, Ellis R, Wattie J, et al.Concurrent dual allergen exposure and its effects on airway hyperresponsiveness,inflam mation and remodeling in mice[J]. Dis Model Mech,2009,2(5-6):275-282.
[18]Gore JC,Schal C. Cockroach allergen biology and mitigation in the indoor environment[J].Annu Rev Entomol,2007,52:439-463.
[19]Chang TT,Huang CC, Hsu CH.Inhibition of mite-induced immunoglobulin E synt hesis,Airway inflammation, and hyperreactivity by herbal medicine STA-1[J]. Immunopharmacol Immunotoxicol,2006,28(4):683-695.
[20]Garantziotis S, Brass DM, Savov J, et al.Leukocytederived IL-10 reduces subepit helial fibrosis associated with chronically inhaled endotoxin[J]. Am J Respir Cell Mol Biol,2006,35(6):662-667.sensitivity for late airway inflammation in males than females in BALB/c mice[J].Scand J Immunol,2003,57(6):562-567.
