提高中药注射剂安全性的技术策略
2012-11-01段为钢张陆勇
段为钢,张陆勇
(1.云南中医学院分子生物学实验室,云南 昆明 650500;2.中国药科大学新药筛选中心,江苏 南京 210009)
中药注射剂系指药材经提取、纯化后制成的供注入体内的溶液、乳状液及供临用前配制成溶液的粉末或浓溶液的无菌制剂。最早产生在上世纪四十年代,由钱信忠等前辈开创[1]。经过几十年的发展,中药注射剂已在临床广泛应用。目前上市使用的中药注射剂约140个品种,包括肌注用、穴位注射用、静脉用注射剂等。中药注射剂能提升药效、使某些中药的疗效得到更好地发挥,但带来的不良反应也时常发生,甚至还很严重,使其安全性问题受到了业界甚至公众的广泛关注,其中以静脉用注射剂的安全性问题最为突出[2]。目前有很多学者在提高中药注射剂安全性方面提出了很多建议[3-4],但多侧重管理层面的,很少提出具体技术层面的策略。为此,本研究从较为具体的技术层面提出相关策略,以供参考。
1 中药注射剂的安全性问题主要来自大分子物质
中药注射剂的疗效是有物质基础的,同样,安全性问题必然存在物质基础。由于目前的绝大多数中药注射剂由口服制剂上升而来,因此业界逐渐意识到中药注射剂的安全性问题主要是大分子物质导致的[5-6]。理由是:1)中药注射剂的安全性问题的临床表现多与原有药理作用关系甚少,多表现为变态 (样)反应,而诱发变态反应的直接抗原则属于大分子物质;2)中药注射剂具有生物提取物的特征,含有微量的大分子物质;3)同品种的口服剂安全性很高,但安全性问题几乎都出现在注射剂,这间接支持中药注射剂安全性问题的物质基础主要是大分子物质,因为消化道屏障的存在,大分子物质口服很难直接吸收。比如,小分子物质绿原酸曾是中药注射剂备受争议的过敏原[7]。但研究证实不是过敏原[8],相反,提取物中的大分子物质才是引起过敏反应的物质[8]。
以下将主要从大分子物质基础角度对中药注射剂相关物质检查、安全性检查和大分子物质去除提出相应的技术策略。
2 中药注射剂有关物质检查法技术指标偏低
根据以上的简要分析,作为生物提取物的中药注射剂可能含有的大分子物质有蛋白质、核酸、多糖、缩合鞣质、树脂等,也含可能富含草酸 (盐)、钾离子等小分子物质。除非有特别的研究支持,这些物质基本上对中药注射剂无疗效贡献,或者其贡献可以忽略。有文献提出某些植物蛋白质具有某些特定生物活性[9-10],但对于从口服剂上升而来的中药注射剂而言应该不属于活性成分,因为蛋白质口服不吸收;另外也有文献报道植物多糖具有多种生物活性[11],但对于从口服剂上升而来的中药注射剂而言,多糖是不易吸收的,甚至连相对分子质量较小的蔗糖 (MW=342)也需水解成单糖才吸收,由此推测也不属于注射剂预定的活性成分。因此,提高中药注射剂大分子物质的质量标准有利于从物质基础方面提高中药注射剂的质量。
2.1 蛋白质检查 蛋白质是强抗原,能诱发机体变态反应,且中药注射中的蛋白多属于植物蛋白或动物蛋白,与人的种属差异大,抗原性很强。微量的蛋白质能足够诱发免疫反应,比如成人使用乙肝疫苗一次所需的蛋白量为20 μg[12]。《中华人民共和国药典》(以下简称《中国药典》)自2000年版以来开始检查中药注射剂中的蛋白质,采用的方法是磺基水杨酸自然沉淀法。《中国药典》2005年版和2010年版基本上沿用了2000年版,只是在表述上略作修改,无实质性提高。
磺基水杨酸自然沉淀法定量标准蛋白质的下限约为25 μg/mL,在大体积 (10 mL)比浊时,检查限可达12 μg/mL,而在小体积 (2 mL)比浊时,检查限约为 37 μg/mL[13]。《中国药典》采用的小体积比浊 (1 mL注射液和1 mL磺基水杨酸试剂),因此检查限不会低于37 μg/mL,中药注射剂的较深颜色,还会干扰比浊。中药注射剂的原料多采用醇水法制备,以牛血清白蛋白 (BSA)为例,BSA在70%以上的乙醇中的溶解度可达20~50 μg/mL,因此乙醇沉淀蛋白质是不彻底的,按照磺基水杨酸自然沉淀法检查,也很难查出阳性结果。
为此,直接提高中药注射剂蛋白质检查方法的策略是采用较大反应体系进行离心沉淀检查。比如采用5 mL中药注射剂和5 mL磺基水杨酸试剂混匀后于5000 r/min离心10 min,不得出现沉淀。这样可以将检查限下降到1~4 μg/mL,同时中药注射剂的颜色也不会干扰。
另外,如果采用富集策略,可以极大地提高检查灵敏度。比如,将一定体积的中药注射剂通过PVDF膜小孔,PVDF膜将特异性地吸附溶液中的蛋白质,随后用有机溶剂洗除中药注射剂的杂色 (蛋白质无色),此时再用蛋白质特异性染色剂如考马斯亮蓝显色来检查蛋白质。本课题的研究表明,根据此原理建立的方法,其检查限可达ng/mL级,同时具有较强的抗干扰能力,结果直观,原始结果可以长期保存[14-15]。
2.2 缩合鞣质检查 《中国药典》检查的是鞣质,包括鞣质单体和缩合鞣质,因为单体鞣质和缩合鞣质均能被蛋白质 (1%鸡蛋清生理盐水溶液和明胶溶液)沉淀。自2000年版以来,《中国药典》对鞣质的检查仅有表述调整,也无实质性提高。令人遗憾的是,《中国药典》方法对加入附加剂聚乙二醇和聚山梨酯的中药注射剂成品无法检查[16],使得某些成品中药注射剂超标的缩合鞣质无法受到监控。从原理上看,该方法也不太适合中药注射剂,因为越来越多的研究表明单体鞣质属于活性物质,如柯里拉京[17]、儿茶素[18]等就具有较好的生物活性,也能被口服吸收。实际上只有缩合鞣质口服不吸收,对中药注射剂无活性贡献,相反还会带来安全性问题。缩合鞣质颜色深水溶性差,容易产生不溶微粒,也能与蛋白质形成复合沉淀,起到增强抗原的作用。因此,中药注射剂应检查缩合鞣质而非单体鞣质。
其次,在鞣质的检查方面,由于《中国药典》采用蛋白质自然沉淀法,检查限量偏高,尽管文献声称此法对标准鞣质 (鞣酸)的检查限可达50~100 μg/mL[19]。但本课题以氧化缩合的没食子酸溶液 (20 mg/mL没食子酸溶液,放置后A410>3)为例,药典方法的检出限>6 mg/mL(见表1)。
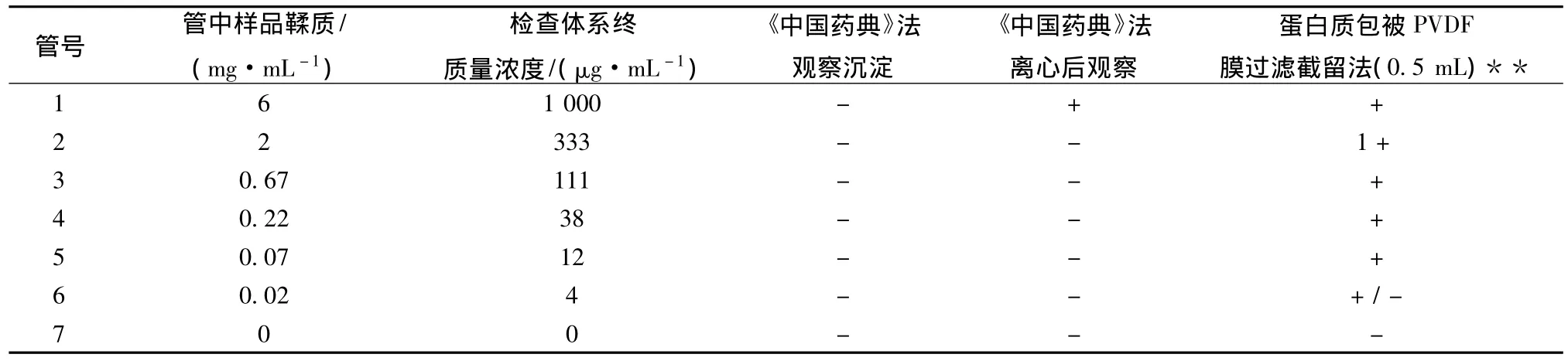
表1 不同检查方式的鞣质检查结果*
在提高检测灵敏度方面,如果采用离心沉淀法,检查限将会降低到6 mg/mL左右 (以上述没食子酸溶液计)。
如果进一步改进方法,采用蛋白质包被的PVDF膜来检测,对注射剂中的缩合鞣质检查限可达70 μg/mL(见表1)[20]。该法仍是利用蛋白质与鞣质形成复合物的原理。由于缩合鞣质与蛋白质形成的复合物仍具有颜色,而且几乎不溶于常见的有机溶剂 (包括DMSO),因此也会排除单体鞣质的干扰,检查的针对性增强。
2.3 树脂检查 中药注射剂中的树脂也属于大分子物质,容易转化成不溶性颗粒,影响注射剂质量。天然树脂具有较高的脂溶性,《中国药典》采用盐酸自然沉淀法检查[16]。自2000年版以来,《中国药典》对树脂的检查仅有表述调整,仍未见实质性提高。同样,由于中药注射剂的颜色较深,对自然沉淀的观察有较大干扰,如果采用离心沉淀法观察,检查灵敏度将会增加2~3倍。
2.4 核酸、多糖检查 由于中药注射剂属于生物提取物,大分子物质核酸和多糖也可能带入到中药注射剂中。核酸在无水乙醇中的溶解度约为15 μg/mL,在70%乙醇中的溶解度约为90 μg/mL。尽管一般资料都声称多糖不溶于乙醇,但中药注射剂还是可能会带入多糖类成分。然而,历版《中国药典》对这两类大分子未纳入检查。
植物核酸属于异源性核酸,目前尚未见药用活性报道,也不能直接吸收。因此对于从口服剂上升而来的中药注射剂而言,应不属于活性成分,相反,核酸也具有一定的抗原性 (如临床上某些疾病能检测到抗DNA抗体[21]),也能增强其他抗原 (如蛋白质)的抗原性。
多糖物质的活性报道较多,多集中在增强机体免疫方面[11],如灵芝多糖[22]。但机体对多糖很难直接吸收,目前也很难找到植物多糖直接吸收的证据 (也许多糖口服起作用不依赖吸收,或通过刺激消化道起作用),因此推测不属于中药注射剂的有效物质。如果将植物多糖注入体内,其增强免疫作用很可能就成为促进变态反应的作用,诱发机体变态反应。
因此,核酸和多糖大分子物质也应该纳入中药注射剂中的检查范围。
2.5 关于大分子物质的仪器检查 采用高灵敏度的仪器检查某些具体物质,具有很多优势,主要体现在检测灵敏度方面。比如SDS-PAGE(十二烷基硫酸钠聚丙烯酰胺凝胶电泳)检查某种蛋白质的灵敏度也可达ng级,质谱检测也常能达到ng级,ELISA(酶联吸附免疫)检测可达pg级[23]。然而,中药注射剂中大分子物质是由很多分子量不均一、理化性质也不均一的分子组成的,经SDS-PAGE分离后,每个蛋白质的含量可能都低于检测限,导致信号被噪音淹没;质谱检测也存在类似的问题,某一具体大分子物质因丰度不够仍可能被检测噪音淹没;普通HPLC由于采用分离检测原理,检测器多为UV检测器,大分子物质峰并不存在特异性,即使含量很高也会受其他指纹峰干扰而无法指认;ELISA检测的信号放大率很高,但只针对某个特异性分子。因此仪器检查对具体大分子物质检测具有多种优势,但对中药注射剂的大分子物质检查优势不明显。
2.6 草酸盐和钾离子检查 《中国药典》对中药注射剂中的草酸盐和钾离子也进行了检查。根据本课题的实验结果(表2)推算,《中国药典》对中药注射剂草酸盐的最高容忍度约为2.47 mmol/L(人体血总钙参考值为2.1~2.6 mmol/L)。而对钾离子的最高容忍度为1 mg/mL,相当于25 mmol/L(人体血钾参考值为3.5~5.5 mmol/L)。
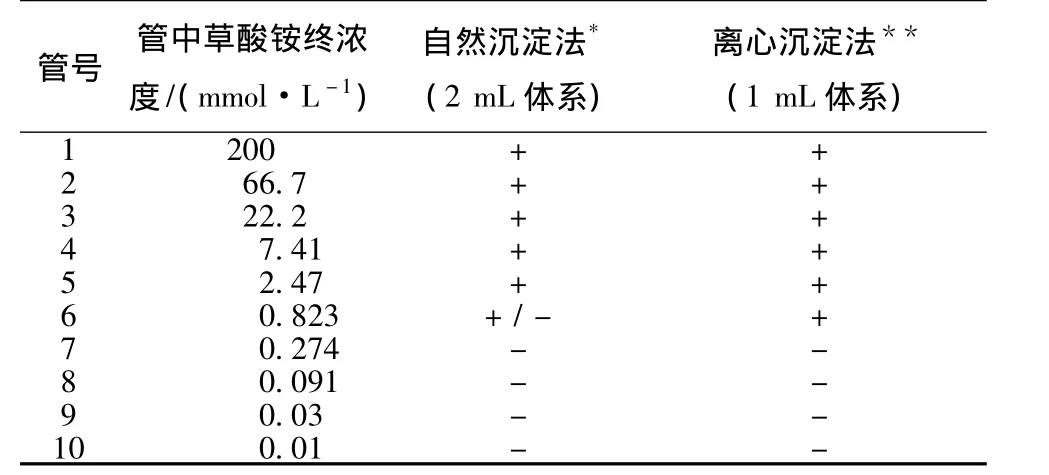
表2 草酸盐氯化钙沉淀检查结果
草酸盐的主要毒性是络合钙离子,心血管毒性明显,钾离子的毒性也主要表现在心血管系统。按照目前中药注射剂的草酸盐和钾离子的最高容忍度,如果采用静脉推注,可能会引发一过性低血压甚至低血压休克;而静脉滴注的速度较慢,对机体的不良反应相对较小[24]。如要提高标准,可以采用离心沉淀法 (见表2)或加大取样体积等进行检查,但是考虑到生产的难度 (草酸盐和钾离子在生产中很难进行选择性去除),暂不建议提高标准 (见后述)。
3 关于安全性检查
3.1 目前中药注射剂安全性检查存在的主要缺陷 自2005年版,《中国药典》增加了《中药注射剂安全性检查法应用指导原则》内容,涉及到异常毒性检查、降压物质检查、过敏反应检查、溶血与凝集检查以及细菌内毒素检查,也保留着中药注射剂的热原检查 (表3)。对比2005年版,2010年版《中国药典》对安全性检查也无实质性提高。提高安全性检查的阳性率有利于发现并评估中药注射剂的安全性,为临床用药提供参考;而有效提高安全性检查的标准,有利于从生物学角度提高中药注射剂的质量。
从原理上讲,安全性检查属于小概率检查,而药理作用研究属于大概率研究。小概率检查和大概率研究应该在方法学上有所区别。根据报道,目前临床上出现的中药注射剂不良反应的总体发生率为2% (尽管某些反应很严重),大多品种的不良反应发生率在5%以下,少数超过10%,个别可达40%(华蟾素注射液)[25]。
在检查样本量上,目前《中国药典》方法进行安全性检查的思路仍沿用药理方法的思路,比如异常毒性只用5只小鼠,过敏反应检查只用6只豚鼠,降压物检质查只用1只猫(《中国药典》未明确规定是几只,但从表述上看应该是 1 只)[16]。

表3 《中国药典》的中药注射剂安全性检查项目
动物实验和化学实验的最大差别在于前者的个体差异较大,要想获得阳性结果,就必须有一定的样本量。由于药理作用一般属于大概率研究,小动物10只,大动物3~6只就能反映出其药理作用。相反,安全性检查属于小概率研究,小量动物很难排除某些不良反应不会发生,除非不良反应的发生率也成为大概率事件。在当前《中国药典》推荐的动物数下,对反应率为5%以下不良反应检出率很低(<30%),如果检出率要达到80%,动物不良反应的理论出现率将成为非小概率事件了 (表4)。
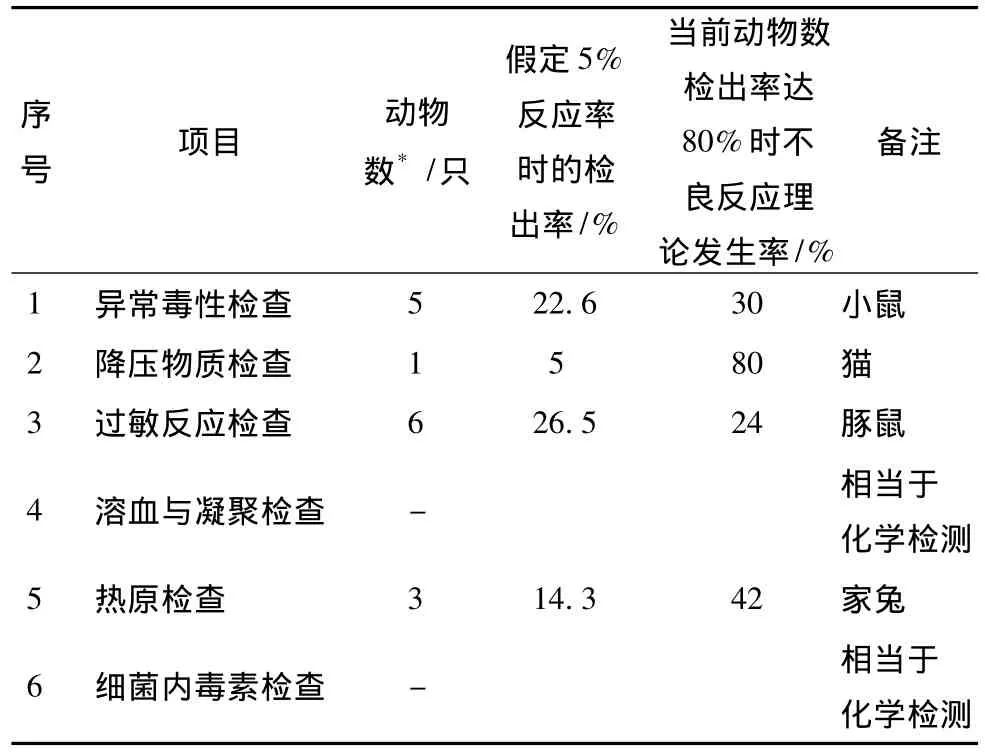
表4 不良反应发生率和检出率的推算
3.2 解决策略 要提高安全性检查的阳性率可以从三方面解决:1)选用敏感动物模型;2)增加检查动物数;3)根据目前认识有针对性地富集中药注射剂某些成分。
目前《中国药典》方法已经是采用公认的敏感动物或较理想动物。要想获得更敏感的模型动物,牵涉到动物品种改造,短期内不大可行。
增加安全性检查阳性率的直接方法就是增加检查样本量,假定动物的不良反应率为1%、5%、10%时,不同动物数的检出率存在较大差别,但动物数的增加能够增加检出率,增加到多少,可以由相关专家确定。但必须清醒的是,增加动物数并不能无限增加小概率不良反应的检出率。即使在最佳的饲养环境中,动物仍存在一定的发病率或死亡率 (尽管概率发生率很小),动物自发的异常会干扰结果判断。
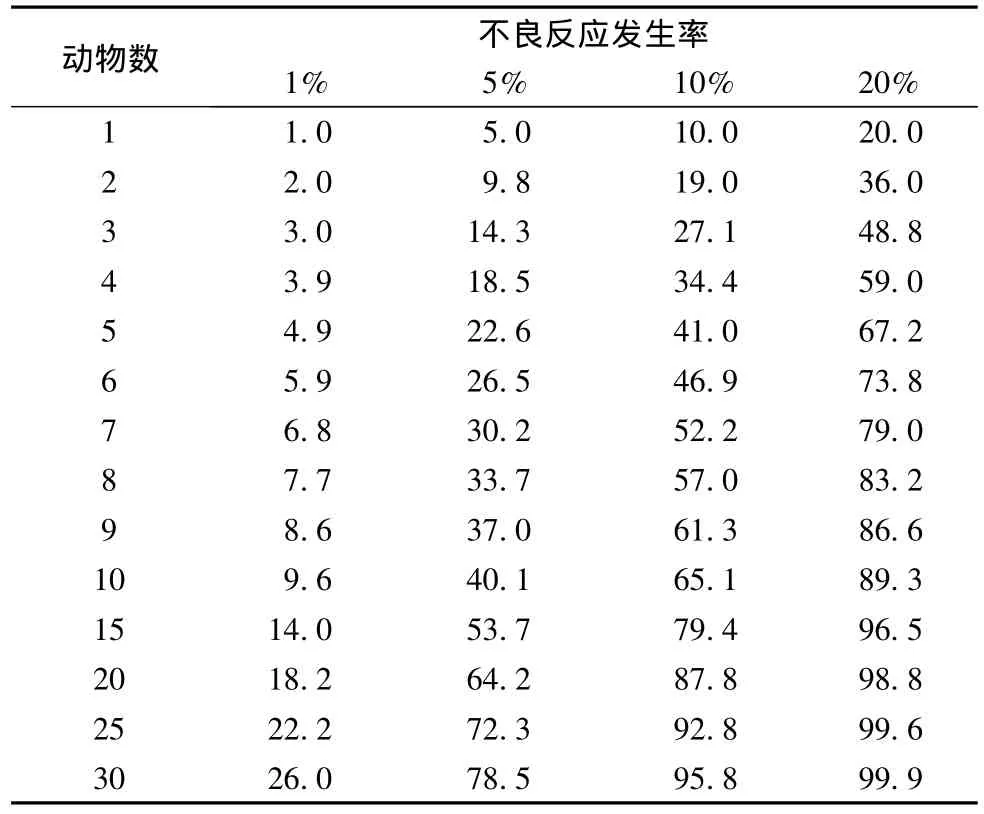
表5 不同动物数对不同发生率不良反应的检出率/%
但增加检查样本量还将增加检查成本,特别是人力成本。为此,有必要提出新的检查策略。如果根据中药注射剂不良反应的特点,对中药注射剂中的某些物质富集,采用现有模型 (不增加样本量或稍微增加样本量),也会显著提高安全性检查的阳性率。将微量大分子物质注射到体内是中药注射剂的显著特点,富集大分子有望增加安全性检查的阳性率。
对此,可以将纳滤技术结合起来,用纳滤膜将相对分子质量>3000或5000的大分子物质富集,获得富含大分子注射剂,这种注射剂样品能大幅度增加检测的灵敏度。比如,本课题组将上市的清开灵注射液100 mL,用10000纳滤膜富集得到25 mL富含大分子注射液 (固体物总含量与原注射液一致),富含大分子注射液给小鼠腹腔注射则发生明显的扭体反应。相似地,双黄连注射液富含大分子注射液能诱发豚鼠过敏反应。但用清开灵注射液和双黄连注射液原液和去大分子注射剂则未见异常发现 (数据尚未发表)。
4 中药注射剂安全性提高的方法
4.1 去除大分子物质 根据以上分析,要提高中药注射剂的安全性,去除中药注射剂中的大分子物质是一个有效的策略。除非有特别的研究支持,对于从口服剂上升而来的中药注射剂而言,大分子物质无疗效贡献,相反还可能带来了安全性问题。以2010年版《中国药典》二部收载的2271个药物 (品种)为例,在口服治疗全身疾病的药物中,相对分子质量大于500的较少,大于1000的只有少数几个,大于3000的则没有。因此中药注射剂中相对分子质量大于3000的物质就不大可能是有效成分了。理论上讲,相对分子质量大于3000的分子都必须去除,由于相对分子质量越小,去除难度越大,因此厂家可以结合实际情况,选择分子量去除范围,或逐步实现去除3000以上分子量物质。本课题组初步的实验表明,去除大分子物质后对中药注射剂指纹图谱的影响很小 (<5%),提示去除大分子物质后的中药注射剂无明显疗效改变 (数据尚未发表)。
在生产方面,只要在目前工艺基础上增加一道分子筛工艺就可以实现大分子去除,去除的物质包括蛋白质、缩合鞣质、树脂、核酸、多糖、热原以及微生物等。尽管增加工艺会增加一定的生产成本,但从提高中药注射剂安全性角度考虑,适度增加成本是值得的。
4.2 去除某些小分子物质 小分子物质是中药注射剂疗效的贡献者,但共性小分子草酸盐和钾离子对机体的疗效贡献小,且会带来心血管毒性。尽管草酸盐可以通过钙剂沉淀去除,但钙剂也可能沉淀其他活性分子如黄酮类成分,从而导致活性成分丢失,影响注射剂的有效性。而钾离子可以通过阳离子交换树脂进行去除,但此去除方式可能会影响到其他阳离子活性成分,比如生物碱。目前也未见中药注射剂选择性去除草酸盐和钾离子的方法报道,且分子筛对这些小分子也无法选择性去除。因此,从生产环节进一步去除草酸盐和钾离子尚存难度。所以,单纯提高草酸盐和钾离子的质量标准,现实意义不大,但是为了减少草酸盐和钾离子的毒性,应该禁止中药注射剂静脉推注。
另在2012年6月9日召开的“2012年全国中药注射剂安全性评价及质量控制学术研讨会”上获悉,适度采用离子交换或电渗析技术可以在不明显改变活性成分的基础上进一步控制钾离子。
必须指出的是,本研究不否认不同中药注射剂中某些特别的小分子物质也参与了安全性问题。由于这属于中药注射剂品种的个性问题,本研究不予讨论。
5 结语
中药注射剂从诞生到现在,经历了六七十个年头,随着科学技术的进步,生产技术也在不断改进。中药注射剂的安全性存在共性问题和个性问题,其问题不可能通过某一个技术全部解决。但从监控大分子物质为切入点,有利于解决中药注射剂的共性安全问题,将产品质量上升到一个更高的水平。
[1]施怀生,冯俊婵.中药注射液创制考源[J].中华医史杂志,1995,25(2):107.
[2]徐 春.关注中药注射剂的不良反应[J].中国现代药物应用,2009,3(4):302-304.
[3]熊兴江,王 阶,何庆勇.中药注射剂应用现状及安全性问题与对策[J].中西医结合学报,2010,8(4):307-311.
[4]毛 睿,宣利江.中药注射剂的现状及安全性分析[J].中国药师,2009,12(1):51-53.
[5]段为钢.中药注射剂安全性的技术思考[J].云南中医学院学报,2009,32(6):12-13.
[6]段为钢,李奇峰,柯 瑾.中药注射剂有效性及“毒性”的物质基础分析[J].医学与哲学,2011,32(8):56-60.
[7]黄芳华.绿原酸及其中药注射剂的安全性问题状况分析[J].中国中药杂志,2008,33(22):2716-2719.
[8]吴晓冬,杨华蓉,林大胜,等.绿原酸致敏性的综合研究与评价[J].中国中药杂志,2010,35(22):3357-3361.
[9]宋华梅,黄利鸣,王艳林,等.天花粉蛋白对宫颈癌Caski细胞DNMT1基因的表达和酶活性的影响[J].中国药理学通报,2010,26(10):1312-1315.
[10]张美莉,侯文娟,杨立风.植物蛋白源生物活性肽的研究进展[J].中国食物与营养,2010(11):33-36.
[11]申利红,王建森,李 雅,等.植物多糖的研究及应用进展[J].中国农学通报,2011,27(2):349-352.
[12]崔忠太,林淑霞,闫岩.接种不同剂量国产重组酵母乙肝疫苗效果分析[J].保健医学研究与实践,2011,8(1):46-47,49.
[13]李奇峰,柯 瑾,段为钢,等.PVDF膜吸附染色法检测中药注射剂微量蛋白[J].云南中医学院学报,2010,33(6):43-46.
[14]Duan W,Que L,Ke J,et al.Detection of trace protein in Chinese materia medica injections by soaking PVDF membrane[C].RSETE 2011-proceedings,Newyork,USA:the Institute of Electrical and Electronics Engineers(IEEE),Inc.,2011:6718-6720.
[15]Duan W,Li Q,KE J.Detection of trace protein in Chinese materia medica injections by use of polyvinylidene fluoride membrane[C].CEPPH 2011-Proceedings,Irvine,CA,USA:Scientific Research Publishing(SRP),Inc.,2011:19-21.
[16]国家药典委员会.中华人民共和国药典:2010年版一部[S].北京:中国医药科技出版社,2010.
[17]熊富良,张雪琼,刘 莹,等.HPLC测定解毒保肝分散片中柯里拉京含量[J].中成药,2009,31(10):附3-4.
[18]刘振丽,宋志前,巢志茂,等.HPLC测定何首乌中抗氧化有效成分没食子酸和儿茶素在炮制前后含量的变化[J].中成药,2009,31(9):1392-1394.
[19]王晓春,杨建春,徐军辉.中药注射剂中裸质检查法的探讨[J].中国药品标准,2002,3(2):30-31.
[20]段为钢,柯 瑾,李奇峰,等.蛋白质包被PVDF膜吸附法检查中药注射剂缩合鞣质[J].中成药,2011,33(11):80-83.
[21]汤春园,陶 瑕,李 山.抗核抗体、抗双链DNA抗体研究与实验室检测的进展[J].内科,2008,3(3):421-423.
[22]李晓冰,赵宏艳,郭 栋.灵芝多糖药理学研究进展[J].中成药,2012,34(2):332-335.
[23]郭青,吴晓燕,史清水,等.中药注射剂质量评价的有关研究思路、方法和建议[J].药物评价研究,2010,33(5):351-360.
[24]马 辉,金 丹,耿凤英,等.1190例中药注射剂不良反应报告分析[J].中国实用医药,2009,4(20):8-10.
[25]吴嘉瑞,张 冰.基于群案信息分析的中药注射剂不良反应发生率研究[J].中药新药与临床药理,2009,20(4):391-394.
