液相色谱串联质谱法测定肉中丙硫咪唑及其代谢物
2012-10-28付晓芳赵晓亚尚吟竹
付晓芳,王 鹏,赵晓亚,李 晶,尚吟竹,叶 诚
(湖北出入境检验检疫局技术中心,湖北 武汉 430050)
液相色谱串联质谱法测定肉中丙硫咪唑及其代谢物
付晓芳,王 鹏,赵晓亚,李 晶,尚吟竹,叶 诚
(湖北出入境检验检疫局技术中心,湖北 武汉 430050)
建立同时测定肉中丙硫咪唑及其代谢物丙硫咪唑砜、丙硫咪唑亚砜、2-氨基丙硫咪唑砜的液相色谱串联质谱法。样品用乙腈提取,液液分配净化后,XDB-C18色谱柱分离,流动相乙腈:0.1%甲酸溶液(1:1,V/V),外标法定量。丙硫咪唑及其3种代谢物的检出限均为0.010mg/kg,在0.010~1.0mg/L范围内其质量浓度与峰面积呈良好的线性关系,相关系数大于0.99。添加量为0.010~0.050mg/kg时的回收率为82.3%~97.6%,相对标准偏差为4.9%~12.9%。该方法简便、快速、准确,可用于猪肉、牛肉、羊肉、鸡肉、香肠中丙硫咪唑及其代谢物的定性、定量检测。
丙硫咪唑;液相色谱-串联质谱;代谢物;肉
丙硫咪唑(albendazole,ABZ),又名肠虫清、阿苯达唑、抗蠕敏,是一种高效、广谱、低毒的苯咪唑类抗蠕虫药,对肝虫、吸虫、绦虫和胃肠道线虫均有显著作用。由于丙硫咪唑是治疗线虫和绦虫的首选药物,因此使用比较频繁,很容易造成动物组织的残留,危害人体健康。丙硫咪唑在体内会代谢为丙硫咪唑砜(albendazole sulfone,ABZ-SO)、丙硫咪唑亚砜(albendazole sulfoxide,ABZ-SO2)和2-氨基丙硫咪唑砜(albendazole-2-aminosulfone,ABZ-NH2)[1]。欧盟和我国均规定丙硫咪唑及其代谢物的总和在动物体内的最大残留限量为100μg/kg,为了满足欧盟和我国兽药残留监控的要求,有必要建立同时测定丙硫咪唑及3种代谢物的检测方法。
目前,国内外对丙硫咪唑及其代谢物的研究主要集中在动物血浆中[2-5],关于动物组织[6-9]、水产品[10-11]和饲料[12]中丙硫咪唑及其代谢物的报道较少,徐雪等[13-14]研究了组织中丙硫咪唑亚砜和砜的液相色谱串联质谱法,没有丙硫咪唑及其三种代谢物的方法报道。我国检验检疫行业标准SN 0207—93《出口肉中丙硫咪唑残留量检验方法》[15],用配有荧光检测器的液相色谱仪测定猪肉中的丙硫咪唑母体含量,而不是检测丙硫咪唑及其3种代谢物的含量。本实验用乙腈匀质提取肉及肉制品中丙硫咪唑及其代谢物,液液萃取去除提取液中的油脂,液相色谱串联质谱法进行检测,旨在为其标准的建立提供参考依据。
1 材料与方法
1.1 材料与试剂
猪肉、牛肉、羊肉、鸡肉、香肠 武汉市场。
标准品丙硫咪唑、丙硫咪唑砜、丙硫咪唑亚砜和2-氨基丙硫咪唑砜(纯度≥97%) Dr. Ehrenstorfer公司;乙腈(色谱纯) 美国Fisher公司;其余试剂均为分析纯。
1.2 仪器与设备
1100 液相色谱仪 美国安捷伦公司;API 4000Q 三级四级杆质谱仪(配有电喷雾离子源) 美国AB公司;Harvard pump Ⅱ针泵 美国Varian公司;Allegra X-12R离心机 美国Beckman公司;涡旋混合器 德国IKA公司;高速均质器 美国Tomtec公司;旋转蒸发仪 日本Eyela公司。
1.3 方法
1.3.1 溶液配制
标准储备液:分别准确称取丙硫咪唑及其3种代谢物标准品10.0mg,至于10mL容量瓶中,用乙腈溶解并定容,配成1.0g/L的标准储备液;混合标准溶液:分别移取标准储备液,用乙腈稀释成1×10-3g/L的混合标准溶液。
1.3.2 样品制备
准确称取肉样5.0g于50mL离心管中,加入15mL乙腈,高速匀浆,3500r/min离心,上清液经无水硫酸钠转入梨形瓶中。10mL乙腈重复上述操作,乙腈层减压浓缩至干。用2mL 90%乙腈溶解残渣,加入5mL乙腈饱和的正己烷,涡旋,弃去正己烷层,下层过0.2μm滤膜,待进样测定。
1.3.3 分析条件
色谱条件:色谱柱为Agilent Eclipes XDB-C18液相色谱柱(150mm×4.6mm i.d.,5μm);预柱为Phenomenex C18(3.0mm i.d.×4.0mm);流动相:乙腈:0.1%甲酸(1:1,V/V)。流速250μL/min,进样量5μL,柱温25℃。
质谱条件:电喷雾离子源(electrospray ionization,ESI),正离子多反应监控(multi-reactions monitoring,M R M)扫描模式,离子源温度4 8 0℃,离子源电压5200V;雾化气、气帘气和辅助气为N2,其中雾化气为0.08MPa,气帘气压为0.05MPa,辅助气流速为6L/min。MRM监测离子对、碰撞电压及去簇电压见表1。
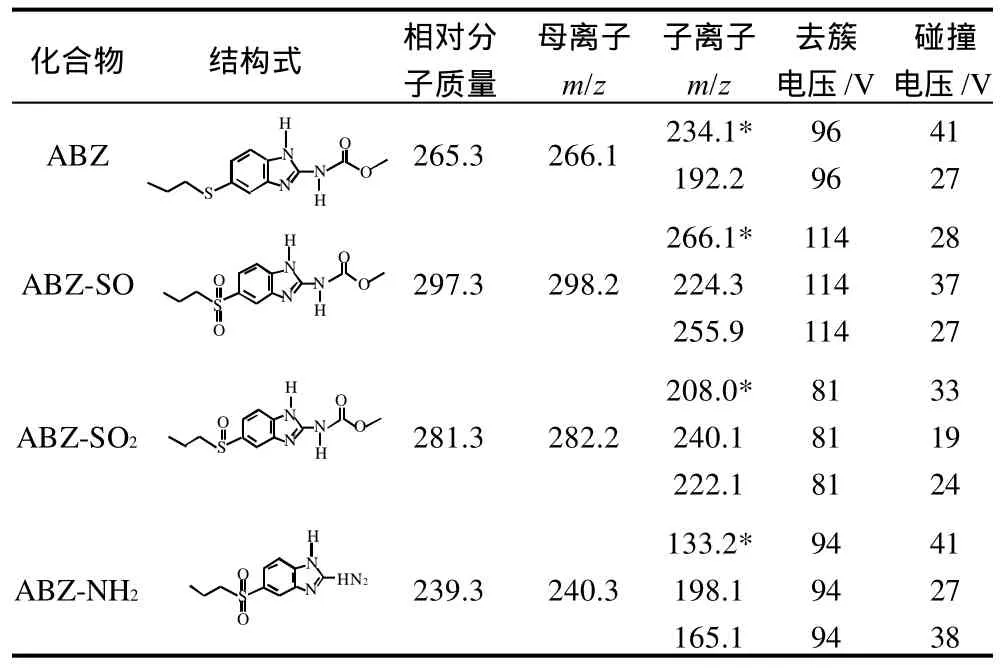
表1 丙硫咪唑及其代谢物的质谱优化条件Table 1 Optimal MS/MS conditions of albendazole and its metabolites
2 结果与分析
2.1 质谱条件的选择
将丙硫咪唑及其3种代谢物标准品溶液采用流动注射直接进样,通过全扫描方式确定其母离子,再对母离子进行二级质谱扫描得到碎片离子,通过优化条件,得到二级质谱图。通过多反应监测(MRM)选择相对丰度较高的离子对为定性定量离子对,并对其去簇电压、碰撞电压等条件进行优化。
2.2 色谱条件的选择
本实验采用Agilent Eclips XDB-C18为色谱柱,用不同的流动相对丙硫咪唑及其代谢物进行分离,结果显示:乙腈:0.1%甲酸溶液(1:1,V/V)为最佳分离体系,在保证有很好的分离效果前提下,运行一个样品大约需要10min,优于文献报道的其他分离体系效果。样品分离谱图如图1所示。

图1 丙硫咪唑及其3种代谢物的MRM色谱图Fig.1 MRM chromatogram showing separaion of albendazole and its metabolites
2.3 样品净化方法的选择
本实验采用正己烷液液萃取的方法对提取液进行去脂净化,去除提取液中脂肪等杂质。丙硫咪唑与2-氨基丙硫咪唑砜性质差别较大,丙硫咪唑是脂溶性物质,而2-氨基丙硫咪唑砜是水溶性物质,在净化时溶剂的选择会影响丙硫咪唑及其代谢物的回收率。为最大效率的去除杂质并保证丙硫咪唑及其代谢物的损失最小,对不同比例的乙腈-水进行考察,通过测定乙腈-水中丙硫咪唑及其代谢物的剩余量确定最佳的乙腈-水比例。具体方法:取0.1mL 100ng/mL的混合标准工作溶液,N2吹干,加1mL不同比例的乙腈-水溶液溶解残渣,然后用1mL乙腈饱和的正己烷进行液液萃取,弃去正己烷层,然后用液相色谱串联质谱分析乙腈-水溶液中丙硫咪唑及其代谢物的量,计算回收率,从而确定最佳的乙腈-水的体积比为90:10。
2.4 线性关系及检出限
用空白样品提取液配制一系列不同质量浓度(10、20、50、100、200、500、1000ng/mL)的混合标准工作溶液依次进样,以组分的峰面积(Y)对相应的质量浓度X/(ng/mL)作标准曲线,并以此作为定量依据。结果表明:r>0.99,丙硫咪唑及其代谢物有良好的线性关系,见表2。对相同质量浓度的标准试样在同一日内的不同时间进行10次重复实验,目标化合物峰面积的相对标准偏差为0.75%~1.26%,说明本方法具有良好的稳定性和重复性。

表2 丙硫咪唑及其代谢物的线性方程、相关系数与检出限Table 2 Linear equations, correlation coefficients and LODs of albendazole and its metabolites
2.5 回收率与精密度
取经测定不含丙硫咪唑及其代谢物残留的猪肉、牛肉、羊肉、鸡肉、香肠样品5.0g,分别添加0.010、0.025、0.050mg/kg含量水平,充分混合均匀,按照本方法进行液相色谱-串联质谱测定,得到丙硫咪唑及其代谢物的回收率和相对标准偏差,结果见表3。添加0.010~0.05mg/kg时的回收率为82.3%~97.6%,相对标准偏差为4.9%~12.9%,符合国家质检总局《残留分析质量控制指南》的要求,可以用作肉及肉制品中丙硫咪唑及其代谢物残留的检测方法。
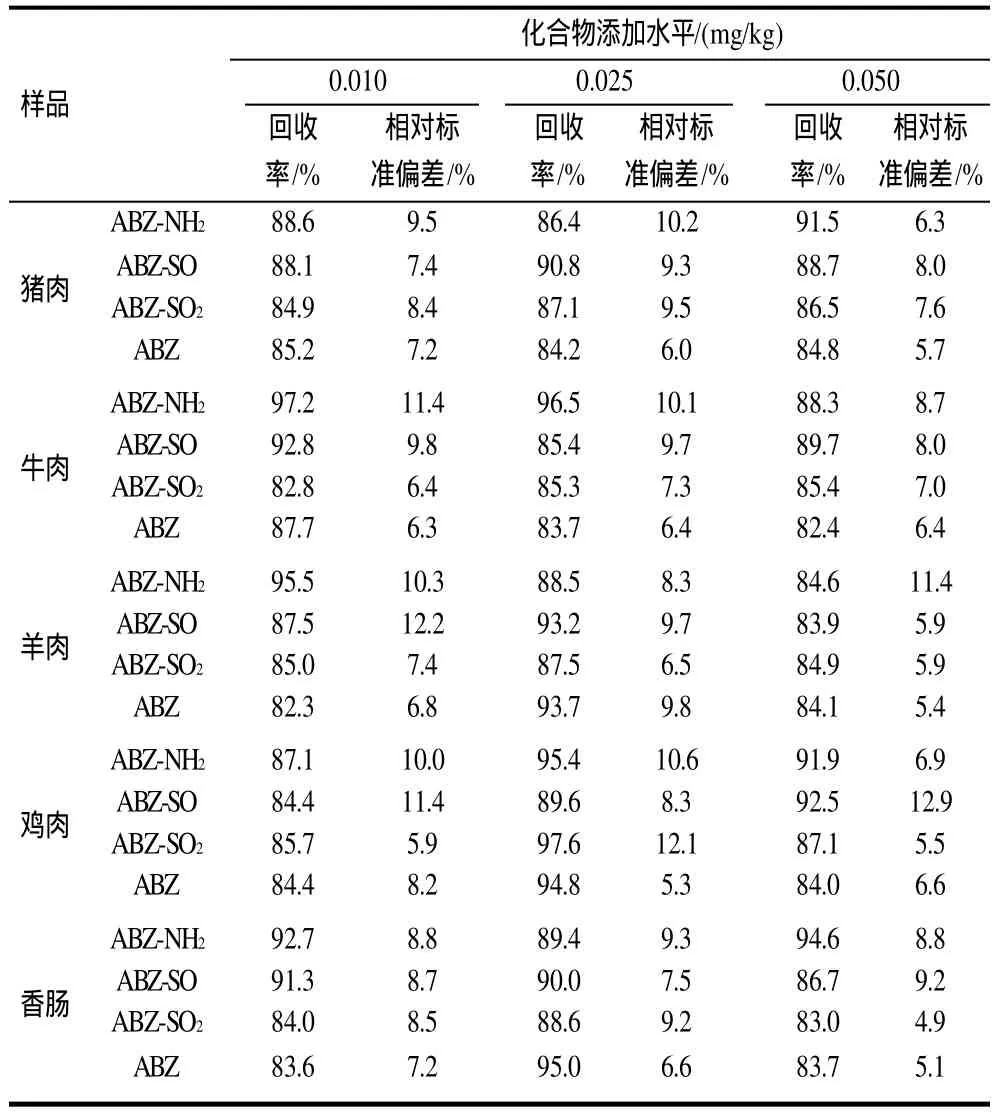
表3 样品的回收率与精密度(n=10)Table 3 Spiked recovery rates and precision (RSD) of albendazole and its metabolites from different samples (n=10)
3 结 论
采用乙腈高速匀浆提取,高效液相色谱-串联质谱法对肉中丙硫咪唑及其代谢物残留的测定进行研究。该方法线性范围宽、线性关系好、重复性好、准确度高,为肉中丙硫咪唑及其代谢物残留的检测建立了检测方法和确证方法。
[1] WU Zimei, MEDLICOTT N J, RAZZAK M, et al. Development and optimization of a rapid HPLC methoc for analysis of ricobendazole and albendazole sulfone in sheep plasma[J]. Journal of Pharmaceutical and biomedical analysis, 2005, 39(1/2): 225-232.
[2] BELAZ K R A, CASS Q B, OLIVEIRA R V, et al. Determination of albendazole metabolites by direct injection of boving plasma and multidimensional achiral-chiral high performance liquid chromatography[J].Talanta, 2008, 76(1): 146-153.
[3] BONATO P S, de OLIVEIRA A R M, de SSNTANA F J M, et al.Simultaneous determination of albendazole metabolites, praziquantel and its metabolite in plasma by high-performance liquid chromatography-electrospray mass spectromety[J]. Journal of Pharmaceutical and biomedical analysis, 2007, 44(2): 558-563.
[4] NOBILIS M, VYBIRALOVE Z, KRIZOVA V, et al. Sensitive chiral high-performance liquid chromatographic determination of anthelmitic flubendazole and its phase I metabolites in blood plasma using UV photodiode-array and fluorescence detection application to pharmacokinetic studies in sheep[J]. Journal of chromatography B, 2008, 876(1):89-96.
[5] 史艳秋, 高学军. 丙硫咪唑对猪囊尾蚴组织化学影响的研究[J]. 黑龙江八一农垦大学学报, 2001, 13(1): 67-69.
[6] JEDZINIAK P, SZPRENGIER-JUSZKIEWICZ T, OLEJNIK M. Determination of benzimidazoles and levamisole residues in milk by liquid chromatography-mass spectrometry: screening method development and validation[J]. Journal of Chromatography A, 2009, 1216(7): 8165-8172.
[7] FLETOURIS D J, PAPAPANAGIOTOU E P, NAKOS D S, et al.Highly sensitive ion paris liquid chromatography determination of albendazole marker residue in animal tissues[J]. Journal of Agriculture and Food Chemistry, 2005, 53(4): 893-898.
[8] SHAIKH B, RUMMEL N, GIESEKER C, et al. Residue depletion of albendazole and its metabolites in the muscle tissue of large mouth and hybrid striped bass after oral administration[J]. Journal of chramatography A, 2009, 1216(9): 8173-8176.
[9] 杜红歌, 谭旭信, 方中意, 等. 高效液相色谱法测定动物肌肉中阿苯达唑及其代谢物[J]. 中国兽药杂志, 2010, 44(1): 52-55.
[10] 于慧娟, 惠芸华, 黄冬梅, 等. 反相离子对液相色谱法测定欧洲鳗鲡体中丙硫咪唑及其代谢物的残留量[J]. 分析科学学报, 2008, 24(6):673-676.
[11] SHAIKH B, RUMMEL N, REIMSCHUESSEL R. Determination of albendazole and its major metabolites in the muscle tissues of Altantic salmon, tilapia, and rainbow trout by high performance liquid chromatography with fluorometric detection[J]. Journal of Agiricultural and Food Chemistry, 2003, 51(11): 3254-3259.
[12] 吴银良, 皇甫伟国. 高效液相色谱法同时测定饲料中8种苯并咪唑类药物[J]. 畜牧与兽医, 2011, 43(4): 73-76.
[13] 徐雪, 董靖, 邓彦红, 等. 猪组织中丙硫咪唑亚砜和砜含量的液质联用测定方法的研究[J]. 动物医学进展, 2011, 32(4): 63-66.
[14] 徐雪. 盐酸丙硫咪唑亚砜在猪体内的药物代谢动力学及残留检测[D].长春: 吉林大学, 2011.
[15] SN 0207—93 出口肉中丙硫咪唑残留量检验方法[S].
Determination of Albendazole and Its Metabolites in Meat by Liquid Chromatography Tandem Mass Spectrometry
FU Xiao-fang,WANG Peng,ZHAO Xiao-ya,LI Jing,SHANG Yin-zhu,YE Cheng
(Center of Technology, Hubei Entry-Exit Inspection and Quarantine Bureau, Wuhan 430050, China)
A liquid chromatography tandem mass spectrometric (LC-MS/MS) method was established for simultaneous determination of albendazole and its metabolites including albendazole sulfone, albendazole sulfoxide and albendazole-2-aminosulfone in meat. Samples were extracted with acetonitrile and cleaned by liquid-liquid extraction. The separation of analytes was performed on an XDB-C18 column with acetonitrile and 0.1% formic acid solution as the mobile phase. The external standard calibration curve was used for quantification. The LOD of albendazole and its metabolites was 0.010 mg/kg. A good linear relationship between peak area and concentration in the range of 0.010-0.050 mg/kg for albendazole and its metabolites was achieved with a correlation coefficient of more than 0.99. The spiked recovery rates and relative standard deviations (RSDs)were 82.3%-97.6% and 4.9%-12.9%, respectively. The method was simple, fast, accurate, convenient, and applicable for qualitative and quantitative determination of albendazole and its metabolites.
albendazole;metabolites;LC-MS/MS;meat
TS255.7
A
1002-6630(2012)08-0180-04
2011-02-22
国家认监委标准修订项目(2009B784r)
付晓芳(1980—),女,工程师,硕士,研究方向为食品安全。E-mail:fuxf@hbciq.gov.cn
