反相高效液相色谱法检测奶粉中含硫氨基酸
2012-10-28李玉玲李卫华杨秀清
李玉玲,李卫华*,杨秀清
(1.山西大学生物技术研究所,山西 太原 030006; 2.山西出入境检验检疫局,山西 太原 030024)
反相高效液相色谱法检测奶粉中含硫氨基酸
李玉玲1,李卫华2,*,杨秀清1
(1.山西大学生物技术研究所,山西 太原 030006; 2.山西出入境检验检疫局,山西 太原 030024)
目的:建立奶粉中含硫氨基酸反相高效液相色谱检测方法,为含硫氨基酸检测提供新思路。方法:用常规酸水解和氧化水解法水解奶粉,对水解条件和色谱分离和检测条件进行研究,用反相高效液相色谱法测定奶粉中的含硫氨基酸。结果:蛋氨酸(Met)、胱氨酸[(Cys)2]检出限分别为0.7、0.3μmol/L,定量检测范围均为10~300μmol/L,相关系数分别为0.9993、0.9992。经酸水解和氧化水解处理的奶粉,所测得的Met含量无显著差异,均为0.43g/100g,(Cys)2的含量则分别为0.06、0.14g/100g,差异显著。结论:奶粉中Met含量的高效液相色谱HPLC检测可选用酸水解或氧化水解中任一种前处理方法,(Cys)2含量的测定只能采用氧化法进行前处理。
奶粉;乳蛋白;含硫氨基酸;高效液相色谱法
奶粉是我国最主要的乳制品品种,产值约占乳制品工业总产值的三分之一[1]。奶粉中的乳蛋白包含人体生长发育所需要的全部必需氨基酸,是一种全价蛋白质,也是人体补充热量的来源[2]。乳蛋白中的含硫氨基酸(蛋氨酸、半胱氨酸/胱氨酸)对人和动物的生理功能具有重要的作用,其代谢反常往往是一些疾病的重要表征。因此,在临床、营养、动物科学与农业科学领域对含硫氨基酸的准确测定有着重要的意义[3-4]。含硫氨基酸在游离或肽键合状态都不稳定,易于发生氧化、烷基化等反应而影响其检测的准确性,国内外学者在这方面进行了大量的研究。在使用离子交换色谱前处理方法时,提出补偿校正法、化学保护法、氧化法、还原衍生法等解决方法,但大多存在一些问题[5]。常碧影[6-8]、钱爱萍[9]、徐洁[10]、杨元秀[11]等对检测饲料中含硫氨基酸的前处理方法进行了研究;于淑新等[12]采用高效液相色谱法测定饲料中含硫氨基酸。本研究对苯酚保护巯基的酸水解法和过甲酸氧化含硫氨基酸生成磺基丙氨酸和蛋氨酸砜的氧化水解法两种前处理方法进行比较。用新型衍生剂4-氯-3,5-二硝基三氟甲苯(4-chloro-3,5-dinitrobenzotrifluoride,CNBF)对奶粉的蛋白水解液进行柱前衍生,反相高效液相色谱方法进行氨基酸检测。通过对两种水解方法检测结果的比较,确定蛋氨酸和(半)胱氨酸两种含硫氨基酸的最佳检测条件,从不同角度为奶粉中含硫氨基酸的检测提供新的思路。
1 材料与方法
1.1 材料与试剂
奶粉 市售。
婴儿奶粉标准品 美国Fapas公司;高纯L-氨基酸(>98%):蛋氨酸(Met)、胱氨酸[(Cys)2]、半胱氨酸(Cys)、磺基丙氨酸(CysA)、蛋氨酸砜[Met(O2)] 北京日出生物科技有限公司;4-氯-3,5-二硝基三氟甲苯(CNBF) 太原市瑞和丰科贸有限公司;乙腈(色谱纯)天津市科密欧化学试剂有限公司;浓盐酸(优级纯) 天津市北联精细化学品开发有限公司;超纯水(由Milli-Q纯水机制备);25、100mmol/L 4-氯-3,5-二硝基三氟甲苯(CNBF)溶液;常规过甲酸溶液:30%过氧化氢与88%甲酸按1:9(V/V)混合,室温放置1h,置冰水浴中冷却30min,临用前配制;40mmol/L氨基酸标准溶液;其他试剂均为分析纯。
1.2 仪器与设备
Alliance2690高效液相色谱仪、ACQUITY超高效液相色谱仪(光电二极管矩阵检测器,用于光谱扫描) 美国Waters公司;资生堂CAPCELL PAK C18柱 北京泰克美科技有限公司;DF-15L型氮吹仪供氮机 杭州德克尔实验设备有限公司;101A-3型干燥箱 上海市实验仪器总厂;Minispin离心机 德国Eppendorf公司;1008型恒温水浴锅 德国GFL公司; PB-10酸度计 德国Sartorious公司;G-560E Vortex-Genie2-涡旋振荡器 美国Scientific Industries公司;0.22μm针筒过滤器 天津博纳艾杰尔科技有限公司。
1.3 方法
1.3.1 样品前处理
酸水解法:准确称取样品适量,加入3.0mL 6mol/L HCl溶液(含0.1%苯酚),-20℃冷冻,N2吹,在吹N2状态下封口,110℃水解24h。水解结束后取出冷却至室温,开封,用pH9.0硼砂-硼酸缓冲液定容到10mL,混匀,静置,离心。取上清液于40℃ N2吹干,用pH 9.0硼砂-硼酸缓冲液溶解,混匀,振荡加入CNBF衍生。
氧化水解法:准确称取样品适量,冰水浴30min后加入2.0mL已冷却的过甲酸溶液,封口,冰水浴氧化16h。氧化结束,开口,加入0.3mL 48%氢溴酸,轻轻摇匀,继续冰水浴30min后取出,40℃ N2吹干。再加入6mol/L HCl溶液3.0mL,摇匀,N2吹干,封口,110℃水解24h。水解结束后取出,处理方法同酸水解法。
1.3.2 样品衍生
准确吸取1.0mL样品溶液于带盖试管中,振荡并加入5.0mL pH9.0硼砂-硼酸缓冲液及2.0mL CNBF溶液,盖好盖子,封口,放入65℃水浴40min。衍生结束后取出,放置至室温,振荡并加入17mL pH7.0磷酸缓冲液,振荡0.5min,再静置10min,取适量液体用0.22μm过滤器过滤至上机小瓶,待用。
1.3.3 反相高效液相色谱法检测条件
流动相A:乙腈;流动相B:乙酸-乙酸钠缓冲液pH6.8;检测波长:240nm;流速:0.32mL/min;色谱柱:C18MGⅡ(5μm,4.6mm i.d.×250mm);梯度洗脱:0~15min,20%A、80%B;15~35min,38%A、62%B;35~38min,48%A、52%B;38~42min,49%A、51%B;42~50min,75%A、25%B;50~55min,75%A、25%B;55~65min,20%A、80%B)。
1.3.4 前处理方法的优化
准确称取适量奶粉标准品(精确到0.0001g),分别采用酸水解法、氧化水解法水解奶粉中的蛋白质,通过不同量的奶粉标准品单因素试验、安培瓶与水解管水解比较实验、不同盐酸及过甲酸用量氧化水解实验、奶粉标准品及标准氨基酸精密度及回收率实验,确定奶粉中含硫氨基酸的最佳前处理方法。
2 结果与分析
2.1 不同标准氨基酸的色谱峰分离效果比较

图1 CysA、Met(O2)标准氨基酸色谱图Fig.1 Chromatogram showing the separation between CysA and Met(O2)

图2 Met、(Cys)2标准氨基酸色谱图Fig.2 Chromatogram showing the separation between Met and (Cys)2
奶粉中分解所得到的含硫氨基酸为(Cys)2和Met,在对奶粉进行常规酸水解时得到的是这两种氨基酸;当用过甲酸处理后,巯基和二硫键被氧化成磺酸基,生成CysA;Met与过甲酸作用则生成Met(O2)。图1显示,当使用CysA和Met(O2)作为标准氨基酸检测时,可获得较好的分离效果。色谱峰的分离受温度影响较小,18~26℃范围内都能够较好分离;图2显示,当检测Met和(Cys)2两种标准氨基酸时,二者的色谱峰与衍生剂的水解产物的出峰时间较接近,不易分离,且对温度条件要求比较严格(19~21℃)。采用氧化水解法处理奶粉时得到的是氨基酸的氧化产物CysA和Met(O2),而采用常规酸水解法水解奶粉时得到的是Met和(Cys)2,在选择水解方法时要考虑色谱峰的分离效果。
2.2 方法检测限及线性范围
准确吸取 Met、(Cys)2、CysA、Met(O2)氨基酸标准液适量,用pH9.0硼砂-硼酸缓冲液以倍比稀释法分别配制300、200、100、60、30、10μmol/L六个不同浓度的混合标准溶液,上机检测后,以氨基酸浓度为横坐标,吸收峰面积为纵坐标做标准曲线,得到标准氨基酸的分离色谱图(图1、2),其检测限及线性范围结果见表1。
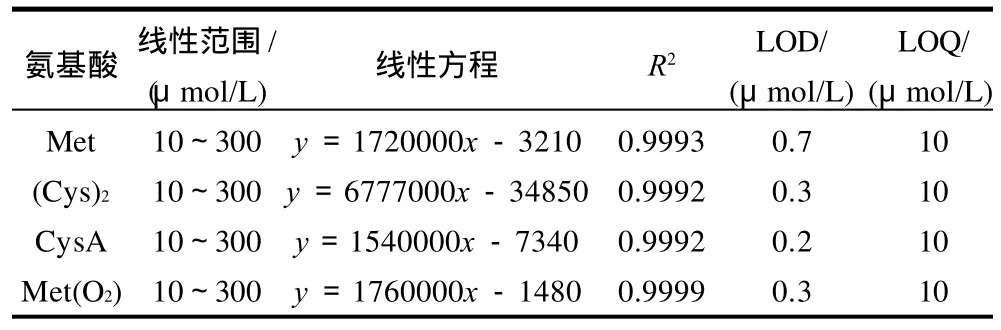
表1 标准氨基酸的方法检测限及线性范围Table1 Detection limits and linear ranges of the developed method for standard amino acids
由表1可见,在信噪比RSN≥3的情况下,4种标准氨基酸的最低检出限(limit of detection,LOD) 值小,Met和(Cys)2检出限分别为0.7、0.3μmol/L检测灵敏度高;RSN≥10时,最低定量限(limit of quantity,LOQ)低且在10~300μmol/L定量范围内相关系数R2≥0.9992,均线性良好,可作标准曲线用。
2.3 不同样品量对蛋氨酸检测结果的影响
将3份不同量的奶粉分别于安培瓶中按1.3.1节方法处理后进行测定,结果如图3所示。可以看出,随样品量的增加,Met测定值逐渐增大,不同样品量Met均有很好的回收率,样品量为30mg时回收率最佳。
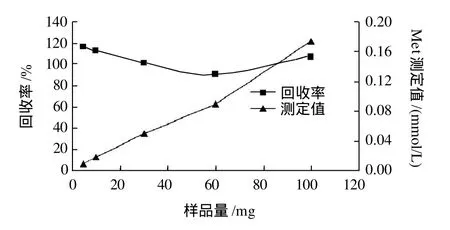
图3 不同样品量对Met检测的影响Fig.3 Effect of sample amount on the determination of methionine
2.4 盐酸及过甲酸用量对检测结果的影响
采用不同量的盐酸和过甲酸对奶粉进行水解,结果见表2。从A~E组,(Cys)2及Met含量逐渐升高,且E组(Cys)2及Met含量最高,说明30mg奶粉样品在加入2mL过甲酸、0.3mL 48%氢溴酸、3mL 6mol/L HCl溶液的前处理条件为含硫氨基酸的理想检测条件。
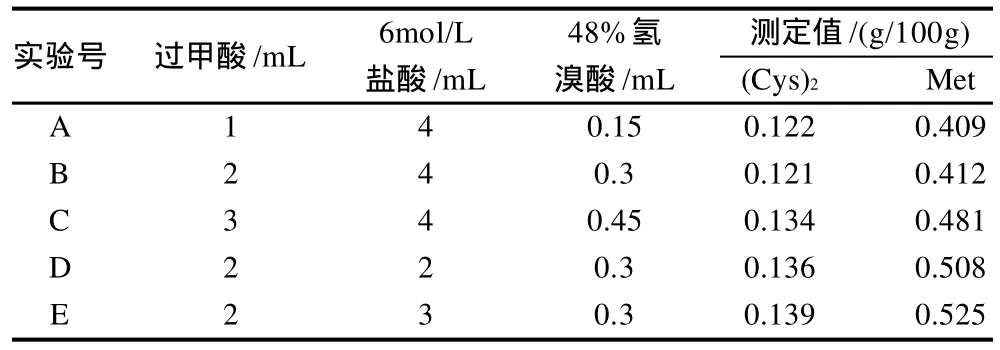
表2 盐酸及过甲酸用量对含硫氨基酸检测结果的影响Table 2 Effect of adding different amounts of hydrochloric acid and peroxyformic acid for sample pretreatment on the determination of sulfur-containing amino acids
2.5 奶粉标准品检测
用已知Met、(Cys)2标准值范围的奶粉标准品分别经酸水解和氧化水解后,结果见表3。可以看出,经酸水解和氧化水解后Met测定值均符合标准值范围,说明两种前处理方法对Met含量测定均没有影响;经氧化水解后,(Cys)2测定值在标准值范围内,但经酸水解后其测定值则低于标准值范围,说明奶粉经酸水解后(Cys)2损失较大,不能得到准确的检测结果。

表3 奶粉标准品含硫氨基酸的测定值Table 3 Determination results for sulfur-containing amino acids in standard milk powder pretreated by different methods
2.6 精密度及回收率实验
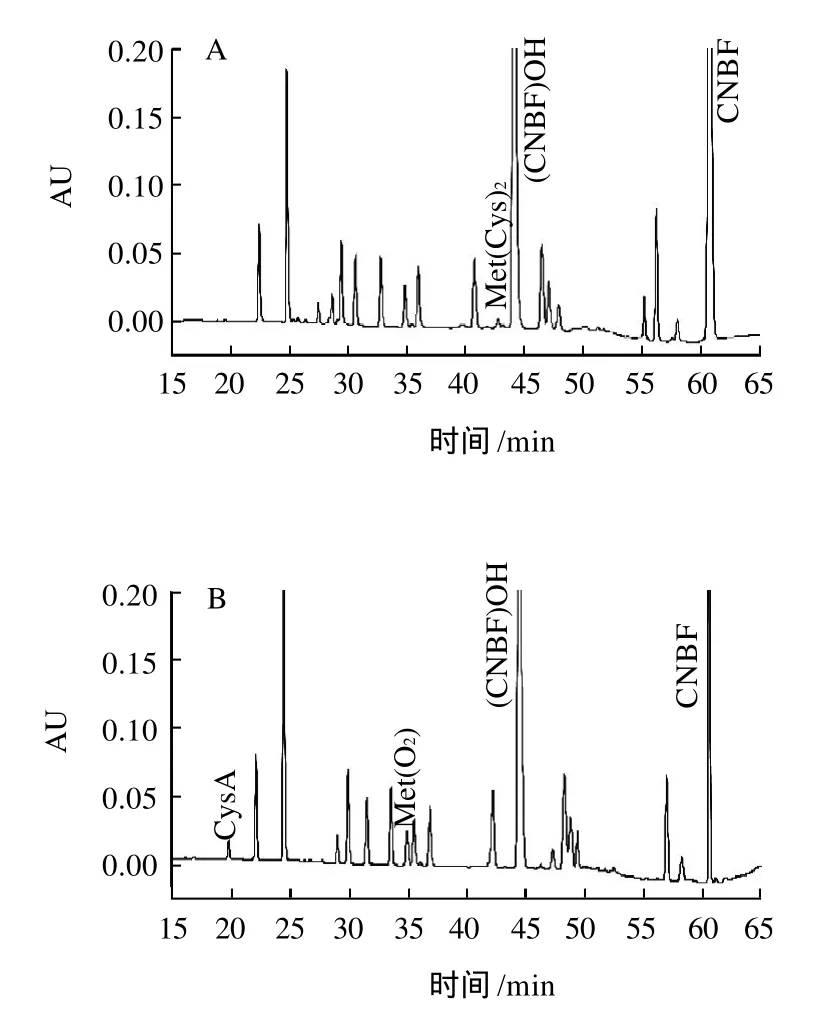
图4 奶粉样品酸水解(A)及氧化水解(B)色谱图Fig.4 Chromatogram of milk powder pretreated by different methods
由图4A可见,Met、(Cys)2与(CNBF)OH有效分离;图4B中Met、(Cys)2分别氧化成的Met(O2)、CysA与其他氨基酸完全分离,满足检测要求。图4中未标色谱峰为奶粉中的其他氨基酸。
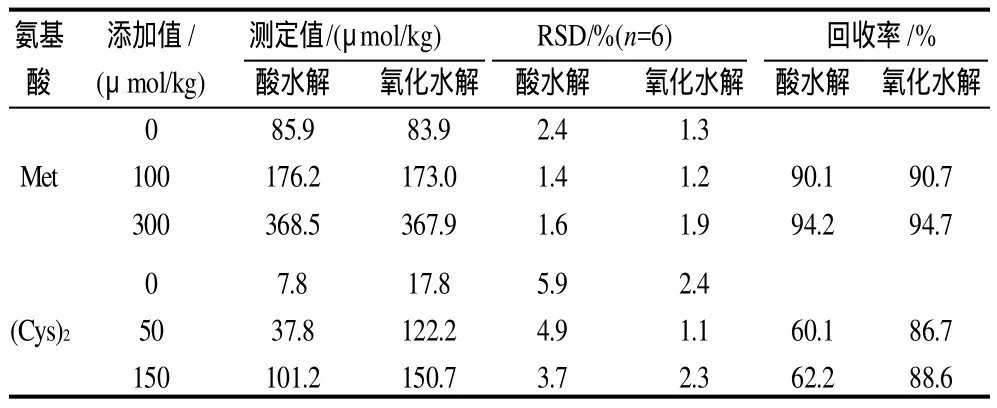
表4 奶粉样品中氨基酸加标回收结果Table 4 Spiked recovery rates of sulfur-containing amino acids in standard milk powder
由表4可以看出:酸水解及氧化水解后Met含量均在85μmol/kg(0.43g/100g)左右,且RSD值小,加标回收率高,说明这两种方法均可检测奶粉样品中Met含量,氧化水解方法精密度更好。酸水解后(Cys)2含量为7.8μmol/kg(0.06g/100g),氧化水解后(Cys)2含量为17.8μmol/kg(0.14g/100g),酸水解含量仅为氧化水解的一半,且RSD值高,加标回收率低,说明(Cys)2在酸水解过程中容易被破坏,用氧化水解法检测精密度良好,加标回收率高。
3 结 论
本研究确立了奶粉中含硫氨基酸的反相高效液相色谱检测方法,方法的最佳前处理条件为在30mg奶粉样品中加入3.0mL 6mol/L HCl溶液(含0.1%苯酚),使用安培瓶的酸水解;或30mg奶粉样品中加入2.0mL过甲酸氧化,0.3mL 48%氢溴酸终止氧化反应,再加入3.0mL 6mol/L HCl溶液水解的氧化水解。奶粉样品经酸水解及氧化水解两种方法处理后,可用反相高效液相色谱法法准确测定蛋氨酸含量,但采用氧化水解方法处理后蛋氨酸含量的精密度较好;胱氨酸在酸水解过程中损失较为严重,影响检测的准确性,氧化水解前处理后用HPLC方法检测能够得到准确的结果。
[1] 钱博. 乳粉蛋白质快速检测方法的研究[D]. 杭州: 浙江大学, 2006.
[2] 孔保华. 乳品科学与技术[M]. 北京: 科学出版社, 2004: 40-80.
[3] 霍湘, 王安利, 杨建梅. 含硫氨基酸的抗氧化作用[J]. 生物学通报,2006, 41(4): 3-4.
[4] GRIMBLE R F. The effects of sulfur amino acid intake on immune function in humans[J]. The Journal of Nutrition, 2006, 136(6): 1660-1665.
[5] 常碧影, 阎惠文, 张明, 等. 食品词料中含硫氨基酸测定方法的研究[J]. 中国粮油学报, 1994, 9(1): 49-55.
[6] 张明, 常碧影. 大豆籽粒含硫氨基酸测定方法试验研究[J]. 大豆科学, 1994, 13(1): 81-82.
[7] 常碧影, 阎惠文, 张明, 等. 高盐食品饲料中蛋氨酸与胱氨酸测定方法研究[J]. 中国农业科学, 1994, 27(5): 82-88.
[8] 常碧影, 李建凡, 张明. GB/T 15399-94饲料中含硫氨基酸测定方法: 离子交换色谱法[S]. 北京: 中国标准出版社, 1995.
[9] 钱爱萍, 徐洁. 饲料中含硫氨基酸测定前处理方法探讨[J]. 福建农业科技, 1999(1): 15-17.
[10] 徐洁, 钱爱萍. 提高饲料中含硫氨基酸回收率的前处理方法[J]. 福建分析测试, 1996, 5(4): 583-587.
[11] 杨元秀, 周孝治. 氨基酸分析仪测定饲料及其原料中的含蔬氨基酸[J]. 检测分析, 2009(2): 40-42.
[12] 于淑新, 冯思, 孙远社, 等. 高效液相色谱-柱前衍生化法测定饲料中的含硫氨基酸[J]. 色谱, 2011, 29(3): 239-243.
[13] 戚平, 梁智安, 曾涛. 含乳饮料中主要氨基酸含量合理性的灰色关联分析[J]. 现代食品科技, 2009, 25(3): 333-334.
[14] 王浩, 张志国, 常彦忠, 等. RP-HPLC 法对乳制品中主要牛奶蛋白的分离及定量测定[J]. 食品科学, 2009, 30(24): 376-377.
[15] 何执静, 彭世明. 脑卒中患者血浆中含硫氨基酸的测定[J]. 氨基酸和生物资源, 1997, 19(4): 32-35.
[16] IWASE H, OZAWA S. Determination of amino acids in human plasma by liquid chromatography with postcolumn ninhydrin derivatization using a hydroxyapatite cartridge for precolumn deproteination[J]. Chromatography B, 1995, 663(6): 15-24.
[17] GOFF J B, GATLIN D M. Evaluation of different sulfur amino acid compounds in the diet of red drum, Sciaenops ocellatus, and sparing value of cystine for methionine[J]. Aquaculture, 2004, 241(4): 465-477.
[18] SURESH BABU S V, SHAREEF M M. HPLC method for amino acids profile in biological fluids and inborn metabolic disorders of aminoacidopathies[J]. Indian Journal of Clinical Biochemistry, 2002,17(2): 7-26.
[19] BARTOLOMEO M P, MAISANO F. Validation of a reversed-phase HPLC method for quantitative amino acid analysis[J]. Journal of Biomolecular Techniques, 2006, 17(2): 131-137.
Determination of Sulfur-Containing Amino Acids in Milk Powder by Reverse-Phase High Performance Liquid Chromatography
LI Yu-ling1,LI Wei-hua2,*,YANG Xiu-qing1
(1. Bio-technology Institute, Shanxi University, Taiyuan 030006, China;
2. Shanxi Entry-Exit Inspection and Quarantine Bureau, Taiyuan 030024, China)
Objective: To establish a new method for the determination of sulfur-containing amino acids in milk powder by reverse-phase high performance liquid chromatography (HPLC). Methods: Milk powder was subjected to acid hydrolysis or oxidation and subsequent hydrolysis. The optimal hydrolysis conditions and chromatographic separation conditions were investigated. Results: The detection limits of the method for methionine and (Cys)2 were 0.7μmol/L and 0.3μmol/L, respectively,and the linear ranges were both 10-300μmol/L with correlation coefficients of 0.9993 and 0.9992, respectively. In addition,no significant difference was observed between the results of methionine content obtained with acid hydrolysis and oxidation and subsequent hydrolysis, which were both 0.43 g/100 g, whereas the (Cys)2 contents were 0.06 g/100 g and 0.15 g/100 g,respectively, showing a significant difference. Conclusion: Both acid hydrolysis and oxidation followed by hydrolysis can be used for the detection of methionine in milk powder, but only the latter is suitable for the detection of (Cys)2.
milk powder;lactoprotein;sulfur amino acids;high performance liquid chromatography
Q517
A
1002-6630(2012)08-0167-04
2011-08-26
国家质检总局科研项目(2010IK157)
李玉玲(1986—),女,硕士研究生,研究方向为生物化学与分子生物学。E-mail:sxlclyl1986@163.com
*通信作者:李卫华(1968—),男,研究员,博士,研究方向为农产品安全。E-mail:aplab@163.com
