离子色谱法检测水果、饮品中的蔗糖、葡萄糖和果糖
2012-10-28周光明熊建飞
张 磊,周光明*,熊建飞
(发光与实时分析教育部重点实验室,西南大学化学化工学院,重庆 400715)
离子色谱法检测水果、饮品中的蔗糖、葡萄糖和果糖
张 磊,周光明*,熊建飞
(发光与实时分析教育部重点实验室,西南大学化学化工学院,重庆 400715)
建立离子色谱法同时分离检测两种水果和两种饮品中的蔗糖、葡萄糖和果糖的分析方法。采用METROSEP CARB 1(150mm×4.0mm)阴离子交换分离柱和脉冲安培检测器,对淋洗分离条件进行优化。确定柱温20℃、淋洗液30mmol/L NaOH溶液,淋洗液流速1.0mL/min,总分析时间25min。在1.0~50.0mg/L范围内蔗糖、葡萄糖和果糖分别呈良好线性。在优化的分离条件下,蔗糖、葡萄糖和果糖的检出限分别为0.085、0.126mg/L和1.072mg/L(进样体积20μL,峰面积定量)。用8.0mg/L蔗糖、葡萄糖和果糖的混标溶液连续5次进样,3种糖峰面积的相对标准偏差分别为6.09%、2.90%和3.03%,保留时间的相对标准偏差分别为2.49%、1.78%和1.79%。样品测定的回收率为83.4%~126.6%。用该方法检测了水果和饮品中的3种糖,效果良好。同时具有操作简单,结果准确,快速有效等优点,可为水果和饮品质量检测提供一个简单有效的方法。
离子色谱;脉冲安培检测;蔗糖;葡萄糖;果糖
水果和饮料中大多都含有不等量的糖类,同时糖类化合物也是维持生命活动的主要能源。现国家标准中对部分水果和饮料中糖类物质种类和含量没有明确规定,只是确定了甜味剂的限量。
目前用于糖类测定的方法很多,对于糖含量测定的文献也较多。其中比色法最为经典,但其所测为单糖和总糖含量,不具备选择性,无法满足检测指标日趋细化的要求[1-2]。由于常见的糖类不易气化并且紫外吸收较弱,气相色谱法[3-4]和毛细管电泳法[5-6]测定时糖类必须经过衍生后方可被检测,操作费时且繁琐。对于常规的液相色谱法[7-8]虽然无需衍生但灵敏度较低,仅适合于常量样品的分析。近年来兴起的离子色谱法处于应用广泛化的趋势[9-11],大多采用阴离子交换分离技术和先进的脉冲安培检测器[12-14]分离和测定糖含量,此方法操作简单,结果准确,是一种快速、便捷的检测方法。近十多年对水果[15]和饮料[16-17]中糖进行分离检测的文献较多,但用离子色谱[18]进行检测的较少。
本实验采用离子色谱法同时对橘子、苹果、果缤纷和红茶中的蔗糖、葡萄糖和果糖进行分析,以期为其方法的而建立提供一定科学依据,并为对糖含量有不同需求的消费者提供参考。
1 材料与方法
1.1 材料与试剂
橘子、苹果、果缤纷和红茶 市售。
蔗糖(分析纯)、葡萄糖(分析纯)和D-果糖(生化试剂)成都市科龙化工试剂厂;NaOH(分析纯) 重庆川东化工有限公司;去离子纯水。
1.2 仪器与设备
861 Advanced Compact IC,817 Bioscan脉冲安培检测器、METROSEP CARB 1(150mm×4.0mm)阴离子交换柱、Metrohm IC-Net 2.3色谱工作站 瑞士万通公司;FA2004A电子天平 上海精天电子仪器有限公司;CQ50超声波清洗器 上海必能信超声波有限公司;GM-0.33II隔膜真空泵 天津市腾达过滤器件厂;布氏漏斗、玻塞漏斗、0.45μm微孔滤膜。
1.3 标准溶液的配制
称取蔗糖、葡萄糖和果糖标样0.1000g,用去离子水分别溶于100mL容量瓶中,配制成1000mg/L标准储备液。
用移液管分别移取上述蔗糖、葡萄糖和果糖标准储备液0.1、0.2、0.5、0.8、1.2、1.4、2.0、3.0、4.0、5.0、6.0mL 于100mL容量瓶中,用去离子水定容至刻度。得到蔗糖、葡萄糖和果糖质量浓度为1.0、2.0、5.0、8.0、12.0、14.0、20.0、30.0、40.0、50.0、60.0mg/L的标准溶液。
1.4 样品的预处理
橘子:取橘子一小瓣放于研钵中,将其研磨成均匀糊状,用干净的烧杯称取约0.3g(实称0.3033g),加入约20mL去离子水溶解,并超声30min,然后用布氏漏斗过滤两次,再转移至100mL容量瓶定容,混匀后用0.45μm的滤膜过滤一次,最后转移至100mL容量瓶中待用。
苹果的预处理方法同橘子,实取0.3321g。
果缤纷:用烧杯称果缤纷约0.3g(实取0.3133g),加入约20mL去离子水溶解,并超声30min,然后用布氏漏斗过滤两次,转移至100mL容量瓶定容,混匀后用0.45μm的滤膜过滤一次,最后转移至100mL容量瓶中待用。
红茶的预处理方法同果缤纷,实取0.3342g。
1. 5 色谱条件及测定方法
分离柱:METROSEP CARB 1(150mm × 4.0mm)阴离子交换柱;淋洗液30.0mmol/L NaOH溶液;流速1.0mL/min;进样量20μL;柱温20℃;再生液 200.0mmol/L NaOH溶液;脉冲安培检测;峰面积定量。
2 结果与分析
2.1 淋洗液浓度的选择
离子色谱法分析糖类时最常用的淋洗液是NaOH溶液,本实验分别用5.0、10.0、15.0、20.0、25.0、28.0、30.0、35.0、50.0、100.0mmol/L NaOH溶液进行淋洗。当淋洗液浓度低于20.0mmol/L时,蔗糖和葡萄糖的色谱峰重叠严重。从淋洗液浓度25.0mmol/L开始时,蔗糖峰后移,在葡萄糖峰之后出现,同时蔗糖和葡萄糖的色谱峰分离度逐渐变好。进一步提高NaOH溶液浓度,在其浓度35.0mmol/L时,蔗糖峰与果糖峰出现重叠,分离度变差。当淋洗液浓度为50.0mmol/L 和100.0mmol/L,蔗糖与果糖分离度太差,无法分离。研究表明,随着NaOH浓度降低,各个色谱峰的保留时间也相应延长,根据高效且分离度达到实验要求的原则,选30.0mmol/L NaOH溶液作为淋洗液。由于本实验选择较低浓度的NaOH淋洗液,而脉冲安培检测器是在碱性条件下(pH≥12)的电化学响应下实现的,所以每次进样前需要对色谱柱进行再生处理,否则检测的灵敏度会降低,重现性会变差,本实验采用高浓度N a O H(200.0mmol/L)平衡柱子。
2.2 色谱柱温度选择
选择30.0mmol/L NaOH溶液作为淋洗液,在不同温度情况下考察混标溶液的分离情况。分别设定柱温为15、20、25、30、32、35、40℃,结果表明,随着温度的降低,峰的分离度逐渐变好,但柱压逐渐增大,保留时间也会相应加长。当温度低于20℃时,色谱峰有些变宽。因此为了保护色谱柱和获得较好的分离度综合考虑选择柱温20℃。
2.3 淋洗液流速的选择
调节流速分别为0.5、0.8、1.0、1.2、1.5mL/min,当流速升高时保留时间减小,对峰的分离度影响不大,但柱压会明显增大,柱压最大不超过12MPa。因此,为了保护色谱柱,同时也尽量缩短分析时间,选用1.0mL/min 作为淋洗液流速。
2.4 定性分析
将配制好的葡萄糖标准溶液在确定好的色谱条件(淋洗液30.0mmol/L NaOH溶液、流速1.0mL/min、进样量20μL、柱温20℃)下进行进样检测(图1),确定其出峰时间大约在12min,再向其中加入蔗糖标准溶液进行检测,确定其出峰时间大约在14min,最后向含有葡萄糖和蔗糖标准溶液的混标溶液中加入果糖标准溶液进行检测,确定其出峰时间大约在16min。此步定性分析是为样品检测的定量分析做好准备。
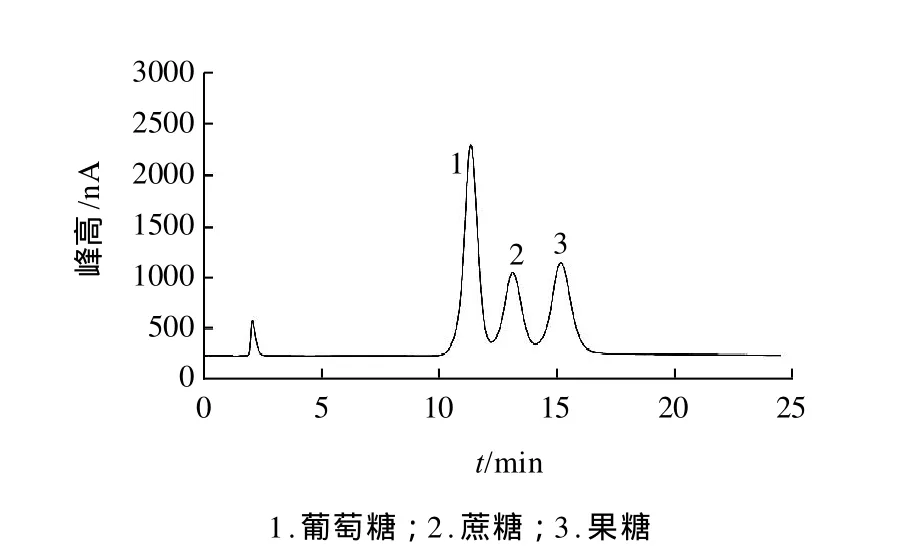
图1 标准样品色谱图Fig.1 Chromatogram of a mixture containing glucose, sucrose and fructose standards
2.5 标准曲线的绘制与检出限的测定
以3种单糖的色谱峰面积(Y)对其质量浓度(X)进行线性回归,并进一步稀释标准溶液,在信噪比为3时测定其最低检出限。线性关系回归方程、相关系数、线性范围和检出限见表1。
所绘制的标准曲线没有过坐标原点,说明存在基质效应,即在所配制的溶液中其他物质对被分析物产生的影响和干扰。为了消除或降低基质效应,尽可能保持样品中基质不变,让标准溶液的基体与样品匹配,提高检测精度。采用的方法有:选择合适的样品预处理方法,尽可能除去杂质;在保证灵敏度的情况下,采用小进样体积,可以适当降低基质效应;优化色谱柱的分离条件,从而达到很好的分离效果,降低其他物质干扰。对比测定的标准色谱图(图1)与样品色谱图(图2)可知,除开始出现的小负峰、第一个可能是醇峰的正峰以及待测物质峰外无其他杂质峰,这说明标准曲线和测定结果可信。同时由回收率测定结果可知,基质效应对样品中物质含量的测定影响不是很大,与以往的参考文献对比,结果是在其范围内的。综上,基质效应对本实验的测定结果影响不大,标准曲线可作为定量依据。
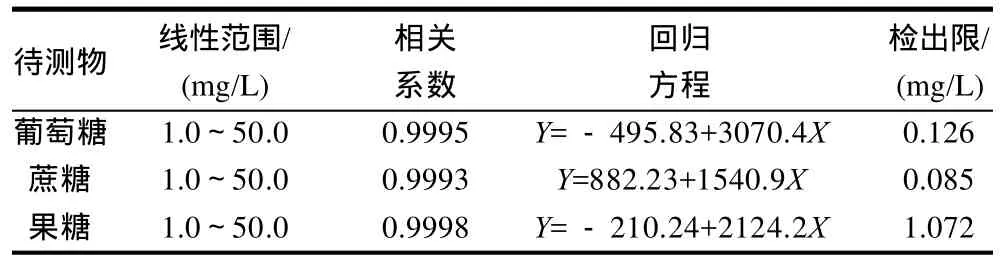
表1 标准品线性回归方程、线性范围和检出限Table 1 Linear regression equations, linear ranges and detection limits of glucose, sucrose and fructose
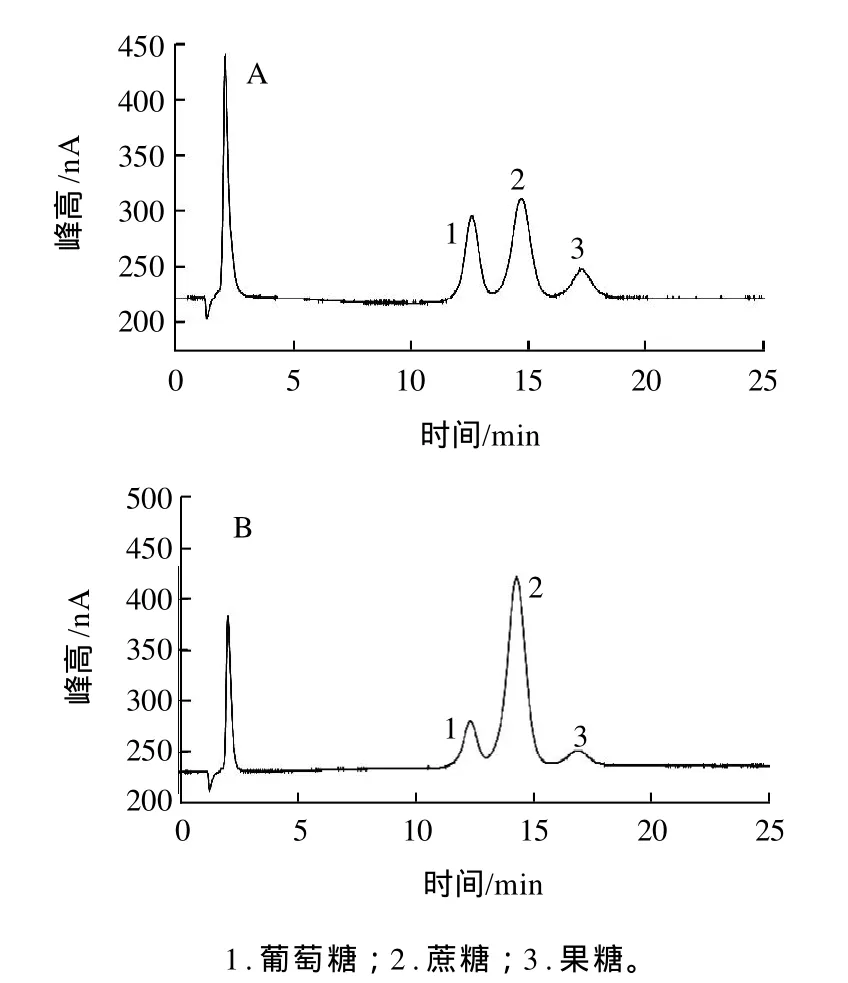
图2 橘子(A)和果缤纷(B)样品色谱图Fig.2 Chromatograms of orange and drink samples
2.6 样品色谱图与测定结果
将处理好的样品溶液按照色谱条件进行色谱分析,色谱图见图2,两种水果和两种饮料中各糖含量见表2。

表2 两种水果和两种饮料中葡萄糖、蔗糖和果糖的含量Table 2 Contents of glucose, sucrose and fructose in two kinds of fruits and two kinds of drinks
由表2可知,苹果中含有大量的果糖,而蔗糖由于含量未在检出限内而无响应信号,葡萄糖含量相对较多。对于橘子,其中3种糖的含量适中,而对于两种饮品来说,它们含有的蔗糖相对较高,特殊人群应慎重选择。
2.7 重现性实验
取8.0mg/L葡萄糖、蔗糖和果糖混合液,按照2.5节色谱条件分别连续进样7次,考虑到实验仪器的不稳定性,弃去前两次取后5次的结果,得到葡萄糖、蔗糖、果糖的峰面积测定值的相对标准偏差(RSD)分别为2.90%、6.09%、3.03%,保留时间的相对标准偏差(RSD)分别为1.78%、2.49%、1.79%。
2.8 加标回收率实验
重新称取各物质各两份(取样量与之前样品测定近似),第1份加入约20mL去离子水溶解,并超声30min,然后用布氏漏斗过滤两次,转移至100mL容量瓶定容,混匀后用0.45μm滤膜过滤一次,最后转移至100mL容量瓶中混匀待测。第2份根据之前样品测定中各葡萄糖的含量进行加标,并将其一同进行预处理操作,最后上机检测。由于两次的质量不能完全相同,这样会给假设相同质量下进行的结果带来很大影响,因此要对实验数据进行校正。本实验是将其校正成0.3000g下各物质中各糖含量。由于样品前处理、溶液移取以及测定时系统的不稳定性等因素都会对这种痕量测定结果产生影响,所以对于测定结果在83.4%~126.6%之间波动,并有超过100%的情况都是可以接受的,加标回收结果见表3。

表3 加标回收率实验结果Table 3 Results of spike recovery tests
3 结论与讨论
本实验建立两种饮料和两种水果中的葡萄糖、蔗糖以及果糖的离子色谱检测法,依据糖类在强碱性条件下离子化的特点,使用阴离子交换色谱柱进行分离,再通过脉冲安培检测器进行检测。本法操作简便,重复性较好,各种糖类的分离度好,无需衍生,且具有更好的选择性和更高的灵敏度,有效的保证了样品中3种糖测定结果的准确性。同时进行加标回收率实验,结果不是特别理想,但由于样品前处理、溶液移取以及测定时系统的不稳定性等因素都会对这种痕量测定结果造成影响,所以结果是可以接受的,该方法的准确性是可信的。综合实验数据分析可知,应用离子色谱法测糖实用性强,具有一定的应用价值。
[1] 姜岷, 姚嘉曼, 陈可泉, 等. 改进DNS比色法测定玉米芯水解液的总糖含量[J]. 太阳能学报, 2009, 30(6): 820-823.
[2] 廉上刚, 潘裕华, 刘彦, 等. 蒽酮-硫酸比色法测定天然鸽乳中可利用糖含量的研究[J]. 中国家禽, 2007, 29(16):17-20.
[3] 周建科, 张立, 韩康, 等. 气相色谱法测定焦麦芽中单糖的组成[J].精细化工, 2007, 24(11): 1085-1118.
[4] 崔莉凤, 王微. 气相色谱法测定芦荟及芦荟干粉中的多糖[J]. 色谱,2003, 21(1): 88-90.
[5] 耿越, 赵相轩, 花义山, 等. 高效毛细管电泳法测定蜂蜜中单糖的含量[J]. 食品科学, 2002, 23(1): 114-117.
[6] 赵燕, 刘莉, 杨兴斌, 等. 高效毛细管电泳法测定唐古特大黄多糖中单糖的组成[J]. 医药导报, 2005, 24(11): 981-983.
[7] 孟伊娜, 张瑞廷, 史强, 等. 高效液相色谱法测定甜高粱茎秆中3种糖含量[J]. 中国农学通报, 2010, 26(8): 90-95.
[8] 周元清, 吴兆录, 史云东, 等. 高效液相色谱法测定烟草料液中的糖[J]. 分析实验室, 2006, 25(9): 72-74.
[9] RONALD A, BURKE, MICHAEL G, et al. Direct determination of polyglucose metabolites in plasma using anion-exchange chromatography with pulsed amperometric detection[J]. Journal of Chromatography B, 1997, 693(2): 353-357.
[10] ALBERTSON P L, ROF C P L. Application of high performance anion exchange-pulsed amperometric detection to the activity of key sucrose metabolizing enzymes in sugarcane[J]. Journal of Chromatography B,2007, 845(1): 151-156.
[11] CLARKE A P, JANDIK P, RCKLIN R D, et al. An integrated amperometry waveform for the direct, sensitive detection of amino acids and amino sugars following anion-exchange chromatography[J]. Anal Chem, 1999, 71(14): 2774-2781.
[12] CATALDI, MASSIMILIANO A, GIULIANA B, et al. Determination of mono-and disaccharides in milk and milk products by high-performance anion-exchange chromatography with pulsed amperometric detection[J].Analytica Chimica Acta, 2003, 485(1): 43-49.
[13] 余娜, 周光明, 朱娟. 离子色谱法检测蜂蜜和葡萄酒中的蔗糖、葡萄糖和果糖[J]. 食品科学, 2010, 31(16): 188-191.
[14] CAI Yaqi, LIU Jingshen, SHI Yali, et al. Determination of several sugar in serum by high-performance anion-exchange chromatography with pulsed amperometric detection[J]. Journal of Chromatograph A, 2005,1085(1): 98-103.
[15] 杨亚玲, 孟冬玲, 孙海林, 等. 固相萃取和高效液相色谱法测定水果中的糖[J]. 云南化工, 2003, 30(2): 28-30.
[16] 唐闻宁. 芦荟饮料中芦荟多糖提取与测定分析[J]. 海南大学学报: 自然科学版, 2001, 19(4): 363-365.
[17] 杨本宏, 郑敏, 陈玉光. 液相色谱法测定玉米乳酸发酵饮料的糖含量[J]. 合肥工业大学学报, 2002, 25(1): 147-149.
[18] 刘晓玲, 李东刚, 史娟, 等. 离子色谱-脉冲安培检测器分析饮料中单糖和二糖[J]. 光谱实验室, 2010, 27(2): 441-445.
Determination of Sucrose, Glucose and Fructose in Fruits and Drinks by Ion Chromatography
ZHANG Lei,ZHOU Guang-ming*,XIONG Jian-fei
(Key Laboratory on Luminescence and Real-time Analysis (Southwest University), Ministry of Education,School of Chemistry and Chemical Engineering, Southwest University, Chongqing 400715, China)
An ion chromatographic method has been developed for the determination of sucrose, glucose and fructose in two kinds of fruits and two kinds of drinks. The analytes were separated on a METROSEP CARB 1 (150 mm × 4.0 mm) anion exchange column using 30.0 mmol/L NaOH as mobile phase at flow rate of 1.0 mL/min and detected with a pulsed amperometric detector. The total time it took to separate the sugars was 25 min. The linear ranges of sucrose, glucose and fructose were 1.0-50.0 mg/L. The detection limits for sucrose, glucose and fructose were 0.085, 0.126 mg/L and 1.072 mg/L (20μL injection, and the quantitative analysis was based on the peak areas), respectively. The RSDs of peak areas for five consecutive determinations of 8 mg/L sucrose, glucose and fructose were 6.09%, 2.90% and 3.03%, respectively. The RSDs of retention time were 2.49%,1.78% and 1.79%, respectively. The recovery rates for the sugars across three spike levels were in the range of 83.4%-126.6%.Satisfactory results were achieved for the determinations of sucrose, glucose and fructose by the method. Meanwhile, the method was simple, accurate, fast, effective and applicable for the quality control of fruits and drinks.
ion chromatography;pulsed amperometric detection;sucrose;glucose;fructose
O657.75
A
1002-6630(2012)08-0159-04
2011-04-16
国家科技重大专项(2008ZX07315);重庆市自然科学基金项目(CSTC,2007BB5370)
张磊(1988—),女,硕士研究生,研究方向为色谱分析。E-mail:z196325@swu.edu.cn
*通信作者:周光明(1964—),男,教授,博士后,研究方向为色谱及其联用技术。E-mail:gmzhou@swu.edu.cn
